活性氧在实验性视网膜脱离后坏死性凋亡中的表达及与RIP-1的关系
2019-04-18丁婕,鲁理,杨南,董凯
丁 婕,鲁 理,杨 南,董 凯
(1.皖南医学院 研究生学院,安徽 芜湖 241002;2.中国科学技术大学附属第一医院 眼科,安徽 合肥 230001)
视网膜脱离(retinal detachment,RD)是指视网膜色素上皮层、神经感觉层分离。尽管该手术治愈率已大为提高,但多数患者视力恢复不佳,究其原因不难发现,视力的丧失主要和视网膜脱离后光感受器细胞死亡情况有关,但这类死亡机制尚未完全明了。坏死性凋亡(Necroptosis)是一种不依赖半胱氨酸蛋白酶(Caspase)的可调控的程序性细胞死亡,它具有凋亡和坏死的共同特征,表现为细胞核凝聚,细胞膜丧失,染色质边聚[1]。Degterev应用半胱氨酸蛋白酶抑制剂z-VAD-FMK抑制凋亡后,发现并不能抑制细胞的死亡,探究其原因发现了一种TNF-α诱导的细胞坏死途径并将其命名为坏死性凋亡[1]。受体相互作用蛋白1(RIP-1)是坏死性凋亡通路中的必须物质,它有其特异性抑制剂Necrostatin-1[2-4]。本课题组的前期研究中,在视网膜脱离后,应用z-VAD-FMK干预发现光感受器细胞凋亡受到抑制,坏死性凋亡明显增加,在此基础上联合Necrostatin-1,不仅抑制RIP-1的表达,细胞的坏死性凋亡也受到显著抑制,在神经功能学上也证实了Necrostatin-1对视网膜具有一定的保护作用[4-6]。但是视网膜脱离后,坏死性凋亡发生的机制仍是讨论的热点。有学者提出,细胞的程序性坏死伴有ROS的产生[7-9]。ROS是生物体内含氧化合物的总称,主要由线粒体产生,众所周知,氧化应激伴有大量的活性氧堆积,但是在视网膜脱离模型中,尚未清楚组织缺血缺氧死亡受体通路激活,ROS是否也参与到坏死性凋亡中。因此,我们通过构建大鼠视网膜脱离模型,采用z-VAD-FMK和Necrostatin-1干预,探讨光感受器细胞坏死性凋亡中是否有ROS的参与并初步探讨ROS与RIP-1的关系,为以后通过干预ROS抑制光感受器细胞死亡,提高患者术后视力奠定实验室基础。
1 材料与方法
1.1 实验动物与模型构建 SD正常成年雄性大鼠60只,体质量270~300 g,安徽医科大学提供。本研究实验操作均严格遵守美国视觉眼科研究学会对动物实验的要求和安徽医科大学对动物实验的规定。参照文献[4]的方法,大鼠腹腔注射10%的水合氯醛麻醉,术前可乐必妥滴眼液(参天制药有限公司)清洗结膜囊,托吡卡胺扩瞳,左眼注入透明质酸钠(1% 美国博士伦公司) 50 μL于视网膜下建立视网膜脱离模型,网膜隆起范围约1/2~2/3。每只大鼠仅左眼建立视网膜脱离模型,每两个视网膜为一个样本,每组6只大鼠。
视网膜取材方法,用10%的水合氯醛行大鼠腹腔麻醉后,用剪刀将结膜囊与眼球分离,暴露眼球后沿神经根部剪断,摘除术眼眼球置于冰上,显微剪沿角巩膜缘位置一圈剪开,剔除眼内容物,显微镊托起视网膜置于PBS中。
1.2 活性氧(ROS)和受体相互作用蛋白1(RIP-1)的表达 在正常对照组和单纯视网膜脱离组,检测视网膜脱离不同时间点(d1、d3、d5、d7、d14)ROS和RIP-1的表达情况,为药物干预做准备。
1.3 z-VAD-FMK和Necrostatin-1干预对ROS表达的影响 取大鼠24只,按照上述方法建立视网膜脱离模型,同时采用微量注射器在视网膜下注射z-VAD-FMK(5 μL,300 μmol/L,Enzo,PA,USA);此为z-VAD-FMK组。将Necrostatin-1 (5 μL,400 μmol/L,Merck,Darmstadt,Germany) 以及 z-VAD-FMK(剂量与前一组一致)视网膜下注射,此为z-VAD-FMK+ Necrostatin-1组。以上实验结果,与正常对照组和单纯视网膜脱离组进行比较,观察药物干预下,ROS表达的变化(浓度参考文献[4])。
1.4 western blot检测 用RIPA裂解液与1%的蛋白酶抑制剂充分裂解,组织匀浆、超声、离心、行BCA蛋白浓度检测定量;取40 μg蛋白上样后凝胶电泳(SDS-PAGE),初始65 V,当蛋白位于浓缩胶、分离胶交界处,提升为125 V;冰上转膜2 h,25 V;5%脱脂牛奶室温封闭40 min;一抗(Cell Signaling Technology 1∶1000)4℃孵育过夜;复温完成时回收一抗,TBST洗膜(10 min×3次);兔二抗(Cell Signaling Technology 1∶5000)室温孵育2 h,TBST洗涤后,ECL显影。
1.5 ROS检测 准确称取30 mg新鲜视网膜,PBS清洗,充分匀浆后离心20 min(3000 r/min),取上清液。参照大鼠活性氧(ROS)酶联免疫分析试剂盒说明书(Andy Gene)进行操作,首先制备标准品的稀释与加样,加入待测样品10 μL和样品稀释液40 μL,37℃温育30 min,配液洗涤后每孔加入酶标试剂50 μL,37℃避光显色15 min,每孔加终止液 50 μL,终止反应。最终在450 nm 波长依序测量各孔的吸光度(OD)值。
1.6 统计学分析 采用SPSS 18.0进行统计分析,实验数据以均数±标准差表示。多组变量之间的比较采用单因素方差分析,两两之间的比较采用q检验。P<0.05为差异有统计学意义。
2 结果
2.1 视网膜脱离后不同时间节点RIP-1及ROS表达的比较 结果显示,视网膜脱离后d1~d14时间节点RIP-1的表达高于attached组(P<0.05);视网膜脱离后d1~ d14时间节点ROS的表达高于attached组(P<0.05)。RIP-1和ROS均于视网膜脱离后第3天达高峰,d3组与其他各组比较差异有统计学意义(P<0.05)。见图1、表1和表2。

图1 western blot检测RIP-1蛋白的表达
表1 视网膜脱离后不同时间节点RIP-1的表达情况

分组nRIP-1attached组30.35±0.02d1组30.58±0.03∗d3组30.72±0.03∗#d5组30.53±0.03∗d7组30.50±0.02∗d14组30.41±0.05∗F58.187P0.000
注:与attached组比较,*P<0.05;d3组与其他各组比较,#P<0.05。
表2 视网膜脱离后不同时间节点ROS的表达情况
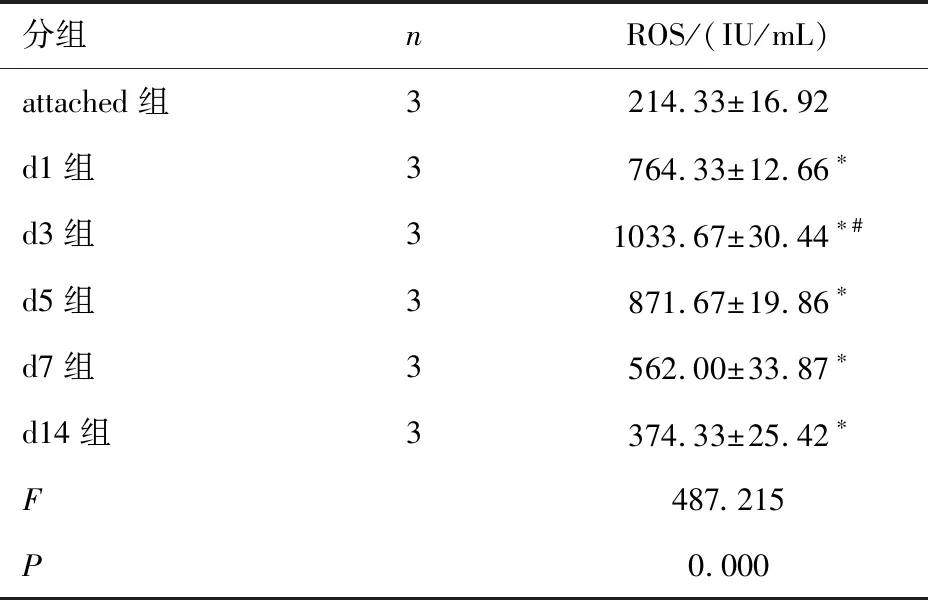
分组nROS/(IU/mL)attached组3214.33±16.92d1组3764.33±12.66∗d3组31033.67±30.44∗#d5组3871.67±19.86∗d7组3562.00±33.87∗d14组3374.33±25.42∗F487.215P0.000
注:与attached组比较,*P<0.05;d3组与其他各组相比,#P<0.05。2.2 各组大鼠ROS表达的比较 根据时间峰值,在进一步实验中,以视网膜脱离第3天为时间节点取视网膜组织进行ROS检测。结果显示,z-VAD-FMK组ROS表达最高,与其他3组相比,差异有统计学意义(P<0.05),而在z-VAD-FMK的基础上,予以Necrostatin-1干预后抑制了ROS表达,虽然高于attached组,但较untreated组及z-VAD-FMK组的ROS表达降低(P<0.05)。见表3。
表3 各组大鼠ROS表达的比较
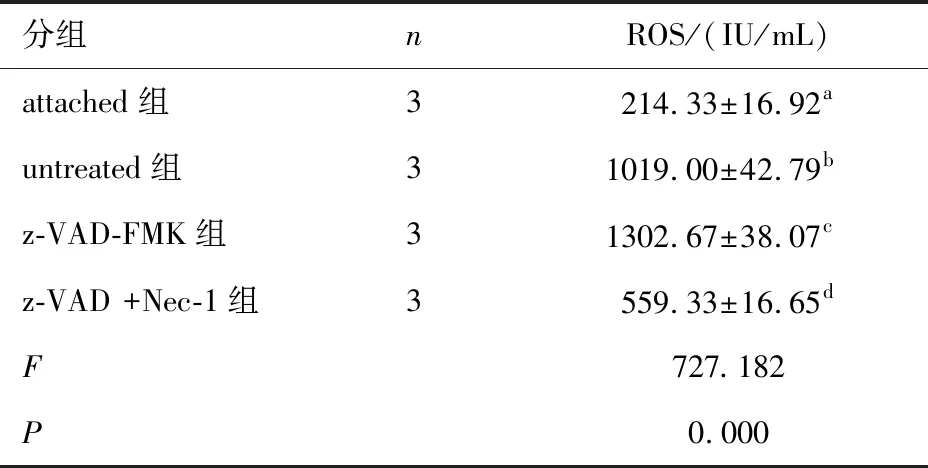
分组nROS/(IU/mL)attached组3214.33±16.92auntreated组31019.00±42.79bz-VAD-FMK组31302.67±38.07cz-VAD +Nec-1组3559.33±16.65dF727.182P0.000
注:多组间两两比较符号不同表示P<0.05。
3 讨论
视网膜脱离属于一种严重致盲性疾病,光感受器细胞死亡会对其视力带来负面作用。视网膜脱离后,感光细胞的坏死性凋亡是近些年研究的热点。我们的研究发现视网膜脱离后,ROS的表达在第3天达高峰,并且可以被RIP-1的特异性抑制剂Necrostatin-1所抑制,ROS可能作为RIP-1的下游共同调控光感受器细胞的坏死性凋亡。
线粒体活性氧簇与程序性细胞坏死之间的关系是各领域长期研究的一个问题。RIP-1作为坏死性凋亡上的关键蛋白,其与ROS之间的关系以及在坏死性凋亡中如何发挥作用是亟待解决的关键点。关于活性氧和程序性细胞死亡的研究早在19世纪末,在对L929小鼠成纤维细胞系研究发现,ROS清除剂能够抑制程序性细胞坏死。在近些年来的研究中,关于活性氧与坏死性凋亡的关系,各学者看法不一。有学者在对Neoalbaconol(NA)诱导肿瘤细胞程序性细胞坏死的机制上研究发现NA可导致RIP-3介导的活性氧的产生,并最终导致细胞出现坏死性凋亡[10]。韩家淮课题组研究出ROS通过氧化RIP-1蛋白上的3个半胱氨酸(C257、C268、C586)和增强第161位(S161)丝氨酸位点进而导致细胞出现程序性细胞坏死[9]。但也有观点认为ROS与坏死性凋亡没有直接联系。RIP-1和RIP-3激酶通过与GLUL、PYGL等糖代谢水平中的关键酶相互作用,通过影响线粒体的代谢而间接提高了ROS 的产生[11]。有学者通过线粒体自噬的结果表明活性氧并不是坏死性凋亡的直接原因,他表示在TNF的刺激下,活性氧的产生只是个伴随现象[12]。更典型的反例是在对TNF诱导的人的结肠腺癌细胞系HT-29的细胞研究中发现细胞程序性坏死与ROS无关[13]。学者们各抒己见,然而在视网膜脱离中,并未见对ROS与坏死性凋亡的直接研究。
我们课题组前期在对视网膜脱离后坏死性凋亡的研究中,发现坏死性凋亡在病理学上表现为细胞及细胞器肿胀,胞膜不完整,胞核凝集,不连续以及自噬泡的产生。z-VAD-FMK使光感受器细胞从凋亡转变为坏死性凋亡,RIP-1表达增加,Necrostatin-1可以抑制RIP-1的磷酸化进而抑制光感受器的坏死性凋亡[4-5]。关于ROS的研究是对课题的延伸与进展,我们发现视网膜脱离后RIP-1、ROS表达升高,并都于第3天达到高峰。与此前课题组对视网膜脱离后光感受器细胞死亡高峰节点相一致[14]。可知ROS与RIP-1在细胞死亡通路上有一定的联系。之后通过z-VAD-FMK和Necrostatin-1联合干预观察ROS表达情况:视网膜脱离后,z-VAD-FMK组ROS表达增加,Necrostatin-1通过抑制坏死性凋亡关键调节蛋白RIP-1,ROS的表达也明显下降。进而得知ROS作为RIP-1的下游共同调控细胞的坏死性凋亡。ROS的检测方法有多种,Trichonas等[3]此前在视网膜脱离后通过检测蛋白质羰基含量得出RIP-1的下游伴有ROS的产生。而我们课题组是通过直接检测视网膜组织中的ROS,得出与其相一致的结果,在今后的实验中我们会进一步用其他方法多方面验证。
关于视网膜脱离后活性氧与坏死性凋亡之间的关系,仍有很多需解决的问题。我们只探究到了视网膜脱离后,ROS作为RIP-1的下游参与到细胞的坏死性凋亡,但具体机制仍需进一步探索。此外,有研究证实自噬可以采用去除受损线粒体或氧化蛋白来下调ROS氧化应激水平,进而促进细胞存活[15-16]。那么在以后的研究中,我们将探索自噬激活后,是否可以通过抑制ROS进而抑制光感受器细胞的坏死性凋亡。通过对活性氧的研究,可以进一步阐释光感受器细胞自噬与坏死性凋亡之间的关系,能够为今后临床上视网膜脱离患者的治疗提供一个新的理论基础及干预靶点,有一定的临床意义。
