双酚A对紫背浮萍生长和光合色素及抗氧化系统影响
2019-04-17梁杰锋马徐发李钰邹沈娟赵博礼侯杰
梁杰锋,马徐发,李钰,邹沈娟,赵博礼,侯杰
华中农业大学水产学院,武汉 430070
双酚A(bisphenol A, BPA),学名2,2-双(4-羟基苯基)丙烷,主要用于生产聚碳酸酯、环氧树脂及牙科填充物等化工产品,这些产品广泛应用于医疗器械、食品罐、婴儿奶瓶和热敏纸等商品中[1]。根据相关资料统计:2005年中国BPA年产能为5.8×104t,截至2015年底,中国BPA年产能达到115×104t[2]。BPA可通过食品途径产生毒性效应,也可通过渗入生态系统间接进入体内[3]。目前BPA在莱州湾和深圳市河流中均被广泛检出[4-5];在日本垃圾渗出液中,BPA检出浓度高达17.2 mg·L-1[6]。BPA会损伤动物生殖发育、遗传物质以及免疫系统[7],增加人体和水生动物的患癌风险[8]。
目前,BPA的毒性效应研究主要集中于动物,对水生植物毒性效应研究相对较少。刘红玲等[9]的研究表明,BPA对斑马鱼有明显的毒性作用,96 h-LC50为9.06 mg·L-1,对鱼卵有致畸作用。Mihaich等[10]研究发现,高浓度(20、50 mg·L-1)BPA导致浮萍(Lemnagibba)叶片密度和生长量显著下降,叶面密度和生长速率7 d-EC50分别为20和32 mg·L-1。Pan等[11]的研究表明,低浓度BPA促进拟南芥幼苗鲜重及侧根数目的增加,高浓度时显示抑制作用。水生植物作为水域环境的重要组成部分,能够为其他生物提供食物和栖息地,在水生生态系统平衡中发挥关键作用,开展BPA对水生植物的生态毒性效应研究具有重要意义。紫背浮萍(Spirodelapolyrrhiza)属紫萍属、浮萍科,叶状体扁平,新个体之间通过短柄相连,具有繁殖快、易培养、能够从水中富集吸收重金属和有机污染物及生长周期短等特点,逐渐成为环境科学和生态毒理学方面研究的理想模式材料[12-13]。
本研究以紫背浮萍为研究对象,探究BPA对其生长、光合色素含量、氧化损伤情况、抗氧化酶活性、抗氧化物质含量以及渗透压调节物质含量的变化特征,探究紫背浮萍在BPA胁迫下,生长与光合作用、氧化损伤及抗氧化系统之间的内在关系,为研究BPA对水生植物的生态毒性机制提供理论依据,旨在为环境内分泌干扰物的生态风险评价提供理论参考。
1 材料与方法(Materials and methods)
1.1 仪器与试剂
仪器:紫外可见分光光度计(UV 2350,尤尼柯(上海)仪器有限公司),台式高速冷冻离心机(Neofuge 15R,中国力康),电子分析天平(BSA224S,德国赛多利斯公司),光照培养箱(GZX-250BSH-Ⅲ,上海新苗医疗制造有限公司),酶标仪(INFINITE 200,瑞士帝肯公司)。
试剂:双酚A(BPA)(≥99%,Sigma-Aldrich公司),二甲亚砜(DMSO)(分析纯,上海化学试剂公司),叶绿素、超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、丙二醛(MDA)、过氧化氢(H2O2)、总抗氧化能力(T-AOC)、抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)、谷胱甘肽(GSH)、可溶性糖含量和可溶性蛋白试剂盒(购自于南京建成生物工程研究所)。
1.2 实验材料
紫背浮萍采自华中农业大学校内池塘,将浮萍浸泡于10%的NaClO和0.1% HgCl22 min除菌,再使用无菌水冲洗后用1/10 Hogland营养液扩大培养4周[14]。
1.3 实验设计
按照经济合作与发展组织(OECD)化学品测试准则中的浮萍急性毒性测试法进行,BPA试剂配制以DMSO为助溶剂,体积浓度为0.1%,对照组加入等量助溶剂[15]。取室内扩大培养后叶片完好、大小相近的1 g浮萍随机放入装有灭菌1 L的1/10 Hogland培养液的烧杯中,培养液和烧杯均进行过高温灭菌,分别添加5个浓度BPA,即0(对照)、1、5、20和50 mg·L-1,每个浓度设置3个平行。紫背浮萍放置于(25±1) ℃光照培养箱中,光暗比为16 h L∶8 h D,光照强度为7 000 lux,2 d更换一次培养液[16],7 d后测定紫背浮萍相关生理生化指标。
1.4 实验指标测定方法
1.4.1 紫背浮萍生长测定
实验结束后,用吸水纸迅速吸干紫背浮萍表面水分,用电子分析天平称量其湿重。
1.4.2 光合色素含量及抗氧化系统指标测定
叶绿素、H2O2、MDA含量,抗超氧阴离子自由基、SOD、POD、CAT、T-AOC、APX和GR活性以及GSH含量的测定均严格按照试剂盒使用说明书进行。
1.4.3 紫背浮萍渗透压调节物质含量测定
可溶性糖和可溶性蛋白含量测定严格按照试剂盒使用说明书进行。
1.5 数据处理
数据以平均值±标准差表示,采用SPSS 21.0统计分析软件,在P=0.05的置信水平对紫背浮萍生理生化指标的变化情况进行单因素方差分析(One-Way ANOVA),并用Graphpad prism 6.01软件绘图(在以下各柱形图中,*表示与对照组相比,P<0.05)。
2 结果(Results)
2.1 BPA对紫背浮萍湿重的影响
不同浓度BPA暴露后,与对照组相比,20 mg·L-1组湿重显著增加(P<0.05),50 mg·L-1组湿重显著降低(P<0.05),其余2组无明显变化(图1)。
2.2 BPA对紫背浮萍光合色素含量的影响
紫背浮萍光合色素含量变化如图2所示,1和5 mg·L-1暴露组的叶绿素a、叶绿素b和总叶绿素含量显著高于对照组(P<0.05),20 mg·L-1组叶绿素a和总叶绿素含量显著高于对照组(P<0.05)。
2.3 BPA对H2O2含量、抗超氧阴离子自由基活性和MDA含量的影响
如图3所示,与对照组相比,5、20和50 mg·L-1暴露组的H2O2含量显著降低(P<0.05),所有BPA处理组的抗超氧阴离子自由基活性显著低于对照组(P<0.05)。与对照组相比,20和50 mg·L-1暴露组MDA含量显著升高(P<0.05)。
2.4 BPA对紫背浮萍抗氧化酶活性的影响
紫背浮萍抗氧化系统响应如图4所示,与对照组相比,BPA处理组的CAT活性显著降低(P<0.05),5、20和50 mg·L-1暴露组POD活性显著降低(P<0.05),所有BPA处理组的SOD和GR活性均显著降低(P<0.05),20和50 mg·L-1暴露组的总抗氧化能力显著降低(P<0.05)。
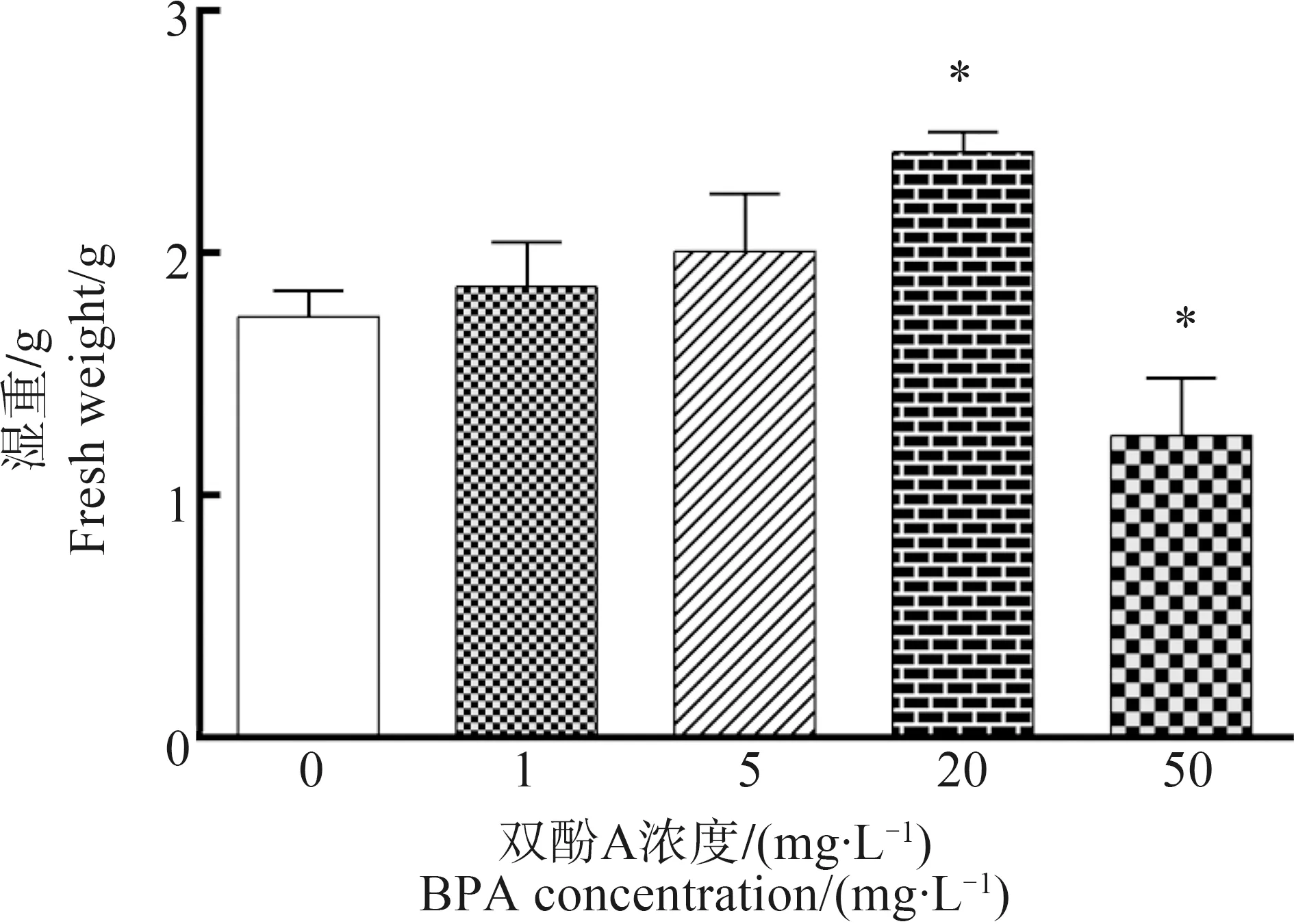
图1 双酚A(BPA)对紫背浮萍湿重的影响注:*P<0.05表示与对照组相比差异显著;下同。Fig. 1 The effect of bisphenol A (BPA) on fresh weight of Spirodela polyrrhizaNote: *P<0.05, compared with the control; the same below.
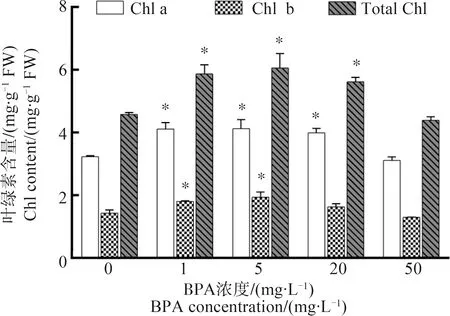
图2 BPA对紫背浮萍光合色素含量的影响Fig. 2 The effect of BPA on the photosynthetic pigments contents of S. polyrrhiza
2.5 BPA对紫背浮萍GSH含量的影响
紫背浮萍GSH含量变化如图5所示,与对照组相比,5、20和50 mg·L-1暴露组GSH含量显著增加(P<0.05)。
2.6 BPA对紫背浮萍渗透压调节物质的影响
紫背浮萍渗透压调节物质含量如图6所示,与对照组相比,20 mg·L-1组可溶性糖含量显著升高(P<0.05)。5、20和50 mg·L-1暴露组组可溶性蛋白含量显著高于对照组(P<0.05)。
3 讨论(Discussion)
3.1 BPA对紫背浮萍生长和光合色素含量的影响
植物光合作用、抗氧化系统以及渗透压调节物质在植物生长和发育过程中扮演重要角色。绿色植物通过利用太阳能,同化二氧化碳和水制造有机物并释放氧气,促进自身生长。20 mg·L-1组湿重显著增加,可能是BPA参与细胞内信号转导,发挥类似细胞分裂素的作用,诱导植物生长[17]。50 mg·L-1组湿重显著降低,可能是由于高浓度的BPA抑制了细胞的分裂,抑制紫背浮萍的生长[18],这与Xu等[19]和Qiu等[20]的研究结果基本一致。Xu等[19]研究发现,低浓度BPA暴露导致玉米幼苗根长、鲜重和干重增加,但高浓度BPA暴露后,鲜重和干重明显降低;Qiu等[20]用含有BPA的溶液来培养大豆,发现低浓度BPA有促进生长的作用,而高浓度的BPA抑制大豆生长。
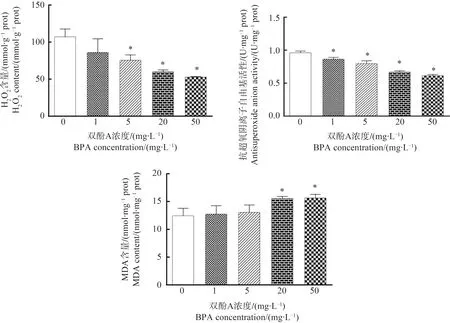
图3 BPA对丙二醛(MDA)含量、H2O2含量和抗超氧阴离子自由基活性的影响Fig. 3 The effects of BPA on the malondialdehyde (MDA), H2O2 contents and antisuperoxide aninon activity of S. polyrrhiza
Jiao等[21]研究发现,低浓度的BPA通过促进叶绿素合成来影响大豆幼苗的光合作用,从而对植物生长产生影响,本研究中1 mg·L-1组、5 mg·L-1组和20 mg·L-1组的光合色素含量显著升高。有研究表明,高浓度的BPA可以降低叶绿素的含量,干扰植物的正常生理活动,对有机物积累过程产生影响[22-23]。本研究中50 mg·L-1组光合色素含量低于对照组,表明BPA可能通过影响光合色素含量对植物的生长产生效应[24]。
3.2 BPA对紫背浮萍抗氧化系统的影响
有研究表明,植物在生长过程中遇到恶劣环境,自身产生大量活性氧(ROS)致使氧化还原反应失衡,植物体内活性氧存在形式主要包括H2O2、·OH以及超氧阴离子(·O2-),过多的ROS会引起细胞内脂、蛋白质和DNA等的氧化损伤,诱发氧化应激[25]。随着BPA浓度增加,H2O2含量和抗超氧阴离子活性降低,BPA暴露组与对照组之间有显著差异,说明紫背浮萍在BPA胁迫情况下,体内·O2-增加,导致抗超氧阴离子自由基活性降低,H2O2降低可能是体内去除活性氧的系统发挥了作用。MDA是植物体内重要的膜脂过氧化产物,Movafeghi等[26]研究发现,紫背浮萍在Zn暴露后,MDA含量显著增加,膜系统受损。本研究中,20 mg·L-1组和50 mg·L-1组MDA含量在暴露组中显著增加,表明高浓度BPA暴露时,活性氧诱导氧化损伤,造成膜脂过氧化,对植物的正常生理活动产生危害[27]。
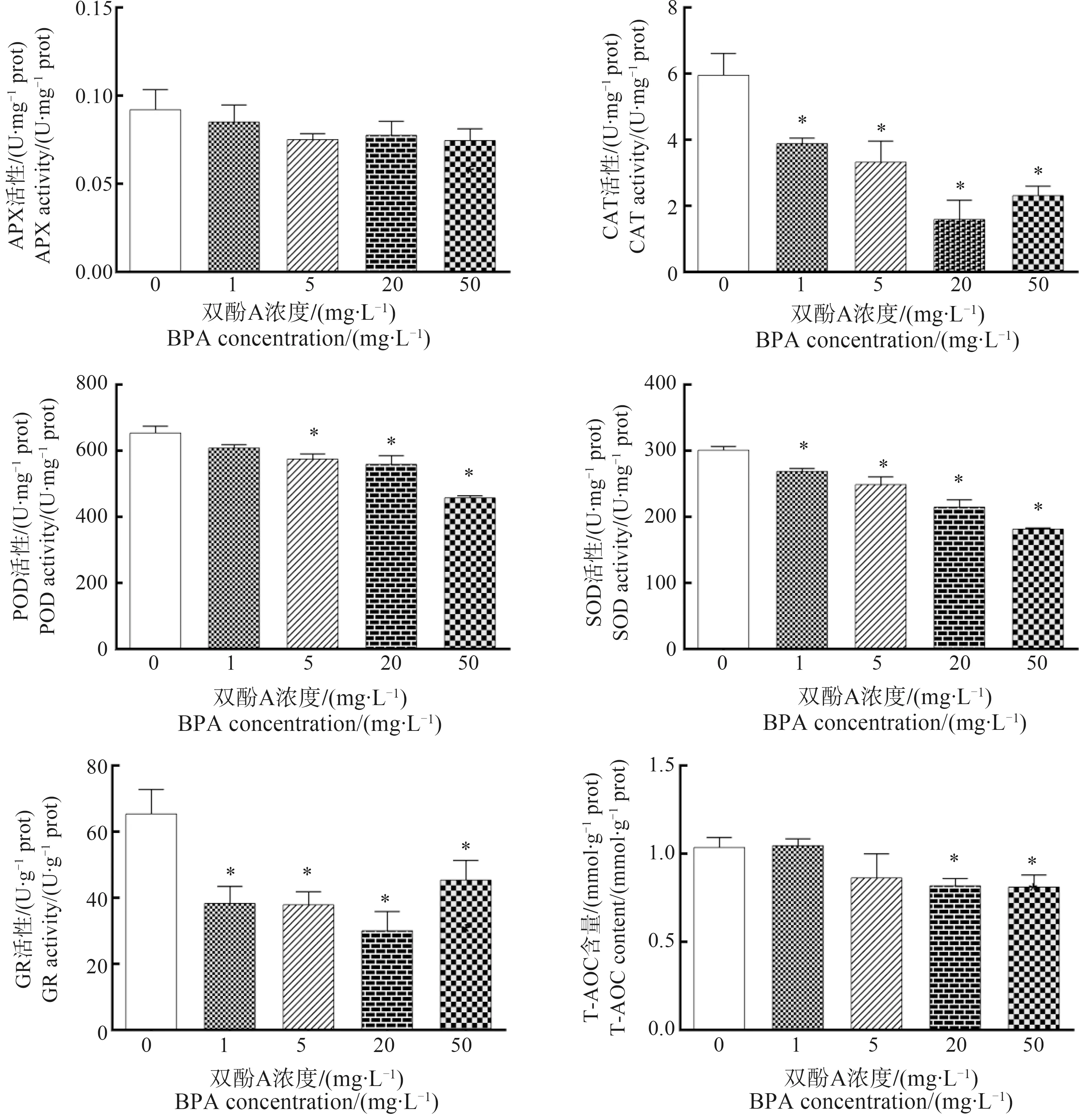
图4 BPA对紫背浮萍抗坏血酸过氧化物酶(APX)、过氧化氢酶(CAT)、过氧化物酶(POD)、超氧化物歧化酶(SOD)、谷胱甘肽还原酶(GR)活性以及总抗氧化能力(T-AOC)的影响Fig. 4 The effects of BPA on the activities of aseorbateperoxidase (APX), catalase (CAT), peroxidase (POD), superoxide dismutase (SOD), glutathione reductase (GR), and total antioxidant capacity (T-AOC) in S. polyrrhiza
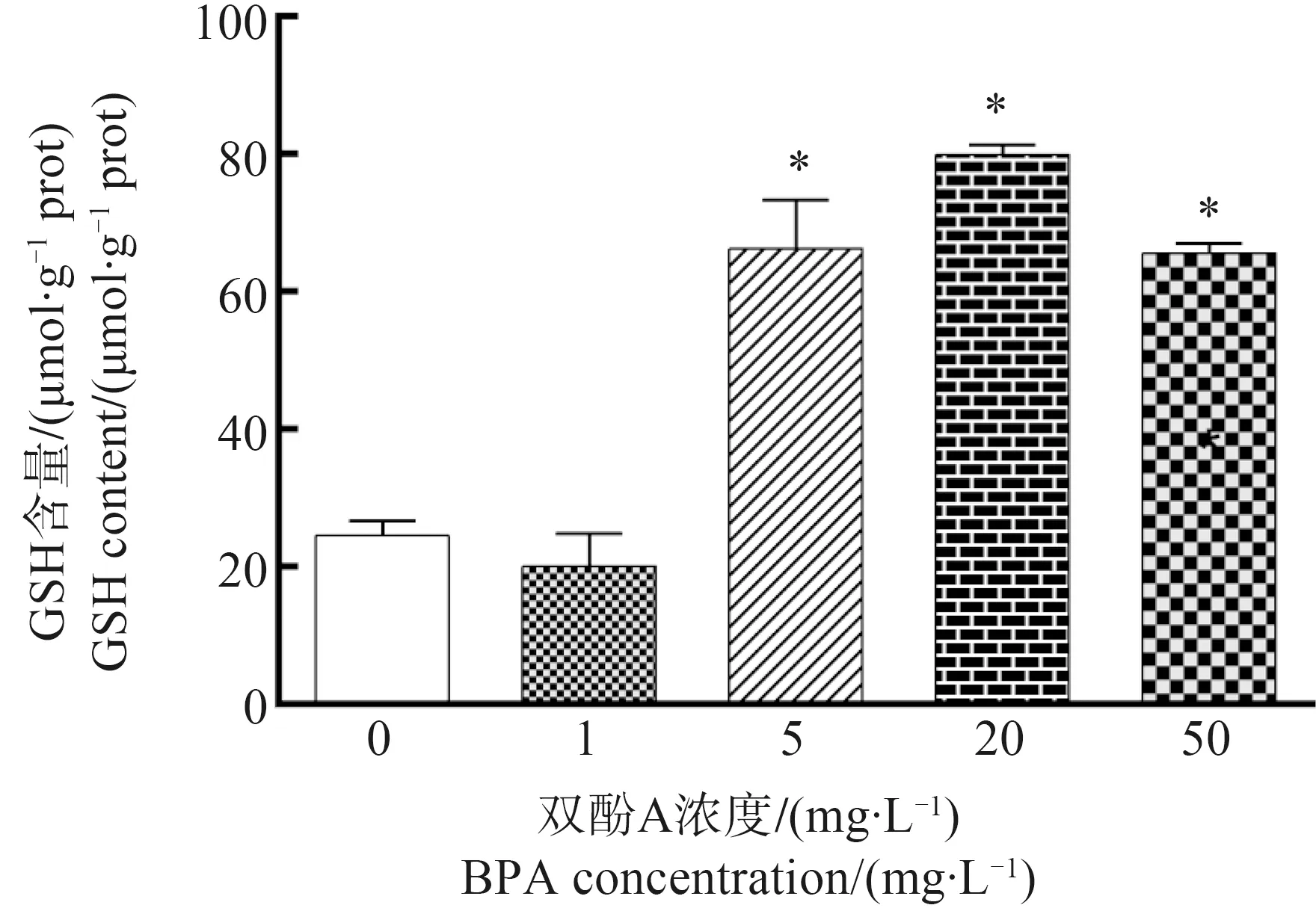
图5 BPA对紫背浮萍谷胱甘肽(GSH)含量的影响Fig. 5 The effect of BPA on glutathione (GSH) content in S. polyrrhiza
植物体内存在抗氧化系统维持植物中ROS含量的平衡[28]。SOD能清除·O2-,并催化·O2-形成O2和H2O2的歧化反应;CAT主要存在于细胞过氧化物酶体中,可将H2O2转化为O2和H2O;POD广泛存在于植物的不同组织中,是反映植物生长发育、体内代谢状态和对外界环境适应性的标志;APX以H2O2作为氧化剂并催化单脱氢抗坏血酸(MDHA)形成;GR在去除ROS对植物氧化应激反应中起关键作用;T-AOC能够反映植物体内的各种抗氧化大分子、抗氧化小分子和酶的总水平。GSH是植物体内重要的抗氧化物质,可以减少重金属对植物的损伤和羟基自由基的形成[29]。BPA暴露后的CAT、SOD和GR活性均显著降低,在5、20和50 mg·L-1
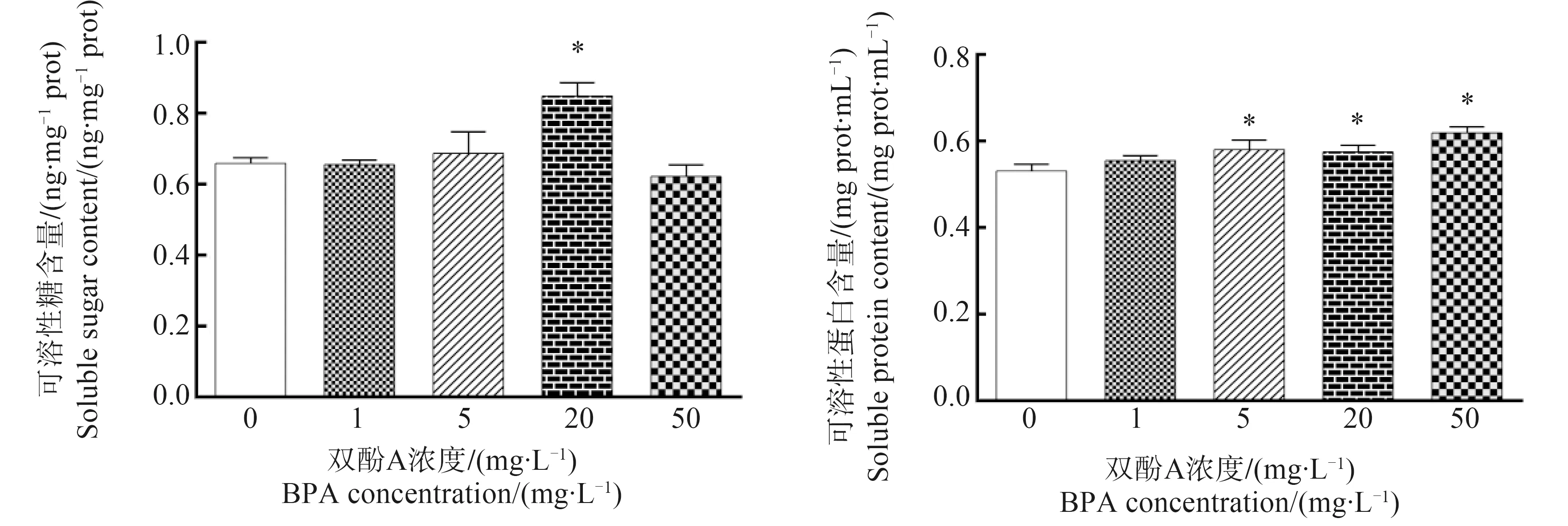
图6 BPA对紫背浮萍可溶性糖和可溶性蛋白的影响Fig. 6 The effect of BPA on soluble sugar and soluble protein content in S. polyrrhiza
暴露组POD和T-AOC活性均显著降低,APX活性出现下降趋势,但与对照组相比没有显著差异,GSH含量在5、20和50 mg·L-1组显著增加,可能是由于BPA暴露后活性氧含量升高,导致抗氧化酶的活性降低,这与其他学者的研究结果基本一致:Xu等[30]研究发现,紫背浮萍在镨暴露后,抗氧化酶活性降低,GSH含量增加;Parlak等[31]的研究表明,紫背浮萍随着纳米二氧化钛含量的升高,CAT与POD活性显著降低。紫背浮萍可能通过激活各种酶和非酶抗氧化剂来减轻BPA诱导的氧化损伤,抗氧化酶活性和抗氧化物质含量的变化反映出紫背浮萍抗氧化系统在BPA胁迫后的复杂变化。
3.3 BPA对紫背浮萍渗透压调节物质的影响
可溶性糖和可溶性蛋白是调节植物渗透压的关键物质,有助于植物适应外界环境的胁迫。有研究表明,苎麻叶片的可溶性糖和可溶性蛋白含量在镉(Cd2+)处理后呈现增加趋势进而来抵御不良环境的影响[32],本研究中,20 mg·L-1组可溶性糖含量显著升高,5、20和50 mg·L-1暴露组可溶性蛋白含量显著高于对照组。紫背浮萍可能通过提高可溶性糖和可溶性蛋白含量,提高渗透调节能力,减轻BPA对于自身的毒性[33]。
综上所述,低浓度BPA提高紫背浮萍光合色素含量,促进有机物质积累,湿重逐渐增加;BPA浓度升高,植物光合色素含量降低,光合作用降低,有机物质积累较慢,活性氧积累,造成氧化损伤,抗氧化酶体系发挥作用,膜脂过氧化发生,植物渗透压调节物质受到影响,植物生长受到抑制。
