大连地区1132例健康体检女性HPV感染情况分析
2019-04-17裴莉杜凤霞
裴莉 杜凤霞
人乳头瘤病毒(human papillomavirus,HPV)为小型双链DNA病毒,具有多种亚型,不同亚型致病性不同,根据其感染后致癌性可分为低危型和高危型两大类。研究表明高危型HPV的持续感染是引发宫颈癌的重要因素[1-2]。因此,HPV基因型检测对宫颈癌及癌前病变的早期筛查、诊断和防治具有重要意义。本研究通过对大连地区健康体检女性进行HPV基因分型检测,从而探讨HPV感染状况、基因型分布特征及相关影响因素,为宫颈癌的诊疗、防治以及抗宫颈癌新疫苗的研发提供可靠的理论依据。现将调查结果报告如下。
1 对象与方法
1.1 研究对象 收集2017年6月至2018年8月大连疗养院健康管理中心1 132例体检女性普查的HPV检测分型结果。被检女性均为非经期、24 h内无性行为、72 h内未阴道给药或进行冲洗,均签定知情同意书。本研究中被检者年龄22~83岁,平均年龄(40.68±8.21)岁。均未行子宫切除术、无HPV感染治疗史及宫颈细胞学病史。按照年龄分为5组(21~30岁、31~40岁、41~50岁、51~60岁、61岁及以上),其中因61岁以上人数过少,故把61~83岁合并为一组。
1.2 仪器与试剂 实验中使用到仪器为GeneAmp PCR System 9700基因扩增仪(杭州日博科技有限公司)和FYY-3分子杂交箱(兴化市分析仪器厂),试剂采用杭州艾康人乳头状瘤病毒基因分型(25型)检测试剂盒(PCR-反向点杂交法)。
1.3 标本采集与处理 标本均为女性宫颈脱落细胞。采集:妇科医生以扩阴器暴露宫颈口,先用无菌棉拭子将宫颈口过多的分泌物擦去,再将专用宫颈刷伸入宫颈口处,紧贴宫颈口黏膜顺时针轻柔转动4~5周后慢慢取出,置于装有细胞保存液的专用取样管中,拧紧瓶盖并充分震荡,直立放置常温或4℃保存,72 h以内完成检测。如同时行细胞学检查及HPV检测,应先取细胞学标本,后取HPV标本。采样中血液或黏液太多影响检测结果,取材前应先去除。
1.4 HPV分型检测 原理:本试剂盒采用PCR体外扩增和DNA反向点杂交相结合的基因检测技术。通过HPV特异引物,扩增出包含25种HPV基因型的目标片段,再将扩增产物与固定在膜条上的型特异性探针进行杂交,依据杂交信号来判断是否有这些HPV型的存在。
具体操作过程中的试剂配制、PCR扩增、杂交、洗膜、显色及结果判定等步骤严格按照试剂盒和仪器说明书的要求进行。本方法可检测25种HPV基因型,包括17种高危型(HPV16,18,26,31,33,35,39,45,51,52,53,56,58,59,66,68,73 型 )以及8种低危型(HPV6,11,40,42,43,44,81,83型)。本研究中的多重感染即同时获得二重或二重以上的感染。
1.5 结果分析 采用Excel 2007录入整理数据并建立数据库,采用SPSS 19.0软件进行统计学处理,计数资料以率表示,组间比较采用X2检验,计量资料用(s)表示,P<0.05为差异具有统计学意义。
2 结果
2.1 健康体检女性HPV感染情况和基因型分布共纳入1 132例健康体检女性为研究对象,其中21~30岁组253例,31~40岁组439例,41~50岁组118例,51~60岁组228例,61岁及以上组94例。经统计分析检出HPV感染212例,总感染率为18.73%(212/1 132),HPV单一感染为158例,其感染率为13.96%(158/1 132),占总感染人数的74.53%(158/212),多重感染54例,为总感染人数的25.47%(54/212)。其中不同年龄组段HPV的感染率也不尽相同(表1)。25种HPV基因型均有检出,总计296型次,其中高危型238型次,占80.41%,高风险HPV感染率为21.02%(238/1 132),低风险HPV感染率为5.12%(58/1 132)。其中高危基因型中HPV52、HPV53、HPV58和HPV16位居检出型次的前四位,分别为14.19%(42/296)、9.12%(27/296)、8.78%(26/296)和8.45%(25/296)(表2)。

表1 不同年龄组HPV感染情况(n)
2.2 不同年龄组HPV感染情况 31~40岁年龄组HPV阳性感染人数最多73人(图1),但其感染率却最低16.63%(图2);61岁及以上和21~30岁两组HPV阳性检出率均较其他组高,分别为23.40%和20.16%,即单一和多重感染率均高于其他组。各年龄组人群HPV感染均以单一感染为主(图3),在41~50岁组段中未检测到三重及三重以上的感染。高危型HPV52、HPV16在单一和多重感染中的感染率在31~40岁组段中最高,分别为24.14%、14.58%(14/58,7/48)和15.52%、8.33%(9/58,4/48)。HPV阳性感染率经X2检验,各年龄组间比较,P>0.05,差异无统计学意义(X2=3.009,P=0.556)。

图1 不同年龄组人群HPV阴性和阳性感染人数情况
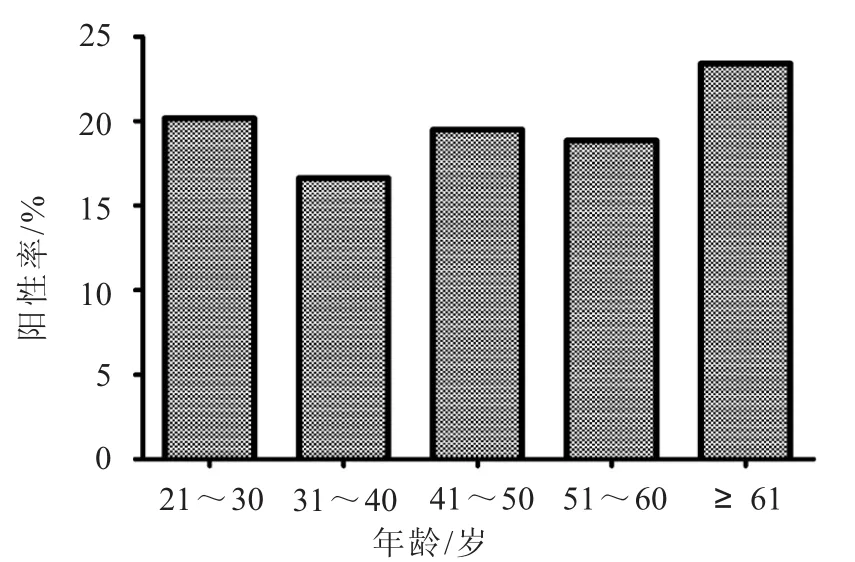
图2 不同年龄组人群HPV阳性感染率
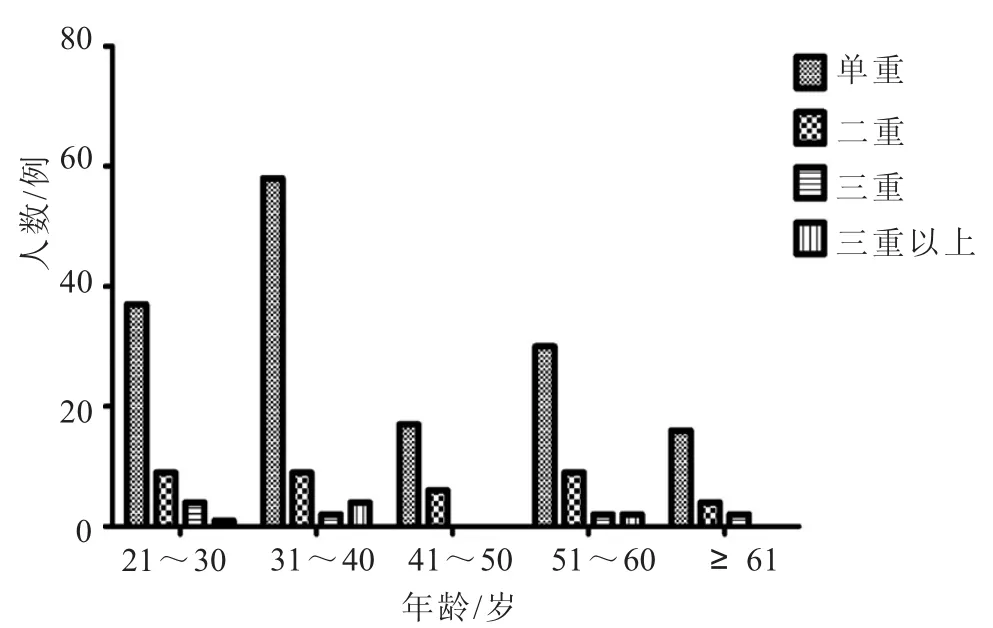
图3 各重感染在不同年龄组人群中的分布
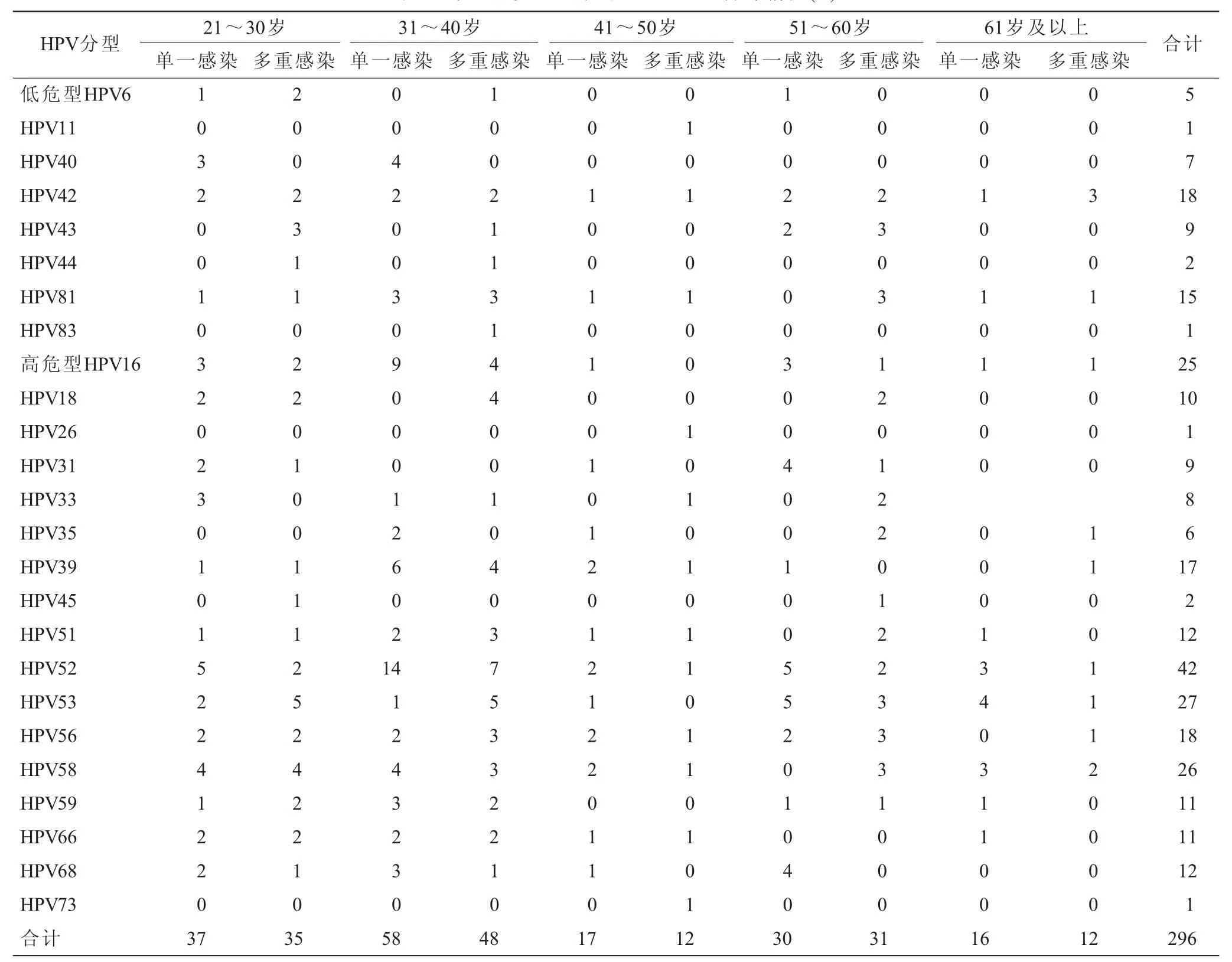
表2 单一和多重感染的HPV基因型分布情况(n)
3 讨论
3.1 引起HPV感染率和基因分型差异的相关因素 宫颈癌已成为中国女性第二大恶性肿瘤[3-4],是最致命同时也是最容易明确病因的肿瘤之一,高危型HPV的持续感染是诱发宫颈癌的罪魁祸首[5]。HPV从潜伏感染到宫颈癌病变需要经历一定的时间,早期治疗的宫颈癌患者生存率高达90%,因此有效的进行HPV基因型检测对预防宫颈癌的发生具有重要的意义。不同的地域、不同的人群以及不同年龄段的HPV感染率和基因分型存在着较大的差异,这可能与当地的经济发展水平、生活习惯、卫生条件、保健意识以及医疗技术水平等因素密切相关。因此准确了解本地区人群HPV感染情况、基因型分布特征和相关影响因素能为宫颈癌的诊疗、防治以及抗宫颈癌新疫苗的研发提供可靠的理论依据。
3.2 本地区HPV感染特征 本地区女性HPV感染以单一高危型感染为主,以HPV52、HPV53、HPV58和HPV16最为常见,且21~30岁及61岁及以上年龄组单一和多重感染率均较高,这与杨炼等和Wang等[6-7]的研究结果相似。高危亚型与成都地区[8](HPV52、16、58和39),云南曲靖市[9](HPV16、52、58和18),甘肃地区[4](HPV16、58、52和18),河北地区[10](HPV16、58和52)、牡丹江地区[11]的(HPV16、52、58和51)前四位相比,感染亚型排序有所不同。本研究显示大连地区1 132例健康体检女性HPV总感染率为18.73%,单一感染率为13.96%,均低于张青等[12](2014)的23.19%和16.70%,且与之检出最高型次的HPV16、HPV58和HPV52的顺序也略有差别。与王诗卓等[13]的辽宁地区的总感染率17.35%,单一感染率14.16%基本相似。61岁及以上和21~30岁两组HPV阳性感染率最高,与国外[14]文献报道的HPV感染年龄近似为“U”型分布相符。邓任堂等[15]认为以20~30岁、>50岁年龄段阳性率较高,呈现“双峰”状。即青年、老年感染率高,而中年感染率相对低。在本研究中,感染的主要年龄段集中在30岁及以下和61岁及以上人群,检出率分别为20.16%和23.40%。分析原因可能与年轻女性生殖道黏膜免疫防御系统尚不够成熟,加之性生活活跃抗感染能力较弱,宫颈鳞状上皮较敏感容易受到HPV的感染。此外,国内学者[16]认为也有可能与生活环境不固定,作息时间不规律,过早性行为,性伴侣不固定等因素相关。感染后大多数女性可以自主的清除掉体内的HPV,只有少数人群由于无法清除进入体内的HPV造成感染,才有可能引起宫颈癌前病变。本研究发现60岁及以上年龄组HPV感染率最高,一方面可能与参选样本量少有关,本年龄段的人数仅为94人;另一方面随着年龄的增长机体的免疫力逐渐下降,机体清除HPV的能力也随之降低。还可能因其处于绝经期,激素水平降低,导致机体免疫功能减退,从而容易引起持续性感染。
3.3 为本地区的疫苗研发提供理论依据 目前已上市的抗宫颈癌疫苗以二价(HPV16和18)、四价(HPV6、11、16和18) 及九价(HPV6、11、16、18、31、33、45、52和58)为主。本次检测的四种常见基因型HPV52、53、58和16并未全部涵盖在九价疫苗中。研究显示疫苗对HPV基因型有交叉保护性[9],但由于HPV型别特异性强,诱导产生的中和抗体交叉保护性较低。机体虽可以通过自身的免疫系统清除早期的HPV感染,但由于病毒的致病性加之持续感染极易引起癌变。因此因地制宜、有针对性的研发适合本地区人群的HPV疫苗尤为重要,而不能以偏概全。
综上所述,HPV基因分型检测对易感染人群的及早发现、及早诊断、及早治疗起着重要作用,对新疫苗的研发评价、接种有着重要价值。因此建议凡有性生活一年以上的女性应该定期做HPV分型检测,而更有效的方式是行液基薄层细胞学检查和HPV二者联合检测。应当引起足够的重视,从而降低宫颈癌的发病率,保护女性健康。
