苯并芘和邻苯二甲酸二(2-乙基己基)酯复合暴露对稀有鮈鲫的内分泌干扰效应研究
2019-04-16付娟娟郭勇勇韩建杨丽华周炳升李云峰倪朝辉
付娟娟,郭勇勇,韩建,杨丽华,周炳升,李云峰,倪朝辉
1. 中国科学院水生生物研究所,淡水生态与生物技术国家重点实验室,武汉 430072 2. 中国科学院大学,北京 100049 3. 中国水产科学研究院长江水产研究所,武汉 430223
长江是亚洲第一长河,也是中国水量最丰富的河流,其水环境与中国人们生活息息相关。长期调查表明,长江水环境中存在多种有机污染物,例如,邻苯二甲酸酯(phthalic acid esters, PAEs)、多环芳烃(polycyclic aromatic hydrocarbons, PAHs)和多溴联苯醚(polybrominated diphenyl ethers, PBDEs)等。
邻苯二甲酸酯(PAEs),又称酞酸酯,广泛应用于塑料制品、化妆品、油漆、食品包装、儿童玩具、润滑剂和农药等制造行业中。随着经济的发展,PAEs的产量和使用量不断增加,据估计全球PAEs的总产量已超过800万t[1],而中国是PAEs的最大进口国,到2010年,中国的PAEs使用量高达136万t,到2015年,中国PAEs年均使用量增长了约7.7%[2]。在酞酸酯中,邻苯二甲酸二乙基己酯(di-(2-ethylhexyl)phthalate, DEHP)是目前使用最为广泛的一种典型的增塑剂,在中国,DEHP年产量占PAEs总产量的80%以上[3],因此是酞酸酯中最主要的增塑剂。目前,DEHP已在全球的非生物介质中以及野生动物和人类的血液、尿液中都不同程度的检出,是分布非常广泛的有机污染物,大量DEHP的毒性研究结果表明,DEHP具有生殖毒性、胚胎毒性、肝脏毒性、免疫毒性及致癌性等多种毒性[4-6]。
多环芳烃(PAHs)是一类广泛存在于环境中的有机污染物,主要是石油、煤等化石燃料和木材、烟草等有机物在不完全燃烧过程中产生的[7];另一方面,在森林火灾和火山爆发等自然现象中也可产生PAHs。PAHs可以通过燃料排放和石油泄漏等途径直接进入水体中,也可以通过大气循环、迁移转化等间接途径污染水体。中国水环境中PAHs污染状况较为严重,在中国长江流域、珠江流域以及辽河流域等水体和沉积物中均检出不同含量的PAHs[8-9],并且PAHs总量最高达到12.9 μg·L-1[10]。苯并芘(benzo(a)pyrene, BaP)是PAHs中最具代表性的一种污染物,大量流行病学调查及可疑危险因素分析表明,BaP不仅是强致癌物,还是强致畸、致突变剂和内分泌干扰物。其不仅对呼吸系统、心血管系统和免疫系统等有损伤作用,而且与不良妊娠结局的发生密切相关[11]。据诸多研究报道,BaP具有抗雌激素活性,会严重影响哺乳动物、水生动物等的生殖系统和繁殖[12]。
在实际水环境中,污染物并非单一存在,所以单一物质的毒性研究已经不能完全反映其在环境中的风险。2种或多种物质混合后,常会发生毒性的改变,称为毒性的联合作用。因而联合毒性效应能够更加准确、真实地反应污染物的环境风险。联合作用的类型,一般分为协同作用、加和作用、独立作用和拮抗作用。当毒物联合作用的毒性大于其中各毒物成分单独作用毒性的总和时称协同作用;多种毒物同时存在时的毒作用为各毒物分别作用时毒作用的总和时称加和作用;而独立作用的毒性低于相加作用,但高于其中单项毒物毒性;拮抗作用指的是毒物联合作用的毒性小于其中各毒物成分单独作用毒性的总和。对于预测联合毒性分析的数学模型,应用最广泛的有浓度加和模型(concentration addition, CA)和效应加和模型(response addition, RA)。其中,CA是混合物风险评价中使用最多的方法,特别是在混合物毒性未知的情况下;而RA是混合物每组分效应的加和,混合物中各组分被认为彼此独立作用且不影响其他物质的毒性,适用于独立联合作用。先前的研究结果显示,三峡库区的PAEs和PAHs的范围分别为1.96~7.81和0.23~0.99 μg·L-1,是最主要的2类有机污染物[13-15]。笔者先前研究了PAHs的代表物BaP对稀有鮈鲫的内分泌干扰效应,结果表明,低剂量BaP暴露不会影响鱼体内激素和基因的水平[16],但是对于长江水体中的多种有毒物质同时存在时对珍稀鱼类的影响还不清楚。基于PAHs和PAEs在长江上游水体中共同存在的客观事实,二者联合暴露更接近于上游珍稀特有鱼类的真实生存环境。因此,研究二者联合暴露的毒理学效应非常必要。
在毒理学研究中,浓度的设置是正式实验的关键,浓度范围一般介于无效应浓度和最大耐受浓度之间。但在不同的试验中浓度梯度的设置也存在着一些差别,例如在急性毒性试验中,污染物浓度水平的设置一般按照等对数间距设置;而在亚慢性试验中,污染物浓度水平的设置一般按几何级数设置。此外,在环境风险评价的研究中,低浓度的设置以实际环境剂量为参考,然后按几何级数递增。本实验选择了长江水域中2种典型的代表污染物DEHP和BaP,以实际环境中BaP和DEHP在长江上游中的含量为依据,各选取2个浓度来探讨2种污染物共存的情况下对稀有鮈鲫的内分泌干扰效应。笔者检测了稀有鮈鲫的形态学指标,血清中性激素水平,以及下丘脑-垂体-性腺轴(hypothalamic-pituitary-gonadal, HPG)相关基因和肝脏中卵黄蛋白原(vitellogenin, VTG)基因的转录水平,以评价BaP和DEHP对稀有鮈鲫潜在的内分泌干扰效应,为预测多种污染物共存条件下对长江上游鱼类的潜在影响提供科学依据。
1 材料与方法(Materials and methods)
1.1 材料与试剂
苯并芘(BaP,CAS:50-32-8)和邻苯二甲酸二乙基己酯(DEHP,CAS:117-81-7)购自美国AccuStandard公司,助溶剂为二甲基亚砜(DMSO),购自美国Amresco公司。内标化合物氘代苯并芘(d12-BaP)和氘代邻苯二甲酸二乙基己酯(d4-DEHP)分别购自美国Supelco和AccuStandard公司。RNA提取试剂(RNAiso Plus reagent)和逆转录试剂盒(PrimerScript RTreagent Kit)购自中国Takara公司。荧光定量试剂盒(SYBR Green PCR Kit)购自日本Toyobo公司。睾酮和雌二醇酶联免疫试剂盒(Testosterone EIA Kit和Estradiol EIA Kit)购自美国Cayman公司。其他所有试剂均为分析纯。
1.2 稀有鮈鲫的饲养和暴露实验
将稀有鮈鲫(Gobiocyprisrarus)饲养在经活性炭过滤且充分曝气的自来水中,光暗周期为16 h∶8 h,水温维持在(25±1) ℃,饲养期间每天投喂饵料2次,饵料为小颗粒商品饵料和刚孵化的丰年虫幼虫。暴露实验开始前,将性成熟的稀有鮈鲫(7月龄)以半静态条件在装有20 L水的缸中驯养2周。每个缸中放置8条雌鱼和8条雄鱼,每天清除多余饵料和排泄物。适应期过后,稀有鮈鲫暴露于0、BaP(0.1、1 μg·L-1)、DEHP(10、100 μg·L-1)和BaP+DEHP((0.1+10)、(1+100) μg·L-1)的暴露液中28 d,暴露结束前一天下午停止喂食,使实验鱼空腹。暴露组和溶剂对照组中DMSO的终浓度为0.001%(体积比)。每个浓度包括3个平行缸,暴露期间每天更换1/2的暴露液。28 d后,用0.03%的MS-222将鱼麻醉,并用滤纸吸干,称量并记录体长和体重,断尾采血用于激素测定。准确分离脑、肝脏和性腺并称重,于液氮中瞬间冷冻,保存于-80 ℃中待测。各形态学指标的计算方法如下:
K=m/L3×100%
(1)
BSI=mB/m×100%
(2)
GSI=mG/m×100%
(3)
HSI=mH/m×100%
(4)
式中:K为条件因子,m为体重(g),L为体长(cm),BSI为脑指数,mB为脑质量(g),GSI为性腺指数,mG为性腺质量,HSI为肝脏指数,mH为肝脏质量(g)。
1.3 化学分析
在暴露的第3天和第7天,分别从暴露缸中取换水后水样200 mL,保存于干净的玻璃瓶中,经0.7 μm玻璃纤维滤膜过滤后收集过滤液,加入对应的内标化合物。水样中BaP及DEHP的抽提方法和分析方法参考之前的文献[17-18]。DEHP用SILICA/PAS玻璃混合型SPE小柱富集(SPE小柱预先用二氯甲烷、乙腈和超纯水依次活化),流速控制在6~8 mL·min-1。水样富集完毕,真空下将柱干燥30 min,然后用乙腈洗脱,洗脱液一并收集到干净的玻璃瓶中,高纯氮气缓缓吹干,最后用0.1 mL丙酮溶解目标化合物,4 ℃保存待测。BaP用C18填料的SPE小柱富集(SPE小柱预先用二氯甲烷、甲醇和超纯水活化),待测水样以5 mL·min-1的流速流过已活化的C18小柱。水样富集完毕真空抽滤30 min使柱干燥。然后用二氯甲烷洗脱,洗脱液一并收集到干净的玻璃瓶中,高纯氮气缓缓吹干,最后用0.1 mL乙腈溶解目标化合物,4 ℃保存待测。本研究利用气相色谱质谱联用仪(Agilent 7890A-5975C)分析了对照组和各处理组暴露水体中BaP和DEHP的实际浓度。用程序空白和空白加标来进行质量控制,根据d4-DEHP和d12-BaP测定加标回收率分别在89%~106%和93%~115%之间。
1.4 性激素的抽提与测定
暴露结束后,MS-222(0.03%)麻醉实验鱼,断尾采血。每2条鱼的血混合一起作为一个平行样,每个浓度雌雄鱼各4个平行。在4 ℃、7 000 r·min-1条件下离心5 min,取上清10 μL用于性激素的检测。激素抽提法参照Guo等[17]的方法。即每个样品(10 μL血清)中加入390 μL Milli-Q水,涡旋混匀,向其中加入2 mL乙醚,混匀器混匀,于4 ℃、5 000 r·min-1下离心10 min,取上清。再用2 mL乙醚按上述方法抽提一次,将2次抽提后的上清液集中于一个干净离心管中,用氮气吹干后保存于-80 ℃。所得样品用试剂盒中120 μL EIA buffer溶解,按照Cayman Chemical Company公司的睾酮和雌二醇试剂盒说明书检测性激素含量,其中睾酮的检测限为6 pg·mL-1,雌二醇的检测限为19 pg·mL-1。
1.5 实时荧光定量PCR
雌雄鱼各不同组织(每个平行由2条鱼的样品合并而成)总RNA提取、纯化、定量及cDNA合成法参照Wang等[19]的方法。为避免基因组DNA的污染,初提取物的总RNA用RNase和DNaseI进行消化并纯化。用分光光度计测定样品在260和280 nm下的吸光值,同时用1%的琼脂糖凝胶电泳进一步检测RNA的浓度,取1 μg总RNA进行反转录得到cDNA,用SYBR Green I染料法对目标基因进行定量检测(ABI 7300, Applied Biosystem, USA)。反应体系为20 μL,其中包括SYBR Green PCR master mix (Toyobo, Japan) 10 μL、ROX 0.4 μL、5 μmol·L-1正义和反义引物各0.5 μL及cDNA 1 μL和7.6 μL ddH2O。实时定量PCR程序为:95 ℃预变性10 min;95 ℃变性30 s,58 ℃复性20 s,72 ℃延伸1 min,40个循环。内参基因选择β-actin,内参及目标基因引物序列通过软件Primer 5 (http://www.premierbiosoft.com/primerdesign/)设计,引物序列见表1。所有样品的定量检测至少重复3次,每次3个平行。以2-ΔΔCt法计算目标基因mRNA的相对表达量[20]。
1.6 数据处理与分析
所有数据均用平均值±标准误表示。通过Kolmogorov-Smirnov方法检测数据的正态性,通过Levene’s检验方法分析数据的方差同质性,数据满足方差同质性,使用SPSS 13.0软件(SPSS, Chicago, IL, USA)通过Dunnett’s检验对数据进行单因素方差分析,当P<0.05时,即表示有显著性差异。

表1 实时荧光定量PCR基因引物Table 1 Primer sequences for the quantitative real-time polymerase chain reaction assays used in this study
2 结果(Results)
2.1 暴露水中BaP和DEHP的实际含量
在2次收集(第3天和第7天)的水样中,BaP和DEHP的含量无明显差异。暴露水中BaP和DEHP的实际浓度如表2所示。为了方便起见,后面仍用名义浓度表示。
2.2 形态学指标
稀有鮈鲫的形态学指标变化如表3所示。在雌性实验组中,BaP和DEHP单独暴露对稀有鮈鲫的各形态学指标均未有明显影响,在BaP和DEHP复合暴露中,均显著增加了雌鱼的脑指数(P<0.05);在雄性组中,只有在1 μg·L-1BaP和100 μg·L-1DEHP显著增加了稀有鮈鲫的肝脏指数(P<0.05)。
2.3 血浆中性激素水平
BaP和DEHP单独暴露下,雌性和雄性稀有鮈鲫的性激素水平均未有显著性变化(图1)。在雌鱼体内,1 μg·L-1BaP+100 μg·L-1DEHP复合暴露组血浆中睾酮(T)含量与对照组及各自单独处理组相比显著性升高(图1(a)),但血浆中雌二醇(E2)含量与对照组相比显著性降低(图1(b))。在复合暴露组中,雄性稀有鮈鲫血浆中的T和E2的水平均未有显著性改变(图1(c), (d))。T/E2是性激素异常的敏感指示指标,在雌鱼的1 μg·L-1BaP+100 μg·L-1DEHP组中,血浆中T/E2与对照组和各自的单独处理组相比均显著性升高(图1(e)),而雄鱼的各浓度组与对照组相比都无显著性差异(图1(f))。
2.4 基因表达
对稀有鮈鲫HPG轴和肝脏中相关基因进行了检测,结果表明,与对照组相比,雌鱼中lh和17β-hsd基因表达量在BaP和DEHP单独暴露时均无显著差异(表4),单独100 μg·L-1DEHP处理显著下调了cyp19a基因的表达(表4),但显著升高了fsh和cyp17的表达量(表4);与对照组相比,复合暴露的1 μg·L-1BaP+100 μg·L-1DEHP组中,fsh、vtg、cyp17和17β-hsd基因表达量显著上调了1.62、2.73、1.96和1.28倍(表4),cyp19a则显著下调了-1.56倍(表4)。
雄性稀有鮈鲫相关基因中,fsh、cyp17、17β-hsd和cyp19a的表达量在BaP、DEHP单独暴露以及二者复合暴露下均无显著性差异(表5);lh基因的表达量在BaP和DEHP单独暴露下均无显著性改变,而在二者复合暴露高浓度组中,lh的表达量显著性下调了-1.52倍(表5),vtg基因的表达量在100 μg·L-1DEHP单独处理组和1 μg·L-1BaP+100 μg·L-1DEHP复合处理组中显著性上调了1.48倍和1.81倍(表5)。
3 讨论(Discussion)
之前大多数研究集中在单一化合物对鱼类的毒理学效应,但在实际水环境中,化合物并不是单一存在,因而单一物质评价不能完全反映其在环境中的风险。在本研究中,笔者以中国特有模式鱼类稀有鮈鲫为研究对象,评价了长江上游水域主要典型污染物BaP和DEHP共同存在时的生殖内分泌干扰效应。实验检测了鱼体各形态学指标、体内性激素水平和HPG轴及肝脏中相关基因的表达量。实验结果表明,BaP、DEHP单独暴露时对稀有鮈鲫性激素含量和基因表达基本上无显著影响,但两者复合暴露情况下,在高浓度复合暴露组显著改变了稀有鮈鲫体内性激素的水平及相关基因的表达,说明BaP和DEHP共同存在的情况下,显著增强了它们各自的毒性效应,表现为协同效应。
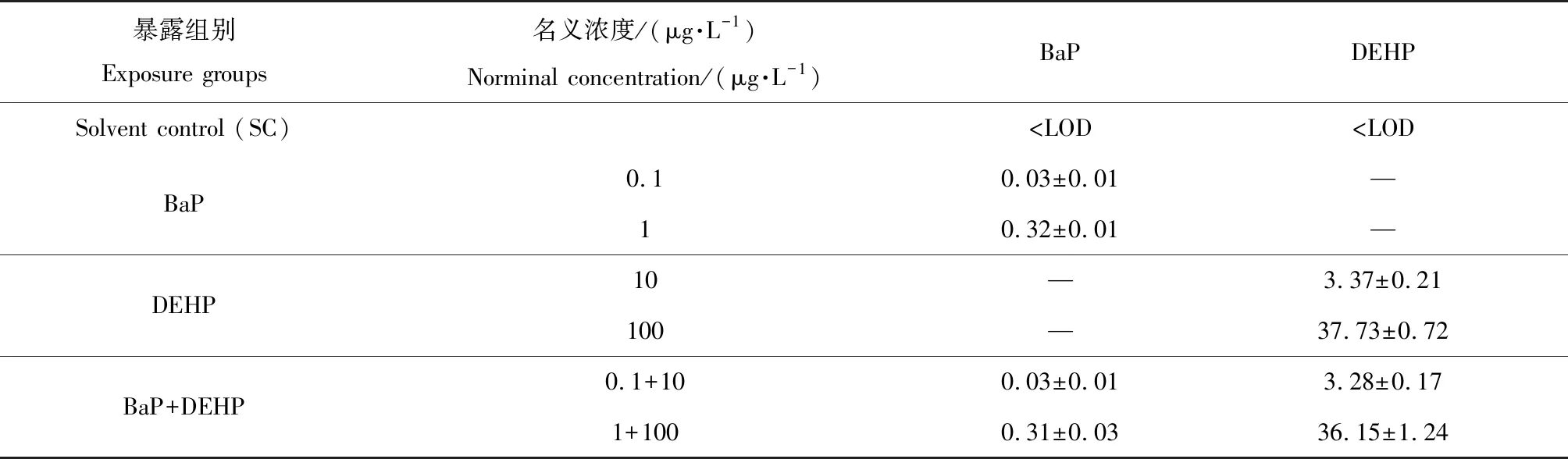
表2 利用GC-MS检测各单独或复合暴露组中苯并芘(BaP)和邻苯二甲酸二(2-乙基己基)酯(DEHP)的浓度Table 2 The measured concentrations of benzo(a)pyrene (BaP) and di-(2-ethylhexyl)-phthalate (DEHP) in each single or co-exposure group by GC-MS analysis
注:实验结果以平均值±标准误表示;—表示没有检测,LOD为检测限。
Note: Data are expressed as mean±SEM; — means not detected; LOD means limits of detection.
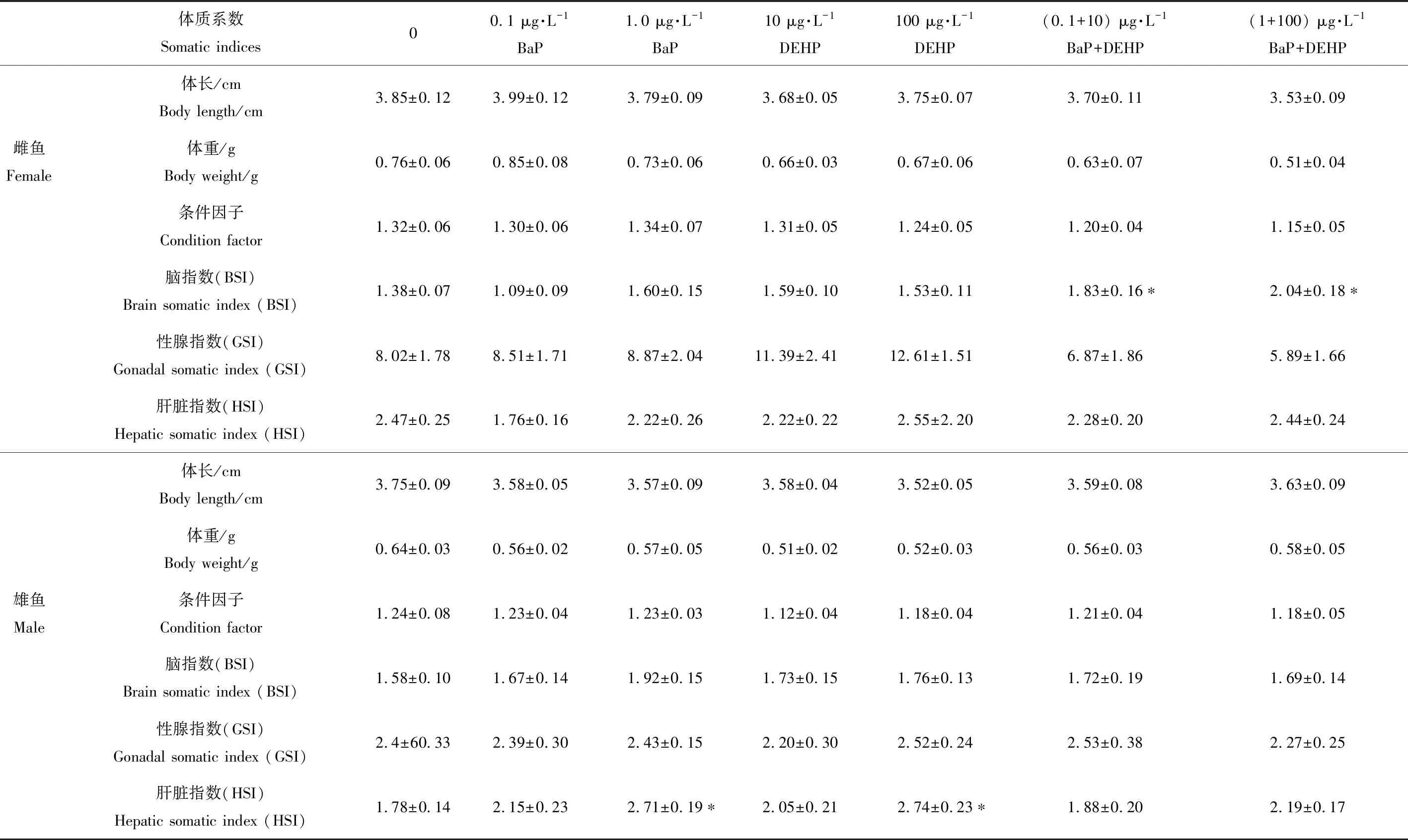
表3 稀有鮈鲫暴露于不同浓度BaP、DEHP和BaP+DEHP中28 d后体质系数的变化Table 3 Somatic indices of rare minnow after exposure to BaP, DEHP and BaP+DEHP
注:实验结果以平均值±标准误表示,每个浓度24条鱼,*表示P<0.05,实验组与对照组相比,差异显著。
Note: Data are expressed as mean±SEM; there are 24 fish in each exposure concentration; *P<0.05 indicates the statistically significant differences compared to the control groups.
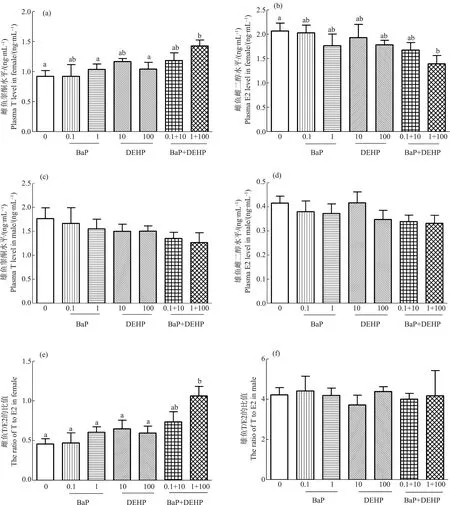
图1 稀有鮈鲫暴露于不同浓度BaP、DEHP和BaP+DEHP中28 d血浆中睾酮(T)、雌二醇(E2)水平和T/E2比值的变化注:测定结果以平均值±标准误表示,每个浓度4个平行样,平均数后上标不同字母表示处理组间差异显著(P<0.05)。Fig. 1 Effects on levels of serum testosterone (T), 17β-estradiol (E2) and T/E2 ratio in rare minnows after exposure to BaP, DEHP and BaP+DEHPNote: Data are expressed as mean±SEM; there are 4 replicates in each exposure concentration; different letters indicate the significant difference among the exposure groups (P<0.05).
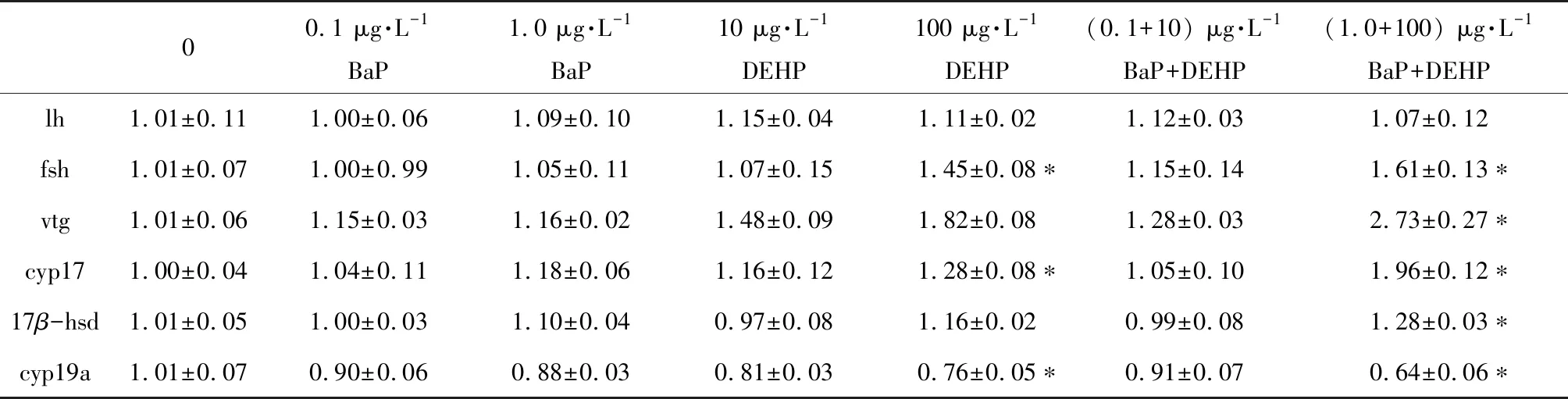
表4 稀有鮈鲫暴露于不同浓度BaP、DEHP和BaP+DEHP 28 d后雌鱼HPG轴和肝脏中相关基因的表达水平Table 4 mRNA expression of related genes in HPG axis and liver of female rare minnows after exposure to BaP, DEHP and BaP+DEHP for 28 d
注:实验结果以平均值±标准误表示,*表示P<0.05。
Note: Data are expressed as mean±SEM; *P<0.05 indicate the statistically significant differences.
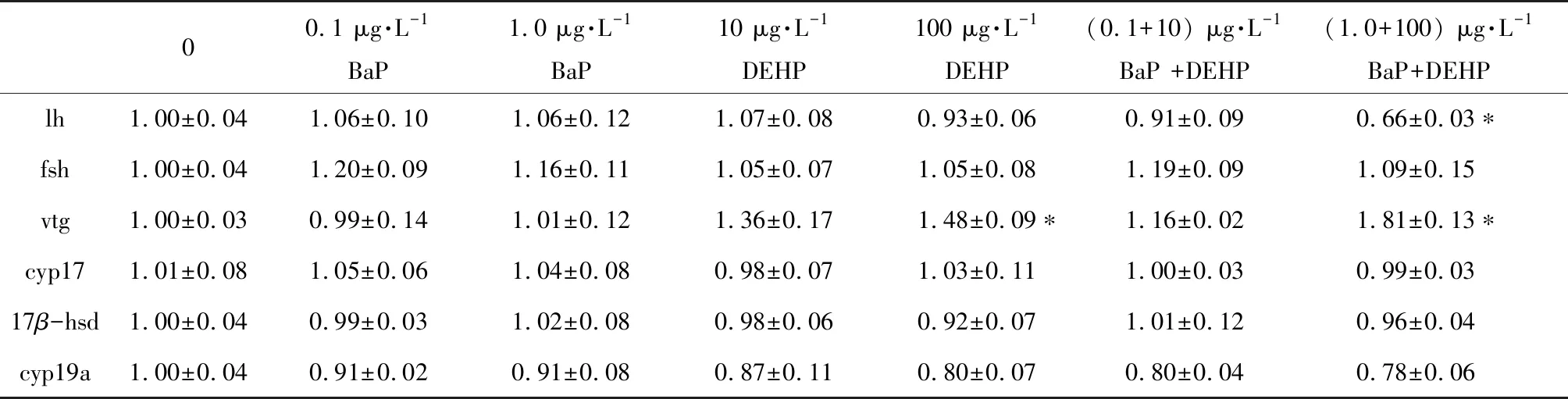
表5 稀有鮈鲫暴露于不同浓度BaP、DEHP和BaP+DEHP 28 d后雄鱼HPG轴和肝脏中相关基因的表达水平Table 5 mRNA expression of related genes in HPG axis and liver of male rare minnows after exposure to BaP, DEHP and BaP+DEHP for 28 d
注:实验结果以平均值±标准误表示,*表示P<0.05。
Note: Data are expressed as mean±SEM; *P<0.05 indicates the statistically significant differences.
在毒理学研究中,性激素水平变化是评价生殖内分泌干扰效应的一个重要指标。在本实验中,稀有鮈鲫经过28 d暴露后,1 μg·L-1BaP+100 μg·L-1DEHP暴露组的雌鱼血浆中睾酮含量显著升高但雌二醇含量显著降低,表现出性别特异性和浓度依赖关系。以往研究表明,BaP和DEHP均是环境中普遍存在的内分泌干扰物,且二者对哺乳动物、鱼类等生物均具有生殖内分泌干扰效应[11,21]。有研究人员用50 mg·kg-1的BaP注射性成熟的虹鳟(Oncorhynchusmykiss),发现无论雌鱼还是雄鱼,血浆中雌二醇和睾酮含量均显著性降低[22]。同样,石首鱼(Micropogoniasundulates)经腹腔注射BaP后,血浆中睾酮和雌二醇含量也显著受到抑制[23]。另外,笔者之前的研究结果表明,将稀有鮈鲫暴露于不同浓度的BaP 28 d后,3 μg·L-1BaP暴露后的雌雄鱼体内的雌二醇含量显著性降低[16]。虽然本实验中BaP单独暴露对稀有鮈鲫体内性激素水平没有影响,但是这有可能是BaP暴露浓度较低导致的,这也与笔者之前实验结果相符。对于DEHP的研究指出,将成年稀有鮈鲫暴露于环境相关剂量的DEHP(3.6、12.8、39.4和117.6 μg·L-1)中21 d后,在雌鱼中,睾酮含量升高,雌二醇含量降低,T/E2比例增加[19]。除此之外,笔者将成年稀有鮈鲫暴露于环境相关剂量的DEHP(4.2、13.3和40.8 μg·L-1)中6个月,结果显示,在雌鱼体内,雌二醇和睾酮的含量均显著性降低[17]。此外,将雄性黑头呆鱼(Pimephalespromelas)暴露于环境相关剂量(12 μg·L-1)的DEHP 28 d,明显降低了黑头呆鱼体内E2的水平[24]。以上这些结果说明,DEHP暴露打破了动物体内激素系统的平衡,产生了干扰效应。在本实验中,只有BaP和DEHP同时存在时,高浓度组的雌鱼体内睾酮和雌二醇含量才会显著性改变,表明在一定浓度范围内,二者同时作用时会增强对稀有鮈鲫的生殖内分泌干扰效应,表现为协同效应。
在类固醇激素合成的过程中,一系列激素(如FSH、LH)和酶类(CYP17、17β-HSD和CYP19a等)发挥着重要作用[25]。鱼类的FSH主要是刺激性腺分泌雌二醇和睾酮等性类固醇激素,LH与排精和排卵有关[26]。而类固醇合成酶对类固醇激素的产生同样是至关重要的,编码这些合成酶的基因上调或者下调,会导致类固醇激素(如T、E2)合成效率的升高或降低。本实验1 μg·L-1BaP+100 μg·L-1DEHP中雌鱼fsh表达量显著上调可能是雌二醇显著降低的一种负反馈机制。此外,在本实验中还观察到1 μg·L-1BaP+100 μg·L-1DEHP组中雌鱼性腺中的cyp17和17β-hsd表达量显著上调,而cyp19a表达量则受到显著性抑制。在鱼类类固醇激素合成的过程中,cyp17编码的蛋白催化黄体酮转化为17α-羟基黄体酮,继续催化转化为雄烷二酮,进而通过17β-HSD转化为睾酮,而cyp19a编码的芳香化酶可以催化睾酮转化为雌二醇[25]。因此,cyp19a基因表达量受到抑制可能会抑制睾酮向雌二醇的转化,导致血浆中睾酮水平的升高和雌二醇水平的降低,而cyp17和17β-hsd基因表达的上调可能是机体对于雌二醇下降的一种补偿机制。先前有研究报道称,DEHP可通过激活过氧化物酶体增殖物激活受体(PPARs)的表达来抑制芳香化酶的活性,从而抑制E2的产生[26]。但也有研究发现,DEHP和利谷隆复合暴露导致的雄性黑头呆鱼血清中睾酮含量降低并不是因为抑制了与类固醇生成相关的基因,也不是由于激活PPARs基因的表达,而是升高了类固醇激素分解代谢的水平如升高了肝脏中CYP3A4以及睾丸中磺基转移酶的表达水平[24]。笔者先前的研究观察到稀有鮈鲫暴露DEHP 21 d后,雌鱼血浆中雌二醇含量降低,性腺中cyp17的表达量上调,而cyp19a的表达量下调[19]。同样,在BaP单独暴露时,也发现雌性斑马鱼(Daniorerio)性腺中cyp19a基因表达显著下调的现象,并且肝脏中vtg表达量也显著受到抑制[27]。以上结果说明,DEHP单独或与其他化合物共存的情况下,可能通过不同的作用模式对鱼类产生不良影响。在本研究中,BaP和DEHP复合暴露的情况下,可能通过抑制芳香化酶的活性导致T向E2转化效率的降低,从而导致T的升高和E2的下降,E2的下降通过机体自身的负反馈机制上调了fsh基因的表达,但具体的作用机理需要后续进一步的研究。在鱼类中,卵黄蛋白原(VTG)是卵子发生,卵子成熟及卵黄合成中必不可少的营养物质,是雌激素效应敏感的生物标志物。本实验中观察到的雌鱼雌二醇含量降低而vtg基因表达量却显著升高的现象在之前的实验中也有观察到,例如,在长期低剂量DEHP暴露后,稀有鮈鲫雌鱼血浆中雌二醇含量下降,而vtg表达量上调,猜测这可能是由于这些具有雌激素活性的化合物直接作用于雌激素受体,从而诱导vtg基因表达[17]。而在本次实验中,观察到除了高浓度的DEHP组和高浓度的复合暴露组中lh和vtg表达量改变之外,所有浓度组对雄性稀有鮈鲫基本无显著影响。
本研究得出以下结论:较高浓度的BaP和DEHP同时存在时,会改变雌性稀有鮈鲫血浆中睾酮和雌二醇含量,同时引起了HPG轴和肝脏中相关基因表达量的改变,而低剂量的复合暴露以及单独的BaP、DEHP处理并没有引起激素或相关基因的改变。这一结果说明,BaP和DEHP共同存在时,会改变它们各自的毒性,表现出协同效应;此外,由于长江上游水体中BaP和DEHP含量远低于本实验观察到的效应浓度,笔者推测,三峡库区上游水体中的BaP和DEHP并不会对该区域的鱼类产生生殖内分泌干扰效应。
