离子选择性微电极用于外界胁迫下细胞液中钙分布检测的新模式
2019-04-16邵海玲徐长山张海娇乔金郑博文何慧敏
邵海玲,徐长山,张海娇,乔金,郑博文,何慧敏
东北师范大学紫外光发射材料与技术教育部重点实验室,长春 130024
离子选择性微电极是一种电化学传感器,其工作原理是利用能斯特(Nernst)方程将测得的电位值与离子活度进行转换,从而得到细胞内外的离子活度(浓度)值[1]。同时,也可以通过测量胞外空间离子的浓度梯度,间接得到离子流信息[2-5]。离子选择性微电极具有非损伤性、测量迅速、灵敏度高、测量范围广并且可以进行连续动态测量等优点[6-7],目前已被广泛应用于医学、生物学和环境科学等多个领域[8-10]。

离子选择性微电极技术的应用中也存在一定的局限性。一方面,在测量细胞外离子浓度梯度时,由于胞外离子浓度差别微小,与之对应电位信号的差别通常小于1 μV[12],因此,在测量的过程中,必须进行严格的电磁屏蔽。另一方面,在测量胞外空间离子浓度梯度时,需要精确控制电极尖端反复移动的距离。操作起来难度较大,对电极微操作系统要求较高。如果要测量细胞内特定位置的离子浓度,则要将电极扎进细胞内并在细胞内精确定位。因为细胞膜具有一定的弹性,所以操作具有很大的难度。尤其对于体积较小的细胞来说,电极很难扎进细胞内。因此,尚未见到利用离子选择性微电极测量细胞内离子浓度分布的研究报道。
笔者在用钙离子选择性微电极研究纳米粒子对芦荟原生质体的毒性时,偶然发现原生质体破裂时,由于胞内离子的突然释放,会产生很强的离子浓度脉冲信号。通过将芦荟原生质体置于低渗液中,有意使其吸水胀破,确认了这一脉冲信号的存在。以往的研究者应当也观察到过这种脉冲信号,不过可能只是把它当成实验中的偶发现象忽略了,没有给予足够的重视。通过分析发现,该信号可以定性地反映细胞液内离子的分布情况(定量的反演分析尚在进行中)。在此基础上,笔者又对低温、CuO NPs、铽、镉和乙醇胁迫下,芦荟原生质体破裂时形成的Ca2+浓度脉冲信号进行了检测和分析,发现了一些新现象,初步揭示了低温胁迫、CuO NPs、铽、镉和乙醇处理对细胞液内Ca2+分布的不同影响。
相对于以往的离子选择性微电极应用模式而言,本文的方法具有以下优点:其一是抗干扰能力强。原生质体破裂时,其外部Ca2+浓度变化可以达到2个数量级,脉冲信号明显,受外界干扰影响小。其二是操作简单、不需要精确控制电极的移动。因为在实验过程中,只需要将微电极的尖端靠近原生质体,而不需要在微米量级上往复移动电极,也不用担心在操作微电极控制器时产生的回程差问题,操作较简单。
1 材料与方法(Materials and methods)
1.1 芦荟原生质体
本文研究对象是芦荟(Aloevera)细胞的原生质体,它不但保留了完整细胞的一切活性特征,而且可以方便地通过低渗液使其胀破产生离子浓度脉冲信号。
原生质体用酶解法从芦荟的叶肉中提取,过程如下:将0.400 g纤维素酶(>15 000 U·g-1,国药集团化学试剂有限公司)、0.280 g果胶酶(1.18 U·g-1, Sigma Aldrich)、2.186 g甘露醇(≥80.5%,中国惠世生化试剂有限公司)、0.040 g磷酸二氢钾(KH2PO4) (≥99.5%,北京化工厂)、0.222 g二水合氯化钙(CaCl2·2H2O)(≥98%,西陇化工有限公司)加入20 mL去离子水混合,放入磁力搅拌器(CL-2,巩义市予华仪器有限公司)搅拌20 min,再将混合液放入低速离心机(DT5-6,北京现代北利离心机有限公司),2 000 r·min-1离心8 min,取上清液即为酶解液,备用;选取健康芦荟叶片肥厚部分,用酒精和去离子水反复冲洗消毒去除表皮和胶质部分并再次用去离子水清洗。将3 g剥好的叶片放入盛有20 mL酶解液的烧杯中,用保鲜膜封口后,用黑色塑料袋包裹,放入温度20 ℃、转速60 r·min-1的恒温培养振荡器(ZWYR-240,上海智诚分析仪器制造有限公司)中震荡酶解约4~5 h后取出烧杯,用200目细胞滤网过滤,得到芦荟原生质体。
将制备好的原生质体移入培养基中培养,培养基的配比为2.186 g甘露醇、0.040 g KH2PO4、0.222 g CaCl2·2H2O和20 mL去离子水。
为了降低培养基中Ca2+对实验结果的影响,在进行Ca2+浓度脉冲检测之前,将芦荟原生质体用无钙培养基(在原培养基配方中去掉CaCl2·2H2O)清洗3~5遍。
1.2 纳米氧化铜悬浮液的配制
用分析天平(XS205DU,瑞士)称取5.000 mg的CuO NPs(粒径为40 nm,Macklin,上海)加入100 mL的去离子水中,水浴超声(KQ-250DB,350 W,昆山市超声仪器有限公司)30 min得到100 mL浓度为50 mg·L-1的纳米氧化铜悬浮液。
1.3 硝酸铽溶液的配制
称取12.000 mg的硝酸铽(Tb(NO3)3)(99.9%, Strem Chemicals)加入500 mL的去离子水中,配制成浓度为24 μg·mL-1的硝酸铽溶液。
1.4 氯化镉溶液的配制
将500 mL的去离子水加入到盛有5.000 mg的氯化镉(CdCl2)(99%,山东西亚化学股份有限公司)的烧杯中,配制成10 mg·L-1的氯化镉溶液。
1.5 钙离子选择性微电极
1.5.1 钙离子选择性微电极制备
钙离子选择性微电极由玻璃电极、Ag/AgCl丝、电解液(10-1mol·L-1的CaCl2溶液)和离子交换剂(LIX)组成[16]。其制备过程包括玻璃管(B150-110-10,外径1.5 mm,内径1.10 mm,长度10 cm,Sutter Instrument)拉制、硅烷化、LIX吸入和电解液灌充等几个步骤。详细制备过程可见参考文献[17-18],此处不再赘述。
1.5.2 离子选择性微电极性能检测
分别配制10-7、10-6、10-5、10-4、10-3、10-2和10-1mol·L-1的CaCl2标定液。用制备好的钙离子选择性微电极依次对不同浓度的标定液进行测量(甘汞电极做参比电极),并记录标定液浓度及其对应的电位值。绘制电极的工作曲线,确定电极的能斯特斜率和检测下限。此外还对电极的响应时间以及稳定性进行了检测。
图1表明电极的R值为0.99965,Nernst斜率是26.9,由此可计算出电极的转换效率为93.7%>90%;电极的检测下限优于10-5mol·L-1;在24 h内的电位值基本保持稳定;电极响应时间均小于1 s。
1.6 低温处理芦荟原生质体
将清洗过的原生质体分为4份,其中一份放在室温下正常培养作为对照组。另外3份原生质体放入培养管中,放入冰箱内分别冷冻15、30和90 min后取出。其中冷冻15 min的原生质体悬浮液处于冰水混合状态,悬浮液的温度为0 ℃。冷冻30和90 min的芦荟原生质体悬浮液此时已经是完全结冰状态,悬浮液温度分别为-1 ℃和-6 ℃。将取出的装有冷冻原生质体的培养管置于室温下解冻作为实验组。
1.7 CuO NPs处理芦荟原生质体
从对照组吸取0.1 mL的芦荟原生质体加入装有10 mL浓度为50 mg·L-1的CuO NPs悬浮液的培养管中,轻轻摇匀。静置10、30和60 min后测量。
1.8 硝酸铽处理芦荟原生质体
采取相同的方法,将0.1 mL对照组的芦荟原生质体加入装有10 mL浓度为24 μg·mL-1的硝酸铽溶液的培养管中,轻轻摇匀。静置10、30和60 min后测量。
1.9 氯化镉处理芦荟原生质体
同样,从对照组吸取0.1 mL的芦荟原生质体加入装有10 mL浓度为10 mg·L-1的CdCl2溶液的培养管中,轻轻摇匀。静置10、30和60 min后测量。
1.10 乙醇处理芦荟原生质体
将3 mL的芦荟原生质体加入到装有5 mL 95%乙醇溶液的培养管中,摇匀后静置40 min待测。
1.11 芦荟原生质体破裂时Ca2+脉冲信号的测量
钙离子选择性微电极和甘汞电极(232型,上海罗素科技有限公司)均固定在三维操纵仪(PTW-4,成都仪器厂)上。微电极尖端的位置可通过倒置显微镜(CPX 41, Olympus)观察。离子选择性微电极的输出信号经高阻微电极放大器(SWF-1D,成都仪器厂)放大后,由多道生理信号采集处理系统(RM6240B,成都仪器厂)采集,最后由电脑记录并显示。
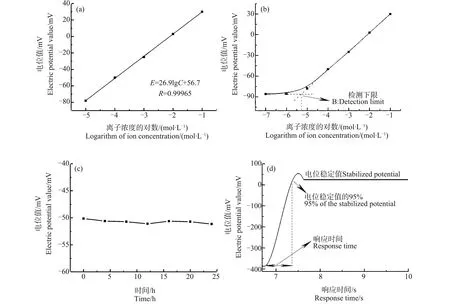
图1 钙离子选择性微电极性能检测注:(a)能斯特斜率检测结果图,(b)电极检测下限,(c)24 h内电极电位的变化,(d)电极响应时间曲线图。Fig. 1 Detection of the performance of the calcium ion selective microelectrodeNote: (a) The test result of the Nernst slope, (b) Lower limit of detection, (c) Changes of electrode potential within 24 h, (d) Response time of the electrode.
将一只10 mL空白培养皿置于倒置显微镜的操作台上,调节三维操纵仪的同时在倒置显微镜下观察,使离子选择性微电极的尖端尽可能接近培养皿底部。甘汞电极尖端置于距离微电极尖端约1.5 cm处。
吸取50 μL待测原生质体悬液滴入装有10 mL低渗液(浓度为55 mg·L-1的甘露醇溶液)的培养管中,轻轻摇匀后倒入显微镜操作台上的培养皿中。调节显微镜操作台,使视野中仅出现一个清晰、外形圆润饱满的芦荟原生质体。此时再次微调三维微操纵仪,使微电极的尖端靠近原生质体,直至电极尖端与细胞膜的距离约为5 μm时停止(各次测量均在这一距离上进行,以保证测量条件的一致性)。关闭屏蔽网拉门,系统开始连续记录电极尖端处的Ca2+浓度。
为了降低外界环境震动和电磁干扰对测量的影响,需将倒置显微镜、三维微操纵仪以及微电极放大器的前级置于防震台上的屏蔽网中。
2 结果(Results)
2.1 对照组的Ca2+浓度脉冲信号
图2是对照组芦荟原生质体破裂时所产生的Ca2+浓度脉冲信号(以电极电位表示,下同)。从图中可以看出,原生质体未破裂前,其附近的Ca2+浓度一直稳定在背景浓度上,没有什么变化。但在原生质体破裂时,其周围的Ca2+浓度在很短的时间内(不到10 s)急剧上升,达到一个峰值后,又缓慢下降至背景浓度,形成一个脉冲信号。
2.2 低温冷冻对Ca2+浓度脉冲信号的影响
吸取前述经冷冻处理15 min并解冻至室温的芦荟原生质体悬液50 μL,滴入低渗液中进行测量。图3是其破裂时Ca2+释放所产生的脉冲信号。从图中可以看出,此时的Ca2+浓度虽然也有快速上升,但是上升到峰值所用的时间大约为17 s,明显长于对照组。
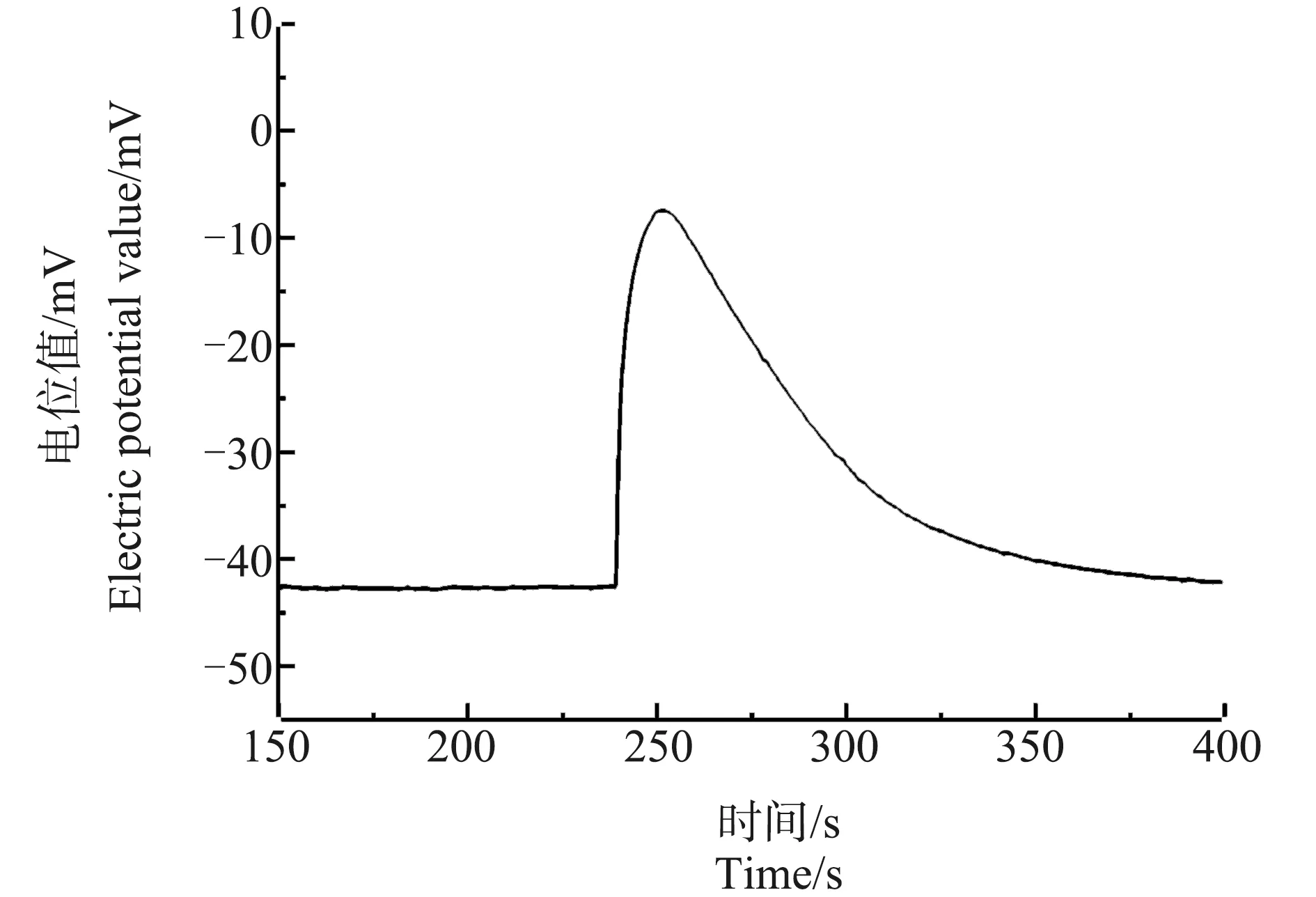
图2 对照组芦荟原生质体破裂时产生的Ca2+浓度脉冲Fig. 2 Ca2+ pulse signal of a breaking control-group Aloe vera protoplast
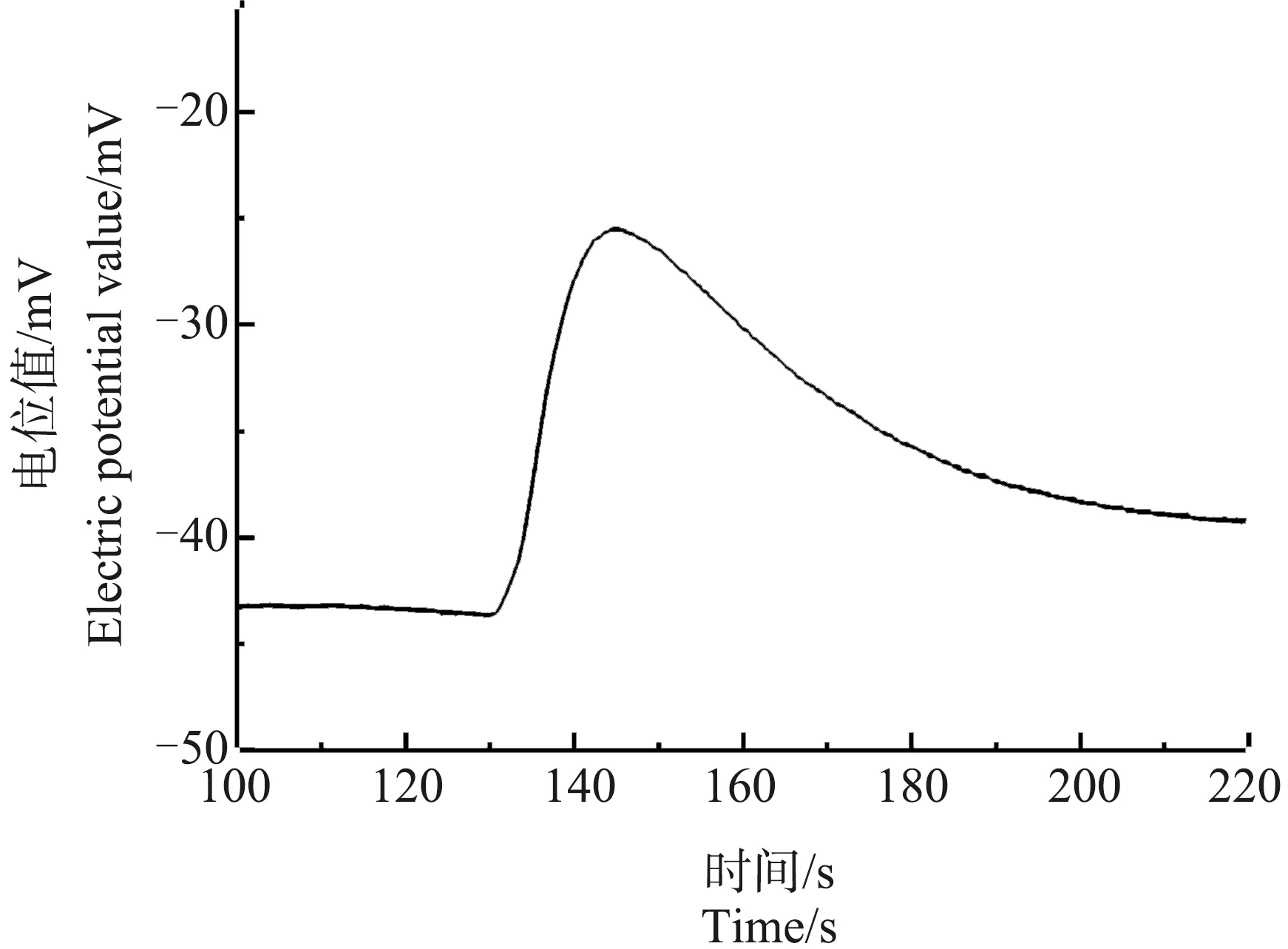
图3 冷冻处理15 min的芦荟原生质体破裂时Ca2+的脉冲信号Fig. 3 Ca2+ pulse signals of a breaking Aloe vera protoplast cooled for 15 min
当温度降至0 ℃以下时,低温处理对Ca2+脉冲信号的影响开始变得非常显著。图4、图5是将芦荟原生质体冷冻30 min和90 min至完全结冰状态后取出,在室温下解冻并继续保存5 min、45 min、23 h和25 h后,所测得的Ca2+浓度脉冲信号。从图4(a)和图5(a)可以看出,与在对照组中观察到的单纯的脉冲信号不同,冷冻30 min和90 min后的芦荟原生质体,其Ca2+浓度脉冲信号的前沿处出现了一个明显的凹陷。这表明,原生质体周围的Ca2+浓度先急剧下降,然后才在较短时间内上升到峰值,最后又缓慢下降趋于背景浓度。经30 min和90 min冷冻的样品,在解冻后23 h(图4(c))和25 h(图5(d))后,脉冲前沿处的凹陷消失。
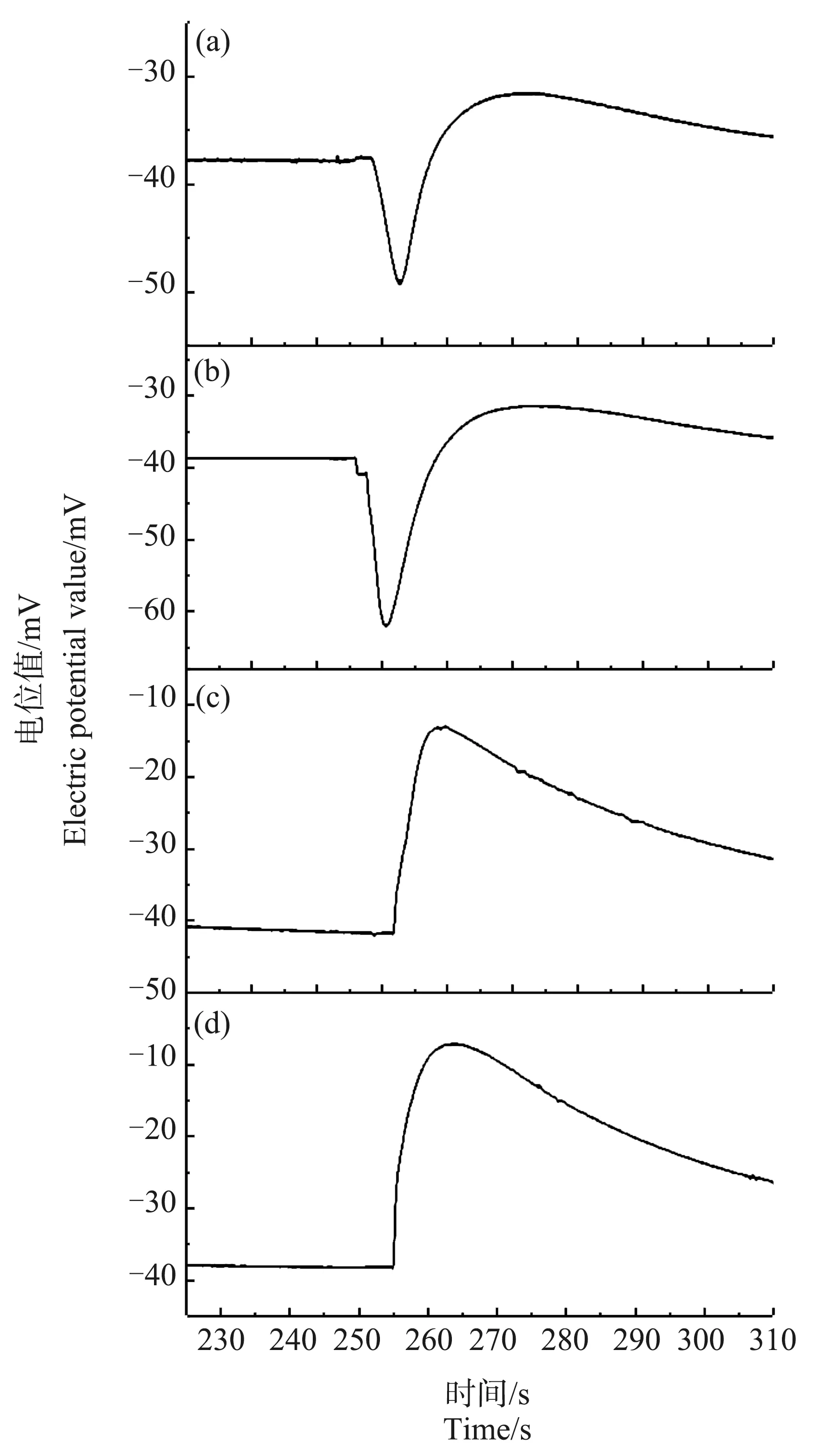
图4 冷冻30 min,解冻不同时间的芦荟原生质体破裂时Ca2+的脉冲信号注:(a)~(d)中解冻时间分别为5 min、45 min、23 h和25 h。Fig. 4 Ca2+ pulse signals of a breaking Aloe vera protoplast of different thawing time after 30 min freezingNote: (a)~(d), thawing time is 5 min, 45 min, 23 h and 25 h.
2.3 CuO NPs处理对Ca2+浓度脉冲信号的影响
图6是将0.1 mL的芦荟原生质体加入10 mL浓度为50 mg·L-1的CuO NPs悬浮液中分别处理10、30和60 min后测得的原生质体破裂时Ca2+浓度脉冲信号的波形图。与对照组图2比较可以看出,经过CuO NPs处理后,原生质体破裂过程中,在脉冲前沿处都出现了Ca2+浓度下降的现象,并且在60 min内,随着处理时间的增加,该下降现象就越明显。
2.4 硝酸铽处理对Ca2+浓度脉冲信号的影响
为探究重稀土元素铽对原生质体破裂时的Ca2+浓度脉冲信号是否有影响,将0.1 mL的芦荟原生质体加入10 mL浓度为24 μg·mL-1的硝酸铽溶液中,图7是分别处理10、30和60 min后测量得到的Ca2+浓度脉冲信号。可以看出,经硝酸铽处理的芦荟原生质体在破裂时,其Ca2+脉冲信号的前沿处均出现了凹陷现象,并且当处理时间为30 min时,凹陷程度最大。
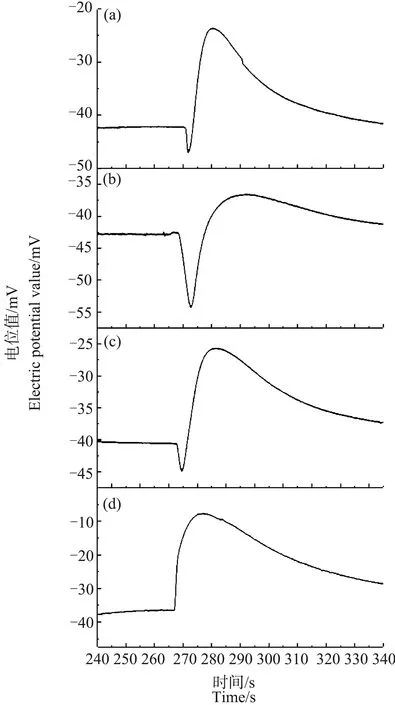
图5 冷冻90 min,解冻不同时间的芦荟原生质体破裂时Ca2+的脉冲信号注:(a)~(d)中解冻时间分别为5 min、45 min、23 h和25 h。Fig. 5 Ca2+ pulse signals of a breaking Aloe vera protoplast of different thawing time after 30 min freezingNote: (a)~(d), thawing time is 5 min, 45 min, 23 h and 25 h.
2.5 氯化镉处理对Ca2+浓度脉冲信号的影响
笔者还利用该方法研究了重金属元素镉对细胞液中Ca2+浓度分布的影响。图8是芦荟原生质体用10 mg·L-1的CdCl2溶液分别处理10、30和60 min后测量得到的Ca2+浓度脉冲信号。可以看出,此种情况下,Ca2+脉冲信号的前沿处同样都出现了小幅度的凹陷现象。
2.6 乙醇处理对Ca2+浓度脉冲信号的影响
用测量Ca2+浓度脉冲的方法研究了乙醇处理对芦荟原生质体的影响。将3 mL的芦荟原生质体加入到5 mL 95%乙醇溶液中处理40 min后测量Ca2+浓度脉冲信号,结果如图9所示。可以看出,经乙醇处理的芦荟原生质体在破裂时,其Ca2+浓度脉冲信号的前沿处没有发生凹陷现象。
3 讨论(Discussion)
从图2可以看到,未经任何处理的对照组原生质体在破裂时产生的Ca2+浓度信号,是一个先急剧上升后缓慢下降的脉冲型信号。这与原生质体破裂时突然释放出其细胞液中的Ca2+,并且释放的Ca2+随时间的推移逐渐向周围扩散的过程相一致。同时可看到,这是一个单纯的脉冲信号,没有叠加其他的细节。这表明,正常芦荟原生质体内细胞液中的Ca2+浓度分布较为均匀,没有大的起伏。
当将原生质体冷冻至不同温度时,其Ca2+浓度脉冲信号的波形会发生不同程度的变化。当冷冻至0 ℃时,基本波形未变,只是Ca2+浓度脉冲信号的前沿变缓,如图3所示。这表明,细胞液中Ca2+的分布仍然均匀,但Ca2+的流动性略有降低。
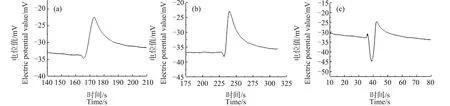
图6 CuO NPs处理不同时间后的芦荟原生质体破裂时Ca2+的脉冲信号注:(a)~(c)中处理时间分别为10、30和60 min。Fig. 6 Ca2+ pulse signal of a breaking Aloe vera protoplast after treatment with CuO NPs at different timesNote: (a)~(c), the treatment time is 10, 30 and 60 min.
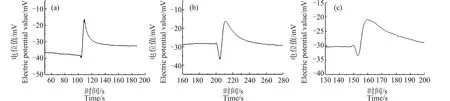
图7 硝酸铽处理不同时间后的芦荟原生质体破裂时Ca2+的脉冲信号注:(a)~(c)中处理时间分别为10、30和60 min。Fig. 7 Ca2+ pulse signal of a breaking Aloe vera protoplast after treatment with Tb(NO3)3 at different timesNote: (a)~(c), the treatment time is 10, 30 and 60 min.
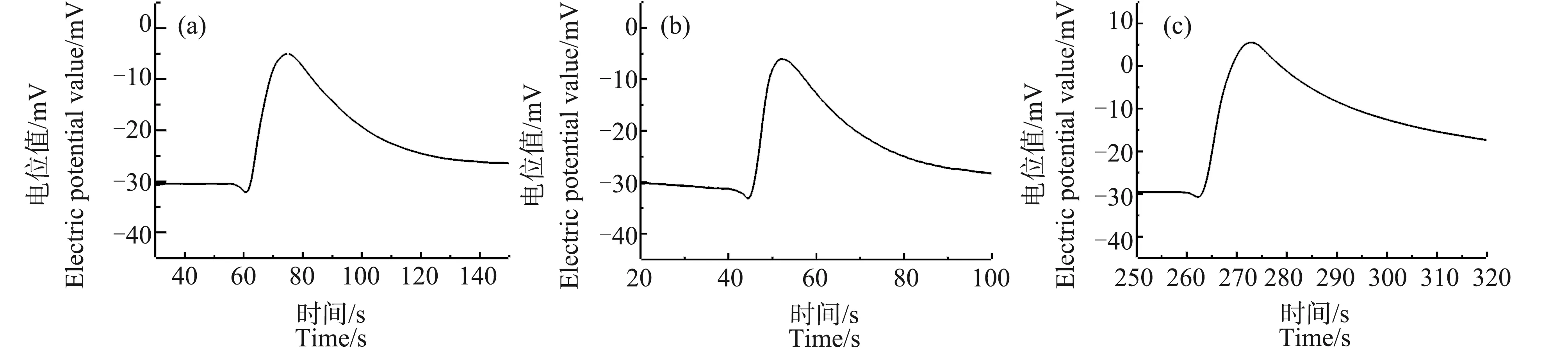
图8 氯化镉处理不同时间后的芦荟原生质体破裂时Ca2+的脉冲信号注:(a)~(c)中处理时间分别为10、30和60 min。Fig. 8 Ca2+ pulse signal of a breaking Aloe vera protoplast after treatment with CdCl2 at different timesNote: (a)~(c), the treatment time is 10, 30 and 60 min.
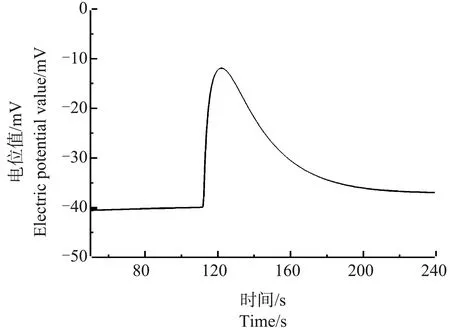
图9 乙醇处理后的芦荟原生质体破裂时Ca2+的脉冲信号Fig. 9 Ca2+ pulse signal of a breaking Aloe vera protoplasts after ethanol treatment
当冷冻至-1 ℃和-6 ℃时,Ca2+浓度脉冲的波形发生了很大的变化,其前沿处出现了一个明显的凹陷(图4和图5)。
在整个测量过程中,原生质体是处在低渗液中的,水会通过细胞膜渗透进原生质体中。如果原生质体内的Ca2+不能很快扩散进这些新渗入的水中,则在原生质体中靠近细胞膜处便会形成一个Ca2+的低浓度区。当原生质体破裂时,就会在脉冲的前沿处出现一个与低浓度区相对应的凹陷。
在对照组中未观察到这种凹陷。这说明,对于正常的芦荟细胞原生质体,细胞液中的Ca2+具有很好的流动性,能够很快地扩散到新渗入原生质体内的水中,使细胞液中Ca2+的浓度分布保持均匀,或者说正常的原生质体对其细胞液中的Ca2+具有很好的调控能力。
当原生质体的温度降至0 ℃时,虽然脉冲前沿变缓,但Ca2+在细胞液中的分布仍然是均匀的。这说明,此时细胞液中的Ca2+仍然具有比较好的流动性,或者说原生质体对于Ca2+分布的调控能力并没有受到明显的影响。只是当原生质体破裂时,Ca2+在低渗液中的扩散速度变慢了。
当温度降到-1 ℃和-6 ℃时,如图4(a)和图5(a)所示,Ca2+浓度脉冲的前沿处才出现了明显的凹陷。这说明,此时原生质体对细胞液中Ca2+的分布失去了调控能力,Ca2+的流动性明显变差,已经无法快速扩散进新渗入的水中,也无法使Ca2+的浓度保持均匀。此时细胞液中的Ca2+浓度分布出现了分层现象。靠近原生质体中心的Ca2+浓度较高,而向外靠近细胞膜附近的Ca2+浓度较低。
在研究低温对植物的影响时,人们比较关注植物形态和生理指标的变化[19]。在有关细胞冷冻保存和复苏的研究中,注意力往往集中在低温导致植物细胞内的水结冰时,冰晶对细胞造成的机械损伤,而较少注意到冷冻对细胞液内Ca2+浓度分布的影响。本文的结果则表明,冷冻会对细胞调控细胞液中Ca2+浓度分布的能力造成损害,使得细胞液内Ca2+的流动性变差,进而造成细胞液内的Ca2+浓度分布出现分层。这一点是今后研究细胞的冷冻保存与复苏时应当注意的。
为了研究冷冻造成的细胞液中Ca2+浓度分布的分层现象是否能够恢复,对解冻后保存不同时间的芦荟原生质体进行了测量。从图4和图5可以看出,在经过较长时间的室温保存后,原生质体中的Ca2+浓度分布可以得到恢复。并且冷冻处理的时间越长,温度越低,恢复所需的时间也越长。冷冻90 min的原生质体,Ca2+浓度分层现象得到恢复所需要的时间比冷冻30 min的原生质体要长约2 h。
笔者还尝试用测量Ca2+浓度脉冲的方法研究了CuO NPs对芦荟原生质体中Ca2+浓度分布的影响。用CuO NPs分别处理芦荟原生质体10、30和60 min,结果表明,Ca2+浓度脉冲信号的前沿处均发生了凹陷现象,并且随着处理时间的增加,该凹陷程度变大(图6)。这说明CuO NPs也会在一定程度上损害原生质体对内部Ca2+浓度分布的调控能力,降低原生质体内Ca2+的流动性,进而引起细胞液中原生质体内Ca2+的浓度分布产生分层现象。并且在60 min内,随着处理时间的增加,分层现象越明显。
有研究表明,CuO NPs会破坏细胞膜的通透性[20],影响酶的活性等[21]。笔者在研究中也发现,经CuO NPs处理后的芦荟原生质体变得比较脆弱,容易发生破裂。所以本文只对经CuO NPs处理60 min后的原生质进行了检测。
铽作为重稀土元素,有关其毒理效应的报道较少,笔者用同样的方法测量经硝酸铽处理过的芦荟原生质体破裂时Ca2+浓度脉冲信号,发现其脉冲前沿处同样出现了凹陷(图7),并且当处理时间为30 min时,此凹陷程度尤为明显。这表明,硝酸铽也会对细胞液调控其内部Ca2+浓度分布的能力造成损伤。继续测量发现经硝酸铽处理的时间大于60 min后,芦荟原生质体破裂时Ca2+浓度脉冲信号与处理60 min时的波形几乎一致。
重金属镉会破坏钙稳态,并引发细胞损伤或死亡[22]。而研究发现,经氯化镉处理的芦荟原生质体破裂时Ca2+浓度脉冲信号的前沿处也出现了小幅度的凹陷现象(图8),并且此波形凹陷程度与处理时间长短无关。这表明,氯化镉会影响原生质体对内部Ca2+浓度分布的调控能力,从而引起细胞液内Ca2+的浓度分布发生轻微的分层。
与上述处理结果不同,经乙醇处理的芦荟细胞原生质体在破裂时,其Ca2+浓度脉冲信号的前沿处没有发生凹陷现象(图9),这说明,乙醇处理并不会影响细胞液中Ca2+的流动性,也不会出现Ca2+浓度分层现象。
综上,本文提出了一种离子选择性微电极用于单细胞检测的新模式,即利用离子选择性微电极对原生质体破裂时产生的离子浓度脉冲信号进行测量,进而分析细胞液内的离子浓度分布情况。用这一方法对经过低温冷冻、CuO NPs、硝酸铽、氯化镉和乙醇处理的芦荟细胞原生质体进行了测量和分析,得到了一些新的有意义的结果。这一新的模式为研究细胞液中的离子浓度分布提供了新的方法,也可为各种环境和生态毒理学评价提供新的途径。
