HSF 1在不同分子分型乳腺癌组织中的表达情况及与预后的关系
2019-04-15王晓兰姚岚巴金玲姜言林刘涛吴彬曹铭谦张殿龙
王晓兰,姚岚,巴金玲,姜言林,刘涛,吴彬,曹铭谦,张殿龙
大连大学附属中山医院乳腺甲状腺外科,辽宁大连1160010
乳腺癌是女性常见的恶性肿瘤,严重威胁女性的生命健康,临床主要采取手术、放化疗、内分泌治疗、生物治疗和免疫治疗等的综合治疗措施进行治疗,但乳腺癌具有高度异质性,不同组织学分型乳腺癌患者的治疗方法及预后明显不同[1]。研究显示,热休克转录因子1(heat shock transcription factor 1,HSF1)的表达水平与多种肿瘤的发生发展密切相关[2]。HSF1可在生理病理性应激条件下快速转录激活,维持内环境稳定,增强细胞凋亡抗性[3]。但HSF1是否可作为乳腺癌治疗靶点尚未达成一致,为探讨HSF1在不同乳腺癌组织学分型中的表达及其对预后的预测作用,本研究回顾性分析乳腺癌患者的临床资料,并取石蜡标本进行免疫组织化学染色检测HSF1的表达水平,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2009年2月至2012年2月大连大学附属中山医院收治的乳腺癌患者的临床资料。纳入标准:①符合《现代肿瘤学》[4]关于乳腺癌的诊断标准,且经病理证实为乳腺癌;②女性;③有石蜡标本存档,临床资料和随访资料完整。排除标准:①继发性乳腺恶性肿瘤患者;②病理活检前接受放化疗患者;③长期服药患者,随访期间意外死亡的患者。依据纳入和排除标准,共纳入364例乳腺癌患者。根据雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)的表达水平差异将364例乳腺癌患者分为Luminal A型组100例、Luminal B型组120例、HER2型组54例及三阴性组90例,4组乳腺癌患者的年龄、淋巴结转移和肿瘤大小等基本临床特征比较,差异均无统计学意义(P﹥0.05)(表1)。
1.2 主要试剂
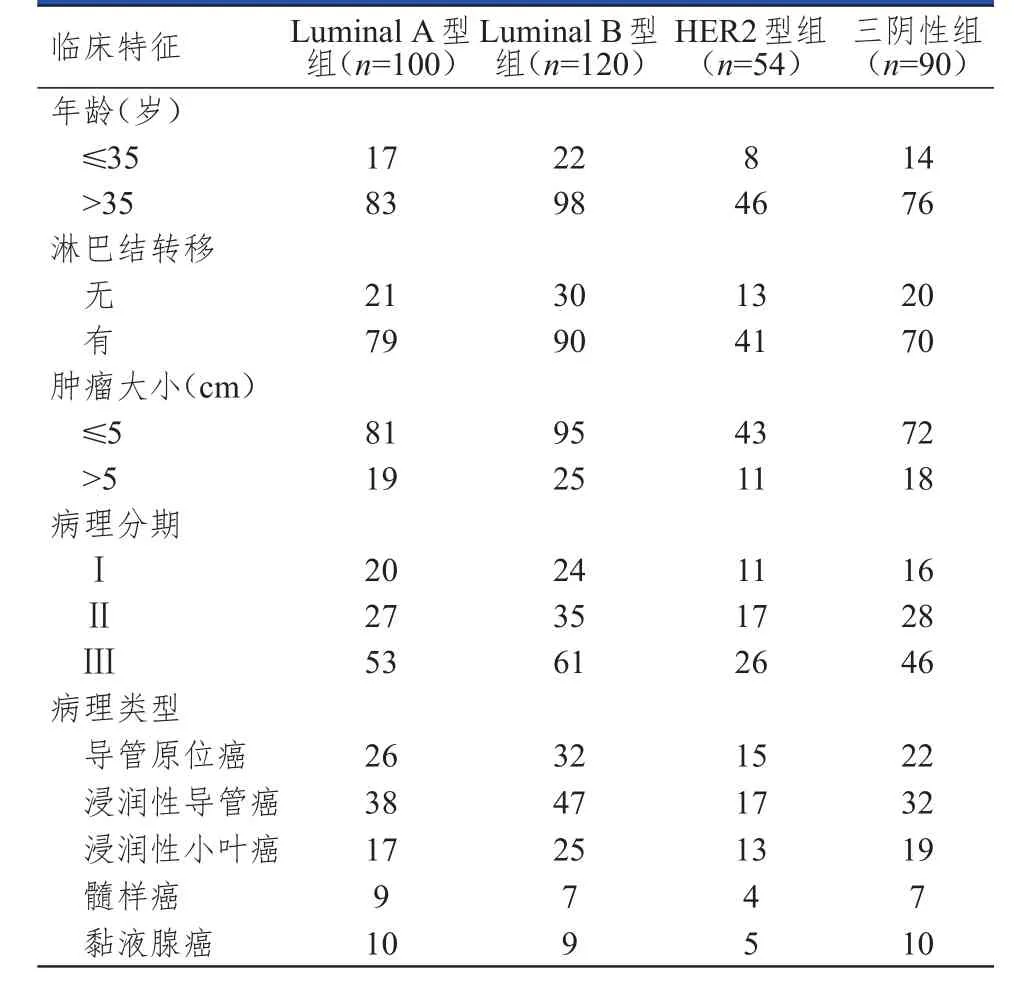
表1 4组乳腺癌患者的基本临床特征
免疫组化试剂盒、二氨基联苯胺(diaminobenzidine,DAB)显色剂均购自北京中山生物技术有限公司,鼠抗人HSF1、鼠抗人热休克蛋白70(heat shock protein 70,HSP70)单抗、兔抗人抗凋亡蛋白B细胞淋巴瘤因子-2(B-cell lymphoma-2,Bcl-2)、兔抗人巨噬细胞移动抑制因子(macrophage migration inhibitory factor,MIF)、兔抗人Bcl-2相关X蛋白(Bcl-2-associated X,BAX)单抗均购自上海优宁维生物科技有限公司,磷酸盐缓冲液(phosphate buffer solution,PBS)购自杭州科易生物技术有限公司。
1.3 免疫组织化学检测
采用免疫组织化学染色法检测乳腺癌组织中HSF1、HSP70、Bcl-2、MIF和BAX的表达情况。取经10%福尔马林固定和石蜡包埋的乳腺癌患者病理标本,切片,厚度约3 μm,然后常规脱蜡脱水,采用柠檬酸盐缓冲液高压抗原修复3 min,并于室温下采用0.3%双氧水处理20 min,PBS冲洗,胎牛血清室温封闭35 min。分别加入鼠抗人HSF1、HSP70,兔抗人Bcl-2、MIF和BAX单抗,4℃冰箱孵育过夜,PBS冲洗,加入生物素标记的二抗(其中HSF1、HSP70加入鼠二抗,而Bcl-2、MIF、BAX加入兔二抗),均室温孵育30 min,PBS冲洗,加辣根过氧化物酶标记的链霉卵白素,室温孵育30 min,PBS冲洗,DAB显色,苏木素复染、脱水、透明、封片。此外,取同一乳腺癌组织标本切片作为空白对照,PBS代替一抗。显微镜下观察乳腺癌组织中HSF1、HSP70、Bcl-2、MIF和BAX的表达情况。
1.4 观察指标和评价方法
采用电话随访的方法对所有乳腺癌患者进行为期5年的随访,无失访发生,比较各组患者的生存率。
显微镜下观察细胞核或细胞质内有棕黄色颗粒为阳性,高倍镜下任选10个不同视野,计数阳性和阴性细胞数,计算阳性细胞率,阳性细胞率=阳性细胞数/(阳性细胞数+阴性细胞数)×100%。其中阳性细胞率﹤1%记为0分,≥1%且﹤25%记为1分,≥25%且﹤50%记为2分,≥50%且﹤75%记为3分,≥75%记为4分;高倍镜下观察乳腺癌组织着色深浅,若不染色则为0分,淡黄色染色为1分,棕黄色染色为2分,棕褐色染色为3分。计算上述两项评分的乘积,0~3分为阴性表达,4~12分为阳性表达,比较4组不同分子分型的乳腺癌患者肿瘤组织中HSF1、HSP70、Bcl-2、MIF和BAX的表达情况。
1.5 统计学方法
采用SPSS 15.0软件对数据进行统计分析。计数资料采用例数和率(%)表示,组间比较采用χ2检验;等级资料比较采用秩和检验;相关性分析采用Spearman相关分析,采用Kaplan-Meier法绘制生存曲线,生存率的比较采用Log-rank检验。以P﹤0.05为差异有统计学意义。
2 结果
2.1 HSF 1、HSP70、Bcl- 2、MIF和BAX表达情况的比较
4组乳腺癌患者乳腺癌组织中HSF1、HSP70、Bcl-2、MIF和BAX阳性表达情况比较,差异均有统计学意义(χ2=16.756、24.912、17.416、45.387、59.724,P﹤0.01)。Luminal A型组和Luminal B型组患者乳腺癌组织中HSF1、HSP70、Bcl-2和MIF的阳性表达率均低于HER2型组和三阴性组患者,BAX阳性表达率均高于HER2型组和三阴性组患者,差异均有统计学意义(P﹤0.05);但Luminal A型组与Luminal B型组患者、HER2型组与三阴性组患者间HSF1、HSP70、Bcl-2、MIF和BAX的阳性表达率比较,差异均无统计学意义(P﹥0.05)。(表2)
2.2 卵巢癌组织中 HSF 1与 HSP70、Bcl- 2、MIF和BAX表达的相关性
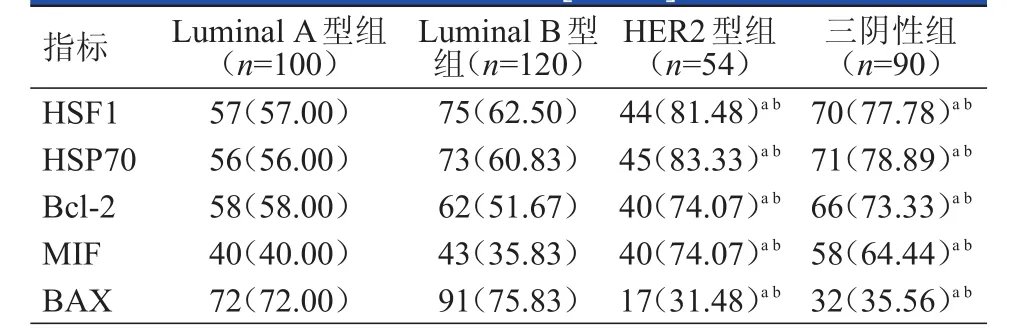
表2 4组患者乳腺癌组织中HSF 1、HSP70、Bcl- 2、MIF和BAX阳性表达情况的比较[ n(%)]
Spearman相关分析结果显示,乳腺癌组织中HSF1与 HSP70的表达呈正相关(r=0.356,P=0.018),HSF1与Bcl-2的表达呈正相关(r=0.389,P=0.016),HSF1与MIF的表达呈正相关(r=0.476,P=0.012),HSF1与BAX的表达呈负相关(r=-0.432,P=0.010)。
2.3 生存情况
HSF1阴性表达患者的5年生存率54.24%(64/118),明显高于HSF1阳性表达患者的18.29%(45/246),差异有统计学意义(χ2=49.116,P﹤0.01)。(图1)
3 讨论
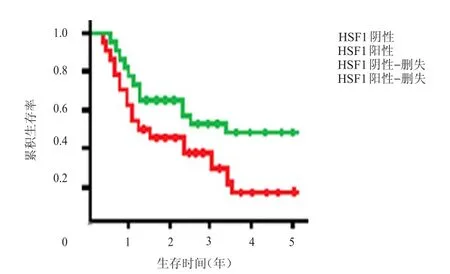
图1 HSF 1阴性表达( n=118)和HSF 1阳性表达( n=246)乳腺癌患者的生存曲线
乳腺癌是发生于乳腺上皮的恶性肿瘤,早期无典型的临床症状和体征,通常经体检或乳腺癌筛查发现。乳腺癌的组织形态、生物学行为、免疫表型及治疗反应的差异较大,且肿瘤组织中各种因子表达水平的差异也可影响乳腺癌患者的治疗及预后[5]。有研究表明,HSF1与多种恶性肿瘤的发生、发展、转移和耐药密切相关[6-8],且HSF1在乳腺癌组织中呈高表达[9]。本研究分析HSF1在不同分子分型乳腺癌中的表达及其对预后的影响,探讨其是否可作为指导乳腺癌治疗及预测预后的指标。
本研究结果显示,Luminal A型和Luminal B型组患者乳腺癌组织中HSF1阳性表达率,均低于HER2型和三阴性组患者,表明HSF1在HER2型和三阴性乳腺癌中高表达,在Luminal A型和Luminal B型乳腺癌中低表达。ER和PR均是正常乳腺上皮细胞中存在的性激素受体,可对乳腺生长、发育和细胞增殖进行调控,癌变时ER和PR减少,肿瘤组织的生长和肿瘤细胞的增殖缺少内分泌激素的调控,导致肿瘤分化程度低,预后较差[10]。HSF1是转录调控因子,存在于真核细胞的蛋白质分子中,结构及功能高度保守,可促进机体发育并维持内环境稳定,其表达及活性异常与多种恶性肿瘤的发生发展密切相关,肿瘤恶性程度越高,HSF1表达水平越高[11]。研究显示,ER和PR表达阴性的子宫内膜腺癌组织中HSF1的表达水平高于ER和PR表达阳性的子宫内膜腺癌组织[12],与本研究结果一致,表明恶性肿瘤患者,HSF1表达水平可能受分子分型的影响,推测ER、PR可能对HSF1具有调控作用,但仍需要进一步探讨。
本研究结果显示,乳腺癌组织中HSF1与HSP70、Bcl-2和MIF的表达均呈正相关,与BAX的表达呈负相关,且HSF1阴性表达患者的5年生存率明显高于HSF1阳性表达的患者,表明HSF1表达对预测乳腺癌患者预后的价值较高。HSP70在进化中高度保守,可在细胞受到感染、高热、缺血缺氧和化学物质等的刺激后迅速合成释放,促进细胞修复和内环境恢复稳定状态,并有助于细胞存活,与肿瘤的发生发展及预后密切相关[13]。HSF1是HSP表达的主要调控因子,也是HSP基因转录关键因子,机体处于热应激或其他应激刺激时,HSF1可被迅速激活,与位于热激蛋白基因启动子上的热激元件形成转录复合体,并促进HSP70的转录[14]。Bcl-2是抗凋亡蛋白,可阻断细胞因各种因素诱发的程序性死亡,在多种肿瘤细胞中呈高表达,与肿瘤的发生发展密切相关,提高肿瘤细胞的抗凋亡作用。Granato等[15]研究发现,通过抑制HSF1的表达,可抑制Bcl-2的表达,促进细胞凋亡。BAX是促凋亡蛋白,不仅可促进细胞自发凋亡,还可促进不同因素诱发的细胞凋亡,抑制肿瘤组织的发生发展,在多种肿瘤细胞中表达水平较低。研究发现,HSF1可抑制BAX的表达,BAX的表达水平降低可影响患者对化疗的敏感性,影响药物发挥作用[16],表明HSF1可能与BAX的表达密切相关。MIF是一种T淋巴细胞因子,可促进肿瘤细胞的扩散、侵袭和转移,促进肿瘤组织的发生发展。研究显示,MIF和HSF1相互作用,促进HER2型乳腺癌的恶性转化[17]。由此可见,HSF1在乳腺癌组织中的表达可能通过某种或某些机制影响HSP70、Bcl-2、MIF和BAX的表达,从而影响乳腺癌患者的预后。
综上所述,HSF1在HER2型及三阴性乳腺癌中高表达,在Luminal A型和Luminal B型乳腺癌中低表达,且HSF1阴性表达的乳腺癌患者的生存时间明显延长,表明HSF1可能通过影响HSP70、Bcl-2、BAX和MIF的表达从而影响乳腺癌患者的预后,可能作为此类患者临床治疗的新靶点,且对预后的预测价值较高。但关于HSF1影响HSP70、Bcl-2、BAX和MIF表达的机制仍需进一步深入研究。
