铂类化疗药物对进展期三阴性乳腺癌的临床疗效及与BRCA基因突变的关系
2019-04-15王楠李鹍李惠平宋国红邸立军姜晗昉刘笑然孔维垚
王楠,李鹍,李惠平,宋国红,邸立军,姜晗昉,刘笑然,孔维垚
北京大学肿瘤医院暨北京市肿瘤防治研究所乳腺肿瘤内科,恶性肿瘤发病机制及转化研究教育部重点实验室,北京100142 0
三阴性乳腺癌是乳腺癌的一种特殊亚型,其雌激素受体(estrogen receptor,ER)、孕激素受体(pro-gesterone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)均为阴性,其发病率约占所有乳腺癌的15%[1]。三阴性乳腺癌具有发病早、侵袭性强、病情进展快和预后差的特点[2-3],且与激素受体阳性或HER2阳性亚型不同,三阴性乳腺癌无特定的治疗靶点,有效的治疗方法较少,化疗仍是主要的治疗方法[4]。三阴性乳腺癌患者乳腺癌易感基因1(breast cancer susceptibility gene l,BRCA1)或BRCA2的突变率较高。BRCA基因突变可以导致同源重组缺陷,使细胞不能修复断裂的DNA链,BRCA基因突变患者的乳腺癌发病风险明显升高,且多表现为三阴性[5]。研究表明,作用于DNA的药物,如铂类化疗药物、多腺苷二磷酸核糖聚合酶[poly(ADP-ribose)polymerase,PARP]抑制剂对BRCA基因突变的三阴性乳腺癌疗效较好[4,6-7]。本研究回顾性分析210例进展期三阴性乳腺癌患者的临床资料,分析铂类化疗药物的临床疗效及其影响因素。
1 资料与方法
1.1 一般资料
回顾性分析2013年1月至2018年8月北京大学肿瘤医院收治的进展期三阴性乳腺癌患者的临床资料。纳入标准:①经病理活检确诊为进展期三阴性乳腺癌;②美国东部肿瘤协作组体力状态评分≤2分;③至少接受2个周期的治疗或至少进行过1次疗效评估;④病灶可测量。依据纳入标准,共纳入210例进展期三阴性乳腺癌患者,年龄21~75岁,平均发病年龄(49.0±9.4)岁;依据是否接受铂类化疗药物治疗分为治疗组(n=86)和对照组(n=124)。两组患者年龄比较,差异有统计学意义(χ2=3.929,P﹤0.01);但两组患者的家族史、病理类型和TNM分期(根据美国癌症委员会第7版TNM分期标准[8])等基本临床特征比较,差异均无统计学意义(P﹥0.05)(表1),具有可比性。
1.2 治疗方法
治疗前,对所有患者进行影像学检查,且每6~12周进行一次影像学评估,如病情变化随时进行影像学评估。对照组三阴性乳腺癌患者未接受铂类化疗药物治疗(包括接受紫杉类药物、蒽环类药物、吉西他滨、卡培他滨、长春瑞滨、抗血管生成药物等的单药或联合治疗方案),治疗组患者接受铂类化疗药物治疗(卡铂单药,卡铂或顺铂与紫杉类药物、吉西他滨、卡培他滨、长春瑞滨或抗血管生成药物等的联合治疗方案)。收集两组患者外周血标本,通过二代测序法检测患者BRCA基因突变情况。
1.3 观察指标和评价标准
根据实体肿瘤疗效评价标准(RECIST 1.1)[9]评估三阴性乳腺癌患者的肿瘤缓解情况:完全缓解(complete response,CR),所有目标病灶消失,至少维持4周;部分缓解(partial response,PR),基线病灶长径总和缩小≥30%,至少维持4周;疾病进展(progressive disease,PD),基线病灶长径总和至少增加≥20%或出现新病灶;疾病稳定(stable disease,SD),基线病灶长径总和缩小未达PR或增加未达PD。比较两组患者的临床获益率(clinical benefit rate,CBR)和无进展生存时间(progress free survive,PFS),CBR指临床疗效达到CR、PR或SD,至少维持24周的患者所占百分比;PFS指治疗开始至PD或由于任何原因而导致死亡的时间。按是否内脏转移、肺转移、肝转移、胸壁转移、骨转移、淋巴结转移(脑转移患者仅8例,2例接受过铂类药物治疗,因数据有限,故未作分层分析)对三阴性乳腺癌患者进行分层,比较含铂类和不含铂类化疗方案的CBR和PFS情况。此外,比较两组患者中BRCA基因野生型和突变型患者的CBR和PFS情况。
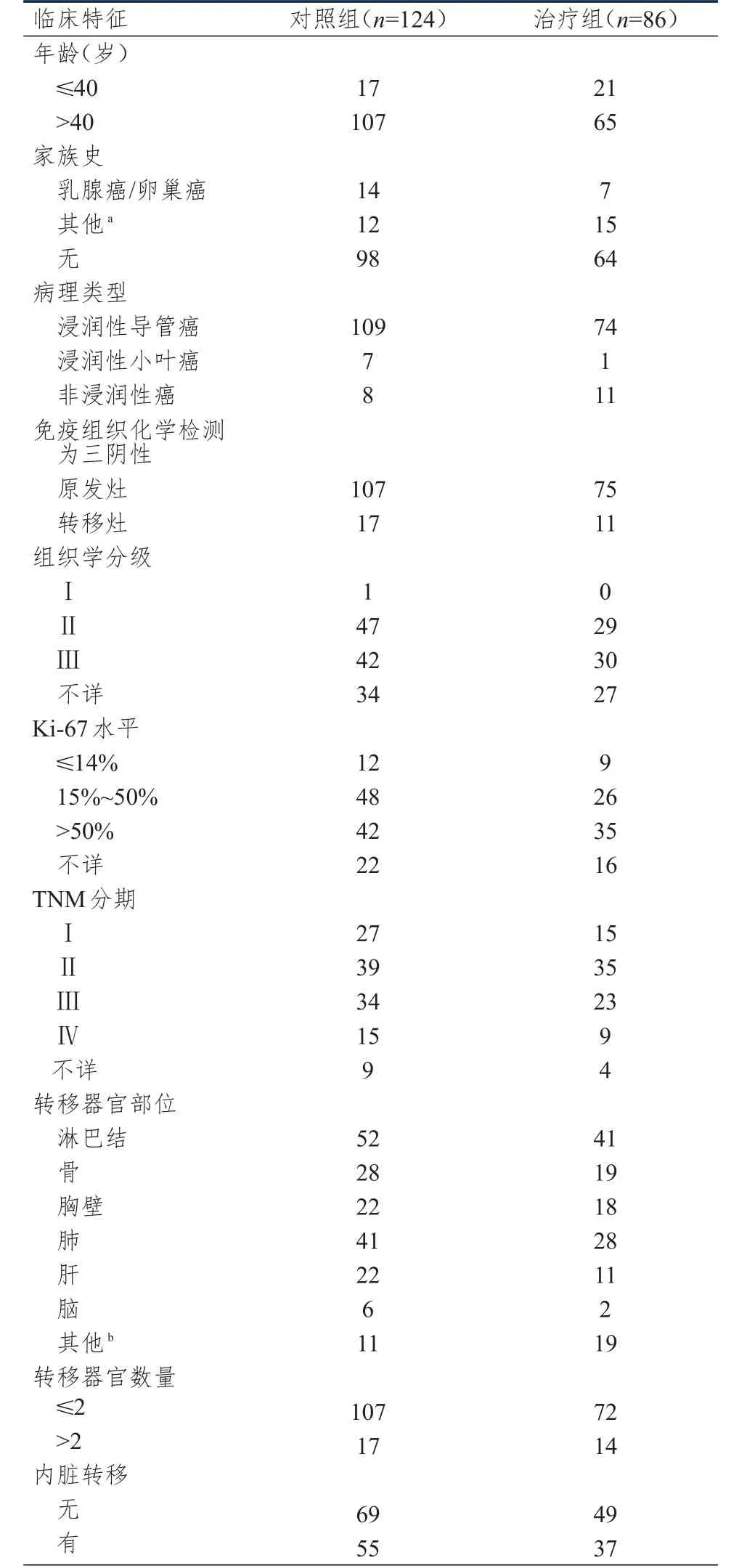
表1 两组进展期三阴性乳腺癌患者的基本临床特征
1.4 随访方法
采用门诊随访或电话随访对所有三阴性乳腺癌患者进行随访,随访时间1.7~95.0个月,平均随访时间(19.8±18.2)个月,随访截止日期为2018年8月31日。
1.5 统计学分析
采用SPSS 22.0软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验;计数资料采用例数和率(%)表示,组间比较采用χ2检验;采用Kaplan-Meier法绘制生存曲线,生存时间的比较采用Log-rank检验。以P﹤0.05为差异有统计学意义。
2 结果
2.1 三阴性乳腺癌患者的CRB和PFS
治疗组患者CBR为51.2%(44/86),与对照组患者的47.6%(59/124)比较,差异无统计学意义(P﹥0.05);且治疗组患者的中位PFS为6.7个月(95%CI:5.2~8.2),与对照组的 5.8个月(95%CI:4.6~7.0)比较,差异无统计学意义(P﹥0.05)。按转移部位对三阴性乳腺癌患者进行分层分析,结果显示,含铂类和不含铂类化疗方案治疗后不同转移部位三阴性乳腺癌患者的CBR和PFS比较,差异均无统计学意义(P﹥0.05)(表2)。

表2 不同转移部位三阴性乳腺癌患者的CRB和PFS
2.2 BRCA基因野生型和突变型三阴性乳腺癌患者的CRB和PFS
210例三阴性乳腺癌患者中,治疗组29例患者检测过BRCA基因,其中8例为突变型,21例为野生型;对照组中30例患者检测过BRCA基因,其中6例为突变型,24例为野生型。治疗组中,BRCA基因野生型患者CBR为23.8%(5/21),低于BRCA基因突变型患者的87.5%(7/8),差异有统计学意义(P﹤0.01);且BRCA基因野生型患者的中位PFS为4.5个月(95%CI:3.2~5.9),短于BRCA基因突变型患者的14.9个月(95%CI:2.8~27.0),差异有统计学意义(χ2=5.609,P﹤0.05)(图 1)。对照组中,BRCA基因野生型患者CBR为29.2%(7/24),低于BRCA基因突变型患者的83.3%(5/6),差异有统计学意义(P﹤0.05);BRCA基因野生型患者的中位PFS为4.1个月(95%CI:2.9~5.3),短于BRCA基因突变型患者的6.0个月(95%CI:4.9~7.1),但差异无统计学意义(χ2=2.611,P﹥0.05)(图2)。
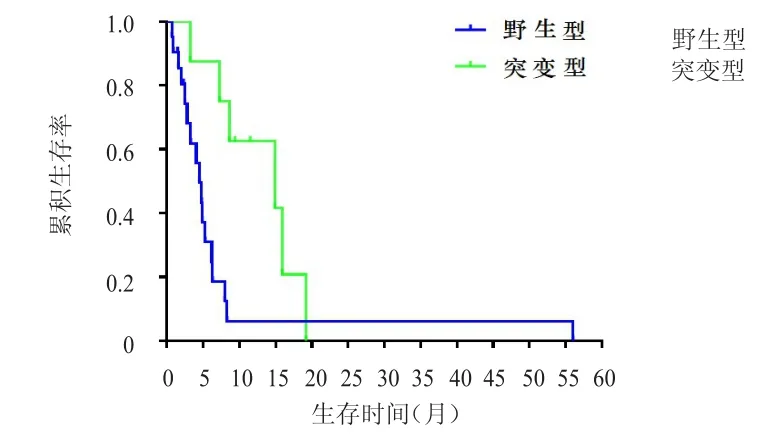
图1 治疗组BRCA基因野生型( n=21)和突变型( n= 8)三阴性乳腺癌患者的PFS曲线
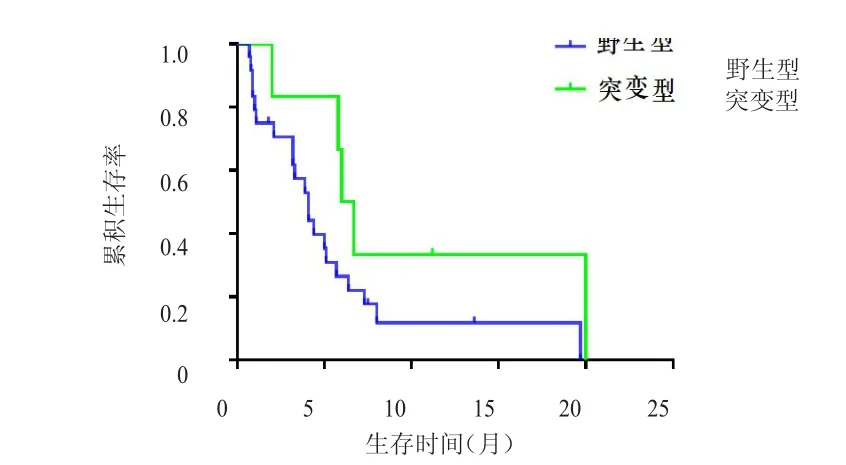
图2 对照组BRCA基因野生型( n=24)和突变型( n= 6)三阴性乳腺癌患者的PFS曲线
3 讨论
三阴性乳腺癌患者2年内复发率约为36.3%,2~3年的复发率约为27.8%[10],且术后2~3年是肿瘤细胞的转移高峰[11],包括内脏转移(以肺转移最为常见[12],其次为肝转移,中枢神经系统转移亦较其他亚型常见)和非内脏转移(以淋巴结转移和骨转移最常见[13-14])。三阴性乳腺癌患者可同时出现多个器官转移[15],首次发病即为多发转移性的比例达79.2%[12]。本研究中210例三阴性乳腺癌患者的常见转移部位为淋巴结(44.3%)、肺(32.9%)、骨(22.4%),与上述研究结果基本一致。
BRCA1或BRCA2基因突变与乳腺癌发生发展密切相关[5],BRCA1基因突变携带者在70岁时的乳腺癌累积发病风险约为57%,而BRCA2基因突变携带者约为49%[16]。乳腺癌患者三阴性亚型BRCA基因突变频率高于其他亚型。北京大学肿瘤医院谢云涛研究小组统计发现,乳腺癌中BRCA1或BRCA2基因突变率为5.3%,其中三阴性亚型最高,为11.2%[17]。研究显示,有乳腺癌或卵巢癌家族史的乳腺癌患者BRCA基因突变的频率较高,约为12.7%[18]。BRCA基因突变可以导致同源重组缺陷,使细胞断裂的DNA链修复受阻,对作用于DNA的药物更敏感[19-22]。
铂类化疗药物治疗晚期乳腺癌有一定的临床疗效,可损伤肿瘤细胞的DNA,进而杀灭肿瘤细胞[23]。因此,铂类药物在三阴性,尤其是伴BRCA基因突变的乳腺癌患者中疗效更好[23-24]。研究表明,采用铂类化疗药物进行新辅助化疗,可提高BRCA突变患者的病理学完全缓解率,从而延长患者总生存时间[25-26]。TNT研究[7]和 CBCSG006研究[4]结果显示,含铂类药物的化疗方案,治疗BRCA基因突变的进展期三阴性乳腺癌患者的客观缓解率和PFS更优。本研究结果显示,治疗组进展期三阴性乳腺癌患者的CBR和PFS均优于对照组,但差异无统计学意义;治疗组BRCA基因突变型患者的CBR、PFS均优于野生型,表明BRCA基因突变的进展期三阴性乳腺癌患者可以从铂类化疗药物的治疗中获益,但尚需更长时间的随访以进一步验证。此外,铂类化疗药物的不良反应如骨髓抑制、消化道反应等[4],是否会影响患者的生存获益也未明确。本研究结果显示,铂类化疗药物在肝转移患者中的效果较好,但与无铂类化疗方案的临床疗效无差异,铂类化疗药物的临床疗效与转移部位是否相关,尚需进一步研究。
综上所述,铂类化疗药物一线治疗进展期三阴性乳腺癌的临床疗效与其他治疗方案无差异,但在有BRCA基因突变的患者中疗效较好,因此,无BRCA基因突变的患者中,铂类化疗药物不是优选方案。
