多排螺旋CT尿路造影对尿路上皮肿瘤和泌尿系息肉的鉴别诊断价值
2019-04-15刘范林蒋群王雪松孙昊金征宇攀枝花市第二人民医院放射科四川攀枝花67068中国医学科学院北京协和医学院北京协和医院放射科北京00730
刘范林,蒋群,王雪松,孙昊,金征宇攀枝花市第二人民医院放射科,四川 攀枝花 67068 中国医学科学院北京协和医学院北京协和医院放射科,北京 00730
尿路上皮肿瘤包括肾盂癌、输尿管癌及膀胱移行上皮癌,其临床发病率为尿路肿瘤的5%~10%[1]。尿路上皮肿瘤的临床表现为多发无痛性肉眼血尿或镜下血尿,可出现膀胱刺激征及腰部胀痛等症状。尿路上皮肿瘤的恶性程度较高,容易发生种植、局部浸润及淋巴结转移,临床预后相对较差。泌尿系纤维上皮息肉是一种罕见的尿路良性肿瘤,约85%发生于输尿管,约15%发生于肾盂,少数发生于膀胱或后尿道[2]。继发于结石的输尿管息肉在临床上较为常见,而原发性输尿管息肉并不多见。原发性输尿管息肉多发生于40岁以下患者,术前误诊率较高,易导致不必要的肾输尿管切除[3]。近年来国内外对尿路上皮肿瘤与泌尿系息肉的鉴别诊断少有报道,尿路上皮肿瘤与泌尿系息肉的临床表现及影像学特点具有一定的相似性,计算机体层摄影(computed tomography,CT)检查对两者的鉴别诊断具有很大的局限性。临床上对这两种肿瘤的处理方式及患者的预后有很大的不同,因此明确诊断极为重要,通过计算机体层摄影尿路造影(computed tomography urography,CTU)检查可以无创、快速地获得临床影像学信息。本文旨在分析尿路上皮肿瘤和泌尿系息肉的CTU表现,探讨CTU对尿路上皮肿瘤及泌尿系息肉的鉴别诊断价值,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析2014年12月至2017年6月于北京协和医院诊断为泌尿系息肉和尿路上皮肿瘤患者的临床资料。纳入标准:①术前均行CTU检查;②术后组织病理学检查证实为尿路上皮肿瘤或泌尿系息肉。排除标准:合并严重心、肺、肝、肾功能不全者。根据纳入和排除标准,本研究共纳入10例泌尿系息肉患者和30例尿路上皮肿瘤患者。泌尿系息肉患者中,男7例,女3例;年龄18~83岁,平均(38.8±20.1)岁。尿路上皮肿瘤患者中,男11例,女19例;年龄21~82岁,平均(63.6±13.1)岁。
1.2 检查方法
全部患者在接受CTU检查前45 min内饮水1000 ml并嘱憋尿以充盈膀胱。使用西门子Flash双源双能量CT,患者取仰卧位,先行常规腹盆部屏气定位相,然后行腹盆部平扫。平扫参数:管电压120 kVp,开启实时动态曝光剂量调节(Care Dose 4D),球管旋转时间0.5 s,准直128 mm×0.6 mm,螺距0.9,重建层厚1 mm,重建间距1 mm。平扫完成后,在患者肘前静脉埋置18G套管针,采用双筒高压注射器以5 ml/s的速度注入100 ml非离子型对比剂碘帕醇(370 mgI/ml),注射前将对比剂加热至37℃以降低对比剂的黏滞性和对穿刺静脉的刺激性。对比剂注射完毕后再以相同速度注射100 ml 0.9%氯化钠溶液。延迟75 s行肾实质期双能量扫描,对比剂注射完毕后延迟550 s行排泄期Flash大螺距扫描。实质期双能量扫描参数:A、B球管的管电压/管电流分别为Sn140 kVp/178 mAs和100 kVp/230 mAs,开启Care Dose 4D,球管旋转时间0.5 s,准直32 mm×0.6 mm,螺距0.9,视野330 mm,双能量图像构成比为0.5(Sn140 kVp和100 kVp数据比率分别为50%,通过后处理计算合成120 kV图像),自动重建层厚1 mm,重建间距1 mm,得到Sn140 kVp、100 kVp和后处理合成的120 kV共3组图像。排泄期Flash大螺距扫描参数:管电压100 kVp,开启Care Dose 4D,球管旋转时间0.28 s,准直128 mm×0.6 mm,螺距3.0,重建层厚1 mm,重建间距1 mm。3期扫描范围均为膈顶至盆底水平。
1.3 图像分析
首先由1名放射科住院医师在图像后处理工作站的“3D”软件中对薄层图像进行三维后处理,包括多平面重组(multiplanar reformation,MPR)、最大密度投影(maximum intensity projection,MIP)以及容积再现(volume rendering,VR)。然后由2名放射科高年资医师共同阅读CTU轴位及三维后处理图像,分析影像图特征:①病灶的部位、数目、形态、直径、密度;②病灶的强化方式及强化程度;③输尿管、肾盂肾盏积水程度(无、轻度、中度、重度);④病灶周围的情况及与邻近脏器的关系。意见不一致时通过讨论得出一致意见。
1.4 统计学分析
采用SPSS 21.0软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验;计数资料以例数和率(%)表示,组间比较采用Fisher确切概率法。绘制受试者工作特征(receiver operating characteristic,ROC)曲线并计算曲线下面积(area under curve,AUC)。以P﹤0.05为差异有统计学意义。
2 结果
2.1 泌尿系息肉患者的临床特征
10例泌尿系息肉中,6例位于输尿管腹段,2例位于输尿管盆段,2例位于膀胱。6例输尿管腹段息肉中,左侧3例,右侧2例,双侧1例;2例输尿管盆段息肉中,左右侧各1例;2例膀胱息肉中,膀胱右后壁1例,膀胱颈部、左侧壁、右侧壁及顶壁偏右侧多发者1例。泌尿系息肉直径为4.1~13.5 mm,平均(9.3±2.6)mm,形态呈类圆形、椭圆形及不规则形;其中1例患者可见裂隙征,对比剂进入。临床表现:3例患者可见肉眼血尿,1例患者体检发现右肾积水,4例患者腰、腹部间断性疼痛,1例患者左肾结石8年、间断左腰痛半年,1例患者体检发现膀胱占位。平扫CT值为19~42 HU,增强扫描实质期CT值为29~93 HU,排泄期CT值为42~112 HU。泌尿系积水程度:3例患者无积水,1例患者双侧上段输尿管及肾盂肾盏轻度积水,1例患者右侧肾盂肾盏及输尿管起始部中度积水,1例患者右侧输尿管盆段轻度积水,1例患者左侧肾盂肾盏轻度积水,1例患者右侧输尿管起始部及肾盂肾盏重度积水,1例患者左侧肾盂肾盏重度积水(图1),1例患者左侧输尿管上段、左侧肾盂肾盏重度积水。
2.2 尿路上皮肿瘤患者的临床特征
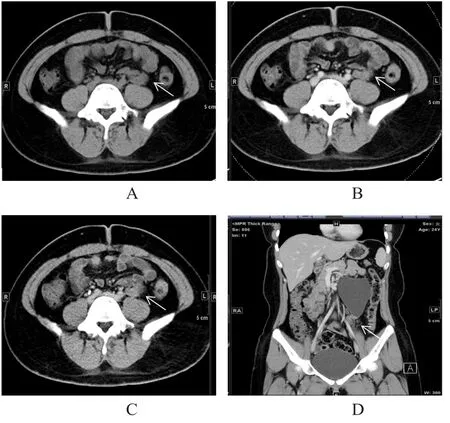
图1 典型左肾盂输尿管移行处息肉患者的影像图
30例尿路上皮肿瘤中,4例位于输尿管腹段(其中肾盂输尿管移行部1例),14例位于输尿管盆段,6例位于输尿管腹盆段,1例位于输尿管多节段,5例位于膀胱。4例输尿管腹段尿路上皮肿瘤中,左侧输尿管腹段2例,右侧输尿管腹段末端1例,右肾盂输尿管移行部1例;14例输尿管盆段尿路上皮肿瘤中,右侧输尿管盆段3例,左侧输尿管盆段11例,其中左侧输尿管盆段多发节段性占位1例,左侧输尿管膀胱连接处占位4例;6例输尿管腹盆段尿路上皮肿瘤中,左侧输尿管腹盆段2例,左侧输尿管腹盆段交界处1例,右侧输尿管腹盆段1例,右侧输尿管腹段及膀胱入口段1例,右侧输尿管腹盆段交界处1例;1例输尿管多节段尿路上皮肿瘤,位于右侧;5例膀胱尿路上皮肿瘤中,膀胱左后壁占位2例,膀胱左后壁增厚1例,膀胱右后壁占位2例。尿路上皮肿瘤直径为8.1~51.5 mm,平均(18.3±13.2)mm,形态不规则,输尿管管壁局限性增厚;其中10例具有裂隙征。临床表现:16例患者因肉眼血尿入院,7例患者体检发现肾积水(其中2例右肾积水,5例左肾积水),4例患者腰部疼痛,1例患者体检发现左侧输尿管结石,1例患者体检发现右侧输尿管占位,1例患者体检发现膀胱占位。尿路上皮肿瘤患者的平扫CT值为25~51 HU,增强扫描实质期CT值为48~95 HU,排泄期CT值为26~93 HU。泌尿系积水程度:5例患者无积水,1例患者右侧肾盂肾盏轻度积水,8例患者输尿管、肾盂肾盏轻度积水(其中左侧7例,右侧1例),4例患者输尿管、肾盂肾盏中度积水(其中左侧3例,右侧1例),1例患者左侧肾盂肾盏重度积水,11例患者输尿管、肾盂肾盏重度积水(其中左侧4例,右侧7例)(图2)。
2.3 尿路上皮肿瘤与泌尿系息肉患者临床特征的比较
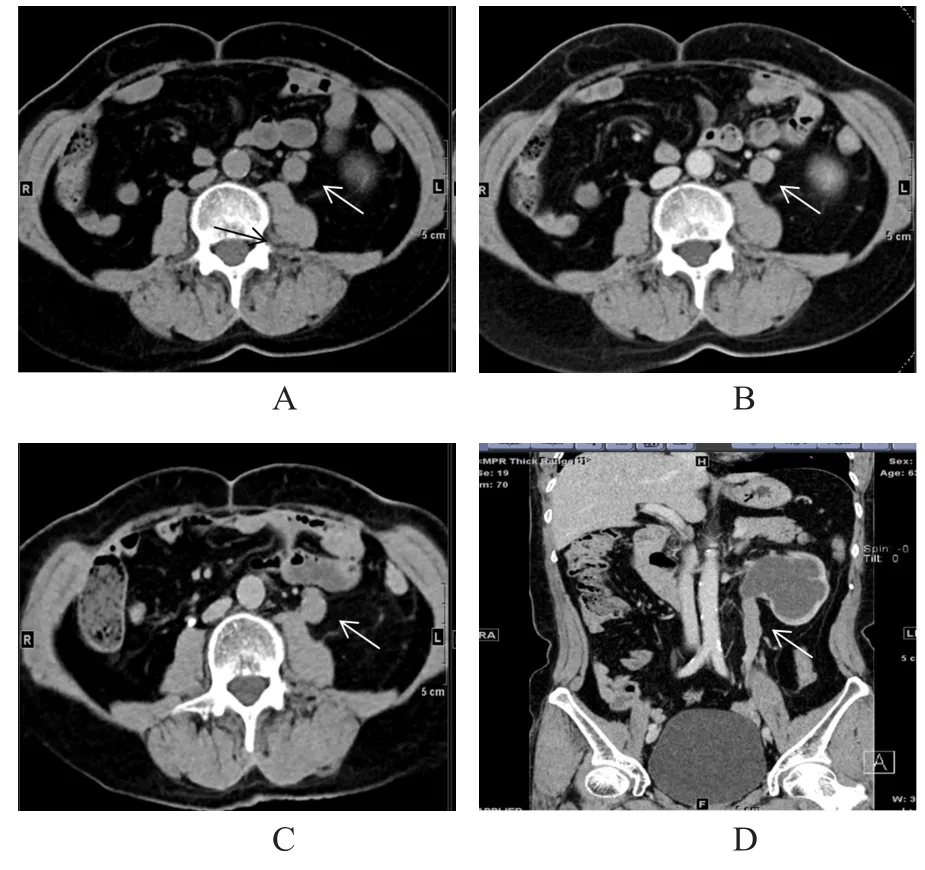
图2 典型左侧输尿管腹段尿路上皮肿瘤患者的影像图
尿路上皮肿瘤患者的发病年龄、肿瘤直径、平扫CT值、实质期CT值及(实质期-平扫)CT值均明显大于泌尿系息肉患者,差异均有统计学意义(P﹤0.01)。尿路上皮肿瘤和泌尿系息肉患者的排泄期CT值比较,差异无统计学意义(P﹥0.05)。(表1)
2.4 ROC曲线分析
实质期CT值鉴别两种病变的灵敏度和特异度与肿瘤直径、平扫CT值及(实质期-平扫)CT值诊断的灵敏度和特异度比较,差异均无统计学意义(P﹥0.05),但其曲线下面积(area under curve,AUC)最大,为0.932。因此,实质期CT值对尿路上皮肿瘤和泌尿系息肉的鉴别诊断效能最高,以71.0 HU作为临界值,灵敏度为83.3%,特异度为90.0%,阳性预测值为96.2%,阴性预测值为64.3%,准确度为85.0%。(表2、图3)
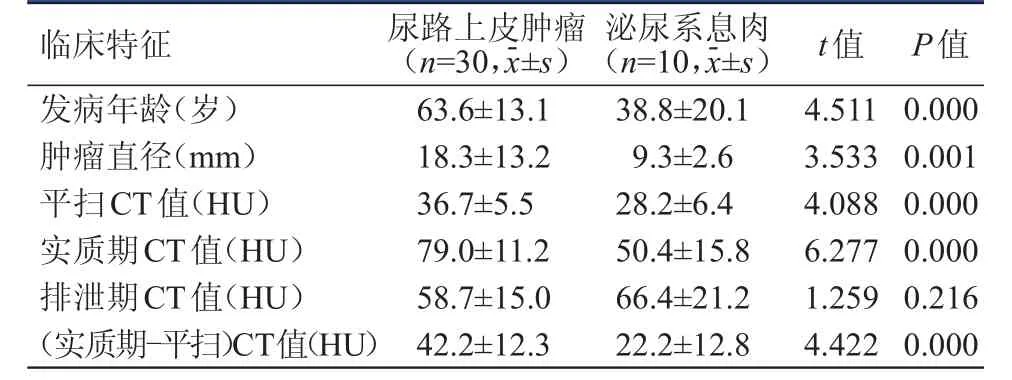
表1 尿路上皮肿瘤与泌尿系息肉患者临床特征的比较
2.5 尿路上皮肿瘤与泌尿系息肉临床征象的比较
尿路上皮肿瘤和泌尿系息肉患者血尿、肾盂肾盏重度积水、裂隙征的发生率比较,差异均无统计学意义(P﹥0.05)。(表3)
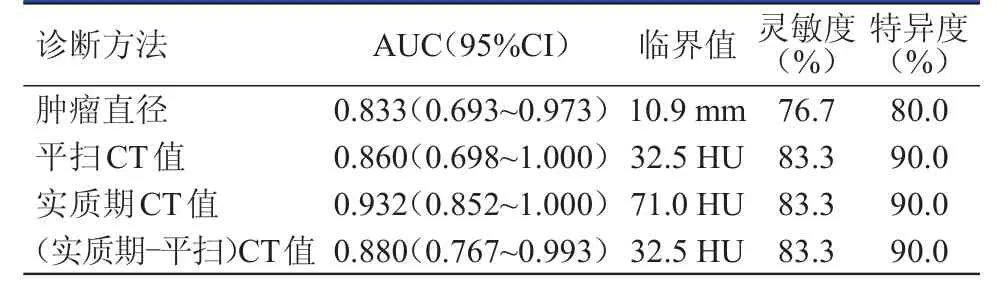
表2 不同诊断方法对尿路上皮肿瘤和泌尿系息肉的诊断效能
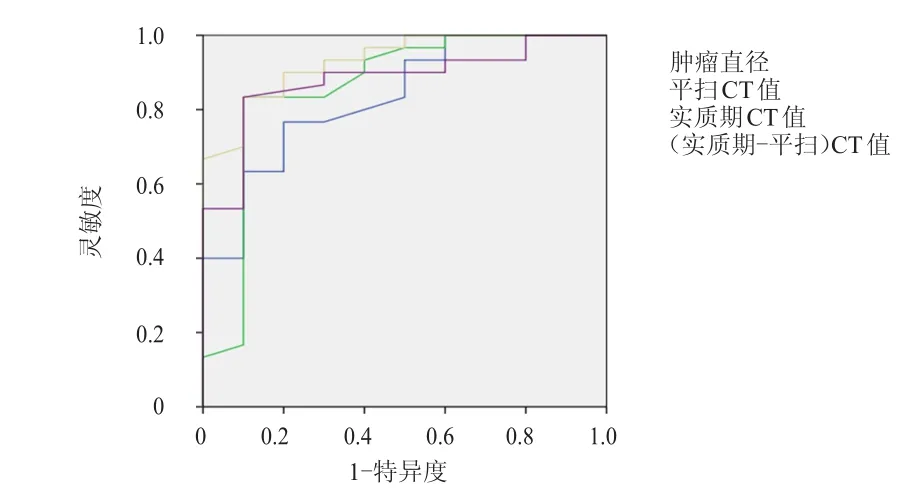
图3 不同方法诊断尿路上皮肿瘤和泌尿系息肉的RROOCC曲线
3 讨论
尿路上皮首先由Melicow和Pachter[4]提出,是基于肾盏、肾盂、输尿管、膀胱及前列腺部尿道皆被覆移行上皮细胞,各段的移行上皮胚胎学来源相同,细胞形态、组织学形态相同,各段的功能为引流尿液,尿液通过时移行上皮无改变,于是将这一系统的移行上皮称为尿路上皮[5]。尿路上皮肿瘤是泌尿系统最常见、发病率较高的肿瘤,主要包括膀胱尿路上皮肿瘤、肾盂尿路上皮肿瘤、原发性输尿管尿路上皮肿瘤、尿道上皮肿瘤。由于尿路上皮肿瘤来源于尿路移行上皮,因此肾盂癌、输尿管癌和膀胱癌具有相似的生物学行为及肿瘤特性[6],尿路上皮肿瘤的发病率和病死率高居泌尿系统肿瘤的首位[7]。其中大部分为膀胱肿瘤,占全部尿路上皮肿瘤的90%~95%[8]。一般认为尿路上皮肿瘤的病因与化学致癌物、环境因素、病毒、慢性炎性刺激、结石等诸多因素有关,此外,吸烟、某些药物的滥用也与肿瘤的发病有着密切的关系[9]。无痛性血尿是尿路上皮肿瘤患者最常见的临床症状,多数为肉眼血尿,少数为镜下血尿。根据血尿诊断尿路上皮肿瘤的灵敏度和特异度均较低,很多泌尿系疾病如前列腺增生、结石和息肉均可表现为血尿。

表3 尿路上皮肿瘤与泌尿系息肉患者的临床征象[[ nn(%%)]]
泌尿系纤维上皮息肉是输尿管最常见的良性病变,可能发生于任何年龄,通常在30~40岁发病[2,10],男性和女性的发病比例约为1.5∶1[9],病变多发于左侧,病因尚不明确,先天性发育异常、梗阻、创伤、刺激、感染或激素紊乱都可能是其发病原因[11]。纤维上皮息肉是起源于中胚层的良性肿瘤,表面光滑、可移动、有蒂,有完整的黏膜面,通常表现为圆柱形,很少有分叶[12]。大多数病变是孤立的,双侧输尿管息肉罕见,大部分的输尿管息肉常合并结石,输尿管息肉合并结石属于原发性输尿管息肉,输尿管结石合并息肉属于继发性输尿管息肉的范畴[13],结石长期嵌顿于输尿管内,对局部黏膜产生损伤和慢性机械性刺激,使输尿管产生局限性炎性增生,在部分患者中可能发展形成良性息肉,以腹痛、血尿、尿频为主要的临床症状[2]。
尿路上皮肿瘤和泌尿系息肉的术前鉴别通常是不准确的,两种肿瘤患者都伴有腰痛、血尿等临床特点,临床表现及体征无明显的特异性,影像诊断无法很好地鉴别这两种疾病[14]。两种疾病的影像学特点在静脉肾盂造影(intravenous pyelography,IVP)、传统CT及磁共振成像(MRI)上无特异性[15]。Adey等[16]报道9例泌尿系纤维上皮息肉,术前仅2例患者通过IVP明确诊断。既往有文献报道泌尿系纤维上皮息肉误诊为尿路上皮肿瘤,因此术前应用正确的影像学方法明确诊断具有重要的临床意义[17]。目前,国内外有关尿路上皮肿瘤与泌尿系息肉影像学鉴别诊断的报道较少,有研究报道输尿管癌与输尿管息肉的螺旋CT诊断结果,利用螺旋CT平扫和4期增强扫描以及MPR、曲面重建、CTU影像表现,观察输尿管息肉和输尿管癌的强化方式、形态特征及二者的CT表现,发现两种疾病的增强幅度具有差异[18],但上述研究仅提供了两种疾病增强特点及增强幅度的差异性,未应用统计学分析方法,未分析灵敏度及特异度等数据,无法提供较明确的诊断依据。尿路上皮肿瘤与泌尿系息肉均可表现为占位、血尿、肾盂肾盏积水且强化趋势具有相似性,两种疾病的鉴别诊断往往依靠诊断医师的主观判断并缺乏相应的特异性,因此常规CT扫描对尿路上皮肿瘤及泌尿系息肉的鉴别诊断尚存在困难。此外,这两种疾病的临床处理方式具有一定的差异,误诊或者延误治疗将会对患者的预后造成很大影响,因此明确诊断对临床合理治疗具有至关重要的作用。
本研究结果显示,尿路上皮肿瘤患者的发病年龄为(63.6±13.1)岁,明显高于泌尿系息肉患者的(38.8±20.1)岁,差异有统计学意义(P﹤0.01)。此结果符合肿瘤恶性病变与良性病变发病年龄的趋势及既往研究报道输尿管癌及输尿管息肉的发病年龄[19-20]。尿路上皮肿瘤患者的肿瘤直径为(18.3±13.2)mm,明显大于泌尿系息肉患者的(9.3±2.6)mm,差异有统计学意义(P﹤0.01)。病灶直径的评价纳入本研究是因为两种疾病的病理类型不同,病灶的生长方式不同,直径是对病灶最直观且最重要的评估指标。尿路上皮肿瘤患者的平扫CT值、实质期CT值、(实质期-平扫)CT值分别为(36.7±5.5)、(79.0±11.2)、(42.2±12.3)HU,均明显高于泌尿系息肉患者的(28.2±6.4)、(50.4±15.8)、(22.2±12.8)HU,差异均有统计学意义(P﹤0.01)。尿路上皮肿瘤患者的CT值在增强实质期达到峰值,泌尿系息肉患者的CT值在增强排泄期达到峰值,两组患者的排泄期CT值比较,差异无统计学意义(P﹥0.05)。其与两组疾病的病理类型相关,尿路上皮肿瘤符合移行细胞癌恶性病变的特点,肿瘤新生血管增多,增强后CT值提前达到峰值,而泌尿系纤维上皮息肉属于良性病变,增强呈缓慢持续强化趋势,排泄期CT值达到峰值。ROC曲线分析结果显示,肿瘤直径、平扫CT值、实质期CT值的临界值分别为10.9 mm、32.5 HU、71.0 HU,若大于上述值,应首先考虑尿路上皮肿瘤。实质期CT值鉴别两种疾病的诊断效能最高(其AUC最大,为0.932),以71.0 HU作为临界值,灵敏度为83.3%,特异度为90.0%,阳性预测值为96.2%,阴性预测值为64.3%,准确度为85.0%,AUC为0.932。尿路上皮肿瘤和泌尿系息肉患者血尿、肾盂肾盏重度积水、裂隙征的发生率比较,差异均无统计学意义(P﹥0.05)。
本研究尚存在一些不足之处:①本研究仅为回顾性分析;②本研究收集的病例数相对较少,泌尿系息肉是少见疾病,感兴趣区的划定没有明确的标准,可能导致所测得的数值具有偏差,造成ROC曲线所得各参数值的精确度不够,有待进一步扩大样本量进行验证。
综上所述,尿路上皮肿瘤与泌尿系息肉患者的发病年龄、肿瘤直径、平扫CT值、实质期CT值及(实质期-平扫)CT值均具有一定的差异,有助于两者的鉴别诊断,且实质期CT值的诊断效能最高,具有重要的临床意义。
