骨髓间充质干细胞对肺癌细胞生长和凋亡的影响
2019-04-15刘培俊
张 慧 刘培俊 黄 华 黄 敏
人骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是1类具有自我更新和多项分化能力的干细胞,在组织修复,器官再生治疗中得到一定的临床效果[1]。研究发现,BMSCs具有向肿瘤组织趋化和低免疫原型的特性,与肿瘤组织的发生和发展有着密切的关系[2-3]。本文就BMSCs对Balb/c-nu裸鼠皮下移植肺癌组织的生长和凋亡进行研究。
1 材料与方法
1.1 实验动物
3~4周龄Balb/c-nu雌性裸鼠由湖北省实验动物中心饲养。动物饲养和处理符合《关于善待实验动物的指导性意见》的规定。
1.2 材料
人BMSCs细胞和肺癌A549细胞购自中国科学院细胞库; DMEM细胞培养基、RPMI 1640细胞培养基和胎牛血清购自Gibco公司;RNA提取试剂盒购自康为世纪;基因引物由Invitrogen(上海)贸易有限公司合成。Annexin V-FITC/PI凋亡染色试剂盒购自贝博生物科技有限公司。
1.3 BMSCs细胞表型鉴定
取第3代BMSCs细胞,制成1×106/ml细胞悬液。各取100 μl,分别加入CD14、CD19、CD34、CD44、CD45、CD73、CD166抗体10 μl,避光孵育30 min,洗涤。流式细胞仪检测,Flowjo软件分析结果。
1.4 肺癌A549裸鼠移植瘤模型建立
30只裸鼠采用细胞接种的方法,取1×106A549肺癌细胞悬液接种于左腋下皮下。约4周后肿瘤结节直径达5 mm左右,活动度可。随机将30只裸鼠分为3组,分别为PBS溶液注射组,BMSCs培养上清组,BMSCs移植组。
1.5 BMSCs静脉注射
取第3代BMSCs细胞,制成1×107/ml细胞悬液。各取100 μl,经裸鼠静脉注射细胞悬液。PBS溶液注射组,BMSCs培养上清组分别注射等量体积的PBS溶液和BMSCs培养上清液。每3天注射一次,维持4周。每3天测量肿瘤最长径a;最短径b,计算体积变化(V=0.5ab2)。4周后处死裸鼠,取肺癌组织块。
1.6 A549肺癌细胞分离
用手术剪将肺癌组织块剪成小块(约1 mm2),冲洗,加入0.25%胰酶消化组织块,37 ℃中消化30 min,冲洗,后转移至25 ml细胞培养瓶中,37 ℃培养A549肺癌细胞。
1.7 MTT法检测A549细胞增殖率
消化各组肺癌A549细胞,制成2×104ml细胞悬液。取100 μl细胞悬液接种于96孔板中,每组设5个平行孔。分别培养0、24、48、96 h后,每孔加入5 mg/ml的MTT20 μl,继续培养3 h,每孔加入150 μl二甲基亚砜(DMSO)溶解,震荡10 min,酶标仪测定490 nm波长吸光值(OD值)。
1.8 RT-PCR检测A549细胞凋亡相关基因表达
用RNA提取试剂盒提取各组细胞中的RNA,逆转录合成cDNA后进行实时定量PCR。基因引物P53,P21,Bax,Bcl-2,Caspase-3和β-actin如表1所示。
1.9 流式细胞术检测A549细胞凋亡率
消化各组肺癌A549细胞,制成1×106ml细胞悬液。PBS洗涤,离心。将细胞重悬于150 μl的缓冲液中,加入10 μl Annexin V-FITC和5 μl PI染液,避光孵育15 min,流式细胞仪检测,Flowjo软件分析结果。
1.10 统计学分析
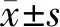

表1 Real-time PCR序列
2 结果
2.1 BMSCs鉴定
流式细胞仪结果显示,BMSCs高表达基质细胞相关表面标记CD44、CD73、CD90、CD166;不表达单核细胞相关表面标记CD14,不表达淋巴细胞相关表面标记CD19,不表达造血干细胞细胞相关表面标记CD34,不表达白细胞相关表面标记CD45(表2)。
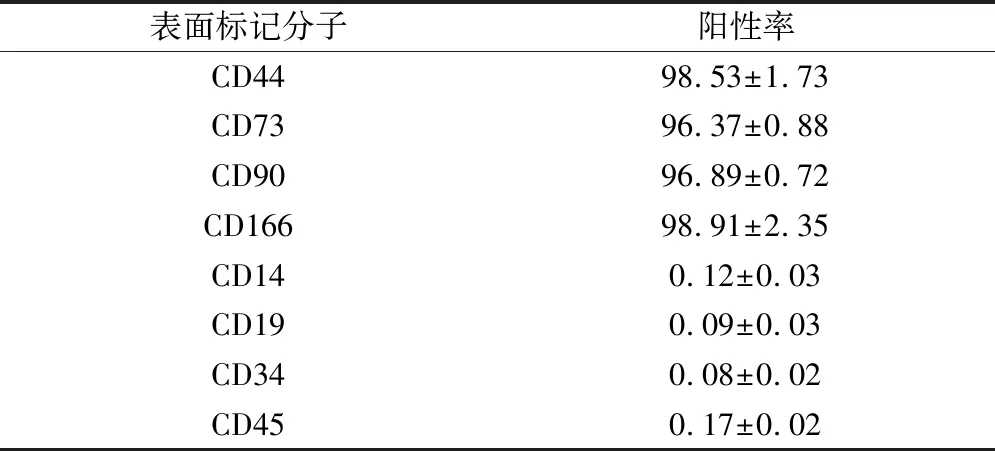
表2 BMSCs表面标记阳性率/%
2.2 BMSCs对Balb/c-nu裸鼠肺癌生长的影响
根据Balb/c-nu裸鼠肺癌体积变化量,发现BMSCs移植组肺癌体积变化量小于PBS组和BMSCs上清组。在第27天,BMSCs移植组肺癌体积为(77.235±0.426);而PBS组和BMSCs上清组肺癌体积分别为(85.360±0.225)和(84.177±0.549)(图1)。
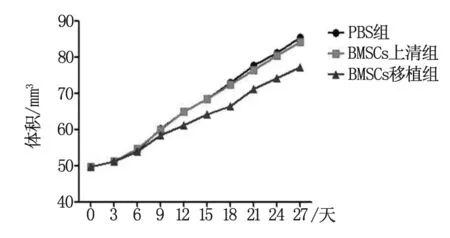
图1 Balb/c-nu裸鼠肺癌生长体积变化
2.3 BMSCs对Balb/c-nu裸鼠肺癌细胞增殖的影响
MTT结果显示,在24、48和96小时观察点,BMSCs移植组肺癌细胞增殖率明显低于PBS组和BMSCs上清组,而PBS组和BMSCs上清组之间细胞增殖未见明显差异(图2)。

图2 各时间点Balb/c-nu裸鼠肺癌细胞增殖情况
2.4 BMSCs对Balb/c-nu裸鼠肺癌细胞凋亡相关基因的影响
RT-PCR结果表明,BMSCs移植组肺癌细胞的P53、P21、Bax、Caspase-3表达量均明显高于PBS组和BMSCs上清组,而PBS组和BMSCs上清组肺癌细胞之间表达未见明显差异。BMSCs移植组肺癌细胞的Bcl-2的表达量明显低于PBS组和BMSCs上清组(图3)。
2.5 BMSCs对Balb/c-nu裸鼠肺癌细胞凋亡的影响
凋亡检测发现,BMSCs移植组肺癌细胞的凋亡率为(17.09±1.92)%,明显高于PBS组和BMSCs上清组肺癌细胞凋亡率,该两组细胞凋亡率分别为(6.47±1.82)%和(5.88±1.39)%。
3 讨论
统计结果显示,随着我国人口老龄化和环境污染程度加重,伴随吸烟等不良习惯的人群增多,我国肺癌发病率每年呈现26.9%的增长[4]。肺癌已成为我国恶性肿瘤死亡的最主要原因,而肺癌患者总体5年生存率低于15%[4-6]。临床上,对于肺癌的治疗方法有限,疗效不佳[6]。因此探讨1种新的治疗肺癌的方法具有重要的意义。
BMSCs是骨髓组织一类具有自我更新、多向分化和损伤趋化特性的非造血性多能干细胞,来源和取材方便。本研究使用的BMSCs高表达基质细胞相关表面标记CD44,CD73,CD90,CD166;不表达单核细胞相关表面标记CD14,不表达淋巴细胞相关表面标记CD19,不表达造血干细胞细胞相关表面标记CD34,不表达白细胞相关表面标记CD45。符合BMSCs的鉴定标准[7]。由于BMSCs的多向分化能力及免疫抑制等特征,已被应用与自身免疫性疾病和移植物抗宿主病的治疗[8-9]。目前,研究发现BMSCs具有肿瘤归巢和免疫原性低等优势,尝试将BMSCs作为趋化因子、细胞因子的载体应用于肿瘤的治疗中,以期获得较好的疗效[10]。在体外研究中,Wang等[11]发现BMSCs在可以抑制肺癌A549细胞的增殖,促进A549凋亡。本文探讨BMSCs对Balb/c-nu裸鼠肺癌A549细胞生长和凋亡的作用,从而为临床运用BMSCs治疗肺癌提供理论基础。
目前对于BMSCs与肿瘤细胞之间的体内相互作用关系尚未明确。Brennen等[12]发现BMSCs可以被前列腺组织募集并促进前列腺癌细胞的生长和恶化。Qi等[13]发现BMSCs可分泌外泌体促进骨肉瘤的增长和转移。但是,Camorani等[14]研究发现BMSCs分泌的细胞因子可以抑制乳腺癌细胞的生长并诱导细胞凋亡。本研究中,为了探究BMSCs与肺癌A549细胞之间的相互关系,构建了肺癌A549皮下移植瘤模型。实验结果发现BMSCs移植可以减缓肺癌A549细胞生长的速度。BMSCs移植处理后的肺癌A549细胞增殖速度下降。
研究发现,细胞的异常凋亡和肿瘤的发生发展也有着密切的关系[15-16]。P53基因属于人体抑癌基因,其可通过P21下游基因与Cyclin-cdk 复合物结合,抑制相关的蛋白激酶活性,导致肿瘤细胞凋亡增加[17]。BMSCs移植组的肺癌A549细胞P53,P21凋亡相关基因表达明显高于PBS组和BMSCs上清组肺癌细胞,提示BMSCs移植可以促进肺癌A549细胞凋亡。Bcl-2家族在肿瘤凋亡中也发挥重要的作用,Bax与Bcl-2的动态平衡调控肿瘤细胞凋亡发生和发展。Bax是促进凋亡的蛋白,而Bcl-2是抑制肿瘤细胞凋亡的蛋白。本实验中,发现BMSCs移植组的肺癌A549细胞Bax,caspase-3凋亡相关基因表达明显高于PBS组和BMSCs上清组肺癌细胞,而Bcl-2明显低于PBS组和BMSCs上清组肺癌细胞。这提示BMSCs移植可以通过Bax和caspase-3通路促进肺癌A549细胞凋亡。另外,流式细胞学结果显示BMSCs移植组的肺癌A549细胞凋亡率明显高于PBS组和BMSCs上清组肺癌细胞。进一步表明BMSCs移植可以促进肺癌A549细胞凋亡。BMSCs移植减缓肺癌A549细胞生长的具体机制可能通过BMSCs分泌的外泌体或者细胞因子,或者通过直接与肺癌A549相互接触从而抑制肺癌A549细胞生长。
图3 Balb/c-nu裸鼠肺癌细胞凋亡相关基因表达情况
本研究表明,BMSCs移植能够减缓肺癌组织生长,移植肺癌A549细胞增殖,增加其凋亡相关基因表达并促进其凋亡。其具体机制有待进一步探究。
