ZNF217在肝细胞癌中的表达及对肿瘤侵袭的影响
2019-04-15姜业臻王宇峰涂康生刘青光
姜业臻 李 超 王宇峰 涂康生 刘青光
我国是世界上原发性肝癌发生率及死亡率最高的国家之一[1],其中主要的病理类型为肝细胞性肝癌(hepatocellular carcinoma,HCC)[2]。高侵袭性导致的肿瘤腹腔播散及多器官转移是导致HCC患者总体生存率较低的主要原因[3]。
在哺乳动物细胞内具有大量含有锌指结构的转录因子,尽管这些转录因子内锌指结构的氨基酸序列相似,但每种转录因子却具有独特的蛋白构象及生物学功能[4]。锌指蛋白217(zinc finger protein 217,ZNF217)是1种位于细胞核内的kruppel样锌指结构转录因子,其表达水平在结肠癌[5]及卵巢癌[6]中均出现异常升高,并与肿瘤细胞增殖、迁移及侵袭特征密切相关,提示ZNF217可能是1种新的肿瘤标志物及分子治疗靶点。本课题旨在通过检测ZNF217在肝癌组织中的表达,分析其与患者肿瘤临床特征之间的关系以及对肝癌细胞侵袭能力的影响及其分子机制,以期为研究ZNF217作为抗HCC侵袭转移治疗靶点提供一定的实验依据。
1 材料与方法
1.1 材料
于我院肝胆外科标本库整理收集在2013年1月1日至2015年1月1日间行手术切除的HCC及癌旁组织标本50例,包括男性38例,女性12例,患者年龄50~71岁,中位年龄56岁。鼠抗人SP免疫组化试剂盒购自北京中杉金桥生物科技有限公司。人永生化肝细胞LO2及肝癌细胞HepG2、Hep3B、SMMC-7721及MHCC97-H均由我实验室保存。鼠抗人ZNF217单克隆抗体(NBP2-46424)购自美国Novus公司;鼠抗人GAPDH(#5174)、E-cadherin(#14472)单克隆抗体及兔抗人Vimentin(#5741)单克隆抗体均购自美国CST公司。DMEM液体培养基及胎牛血清均购自美国Gibco公司。RNA提取试剂Trizol(#15596026)、转染试剂LipofectamineTM3000(#L3000015)及RT-PCR试剂盒(#10928042)均购自美国Invitrogen公司。SYBR Green实时荧光定量PCR试剂盒(#1725120)购自美国BIO-RAD公司。Transwell小室(#3458)购自美国CORNING公司。人工基质胶(#354230)购自美国B&D公司。ZNF217引物(上游5'-ATGTTACTCCTCCTCCGGATG-3';下游5'-ACACTTGGCCTGTATCTCA-3'),GAPDH引物(上游5'-CCAGGGCTGCTTTTAACTCT-3';下游5'-GGACTCCACGACGTACTCA-3')由上海生工生物工程公司合成。ZNF217 siRNA(sc-63249)及阴性对照siRNA购自美国Santa Cruz公司。
1.2 方法
1.2.1 免疫组化染色 福尔马林液固定-石蜡包埋的组织切片常规脱蜡、水化及微波抗原修复,分别用3%过氧化氢及10%山羊血清封闭切片。用鼠抗人ZNF217抗体按1∶100稀释比例浸没组织标本,4 ℃摇晃、孵育过夜。洗净未结合一抗后,使用辣根过氧化物酶标记的山羊抗鼠二抗结合相应一抗,DAB法显示阳性蛋白。按如下方法计算切片染色得分:无阳性染色细胞为0分,阳性染色细胞数<25%为1分,25~50%为2分,50%~75%为3分,>75%为4分。
1.2.2 细胞培养及qRT-PCR 人永生化肝细胞LO2及肝癌细胞HepG2、Hep3B、SMMC-7721及MHCC97-H培养于适宜环境中,稳定传代2~3代。按Trizol说明书指示提取细胞总RNA。每样本取等量RNA配制20 μl的逆转录反应体系合成cDNA。cDNA稀释10倍后取5 μl配制Real-time PCR体系,按如下条件进行PCR反应:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火延伸30 s,扩增40个循环。以GAPDH作为内参,采用2-△△Ct法计算ZNF217 mRNA的相对表达量。
1.2.3 细胞siRNA转染 MHCC97-H细胞以过夜培养达50%~70%之密度接种于6孔板中。ZNF217 siRNA转染分组:阴性对照组(si-Control)每孔加入75 pmol的阴性对照siRNA及7.5 μl转染试剂,ZNF217组每孔加入75 pmol的ZNF217 siRNA及7.5 μl转染试剂;以无血清DMEM培养基调整终体积为2 ml/孔。转染48 h后进行下一步试验。
1.2.4 Transwell侵袭小室模型 用无血清DMEM培养基按1∶8比例稀释50 mg/l的基质胶100 μl/孔覆盖transwell小室上室面,于37 ℃细胞培养箱内风干1 h后备用。取转染48 h后的MHCC97-H细胞用无血清DMEM培养基重悬,以2×105/ml的密度每孔加入100 μl的细胞悬液。24孔细胞培养板内每孔加入750 μl含10%胎牛血清的DMEM培养基。将小室放于24孔板中继续培养24 h。PBS清洗小室、4%多聚甲醛固定,并用0.1%的结晶紫染色10 min。擦除上室面未成功侵袭过小室膜的细胞,显微镜下观察并计数下室面细胞数目。
1.2.5 蛋白免疫印迹检测 MHCC97-H细胞转染72 h后,以RIPA裂解细胞,提取细胞总蛋白并均值化每样本蛋白量。4%~20% SDS-PAGE凝胶每孔加入15 μl蛋白样品,垂直电泳分离蛋白。100 V转膜2 h之条件将目的蛋白转移至NC膜上。5% BSA室温封闭1 h后按1∶1 000比例4 ℃孵育ZNF217、E-cadherin、Vimentin及GAPDH一抗过夜。PBS洗去未结合一抗后采用1∶5 000稀释的HRP标记山羊抗兔二抗室温孵育NC膜1 h。于暗室内,ECL法观察蛋白表达。
1.3 统计学分析

2 结果
2.1 ZNF217在肝癌组织中的表达情况
经免疫组化检测发现,ZNF217主要表达于细胞核及细胞质中。统计学分析表明,HCC组织中的ZNF217的免疫组化评分(2.53±0.31)显著高于癌旁组织评分(1.03±0.33)(P=0.007)。
2.2 肝癌中ZNF217表达与其临床病理特征的关系
50例HCC患者分为ZNF217高表达组(n=32)和ZNF217低表达组(n=18)。高表达ZNF217患者其临床TNM分期较低表达ZNF217的患者更晚(χ2=5.223,P=0.022),见表1。
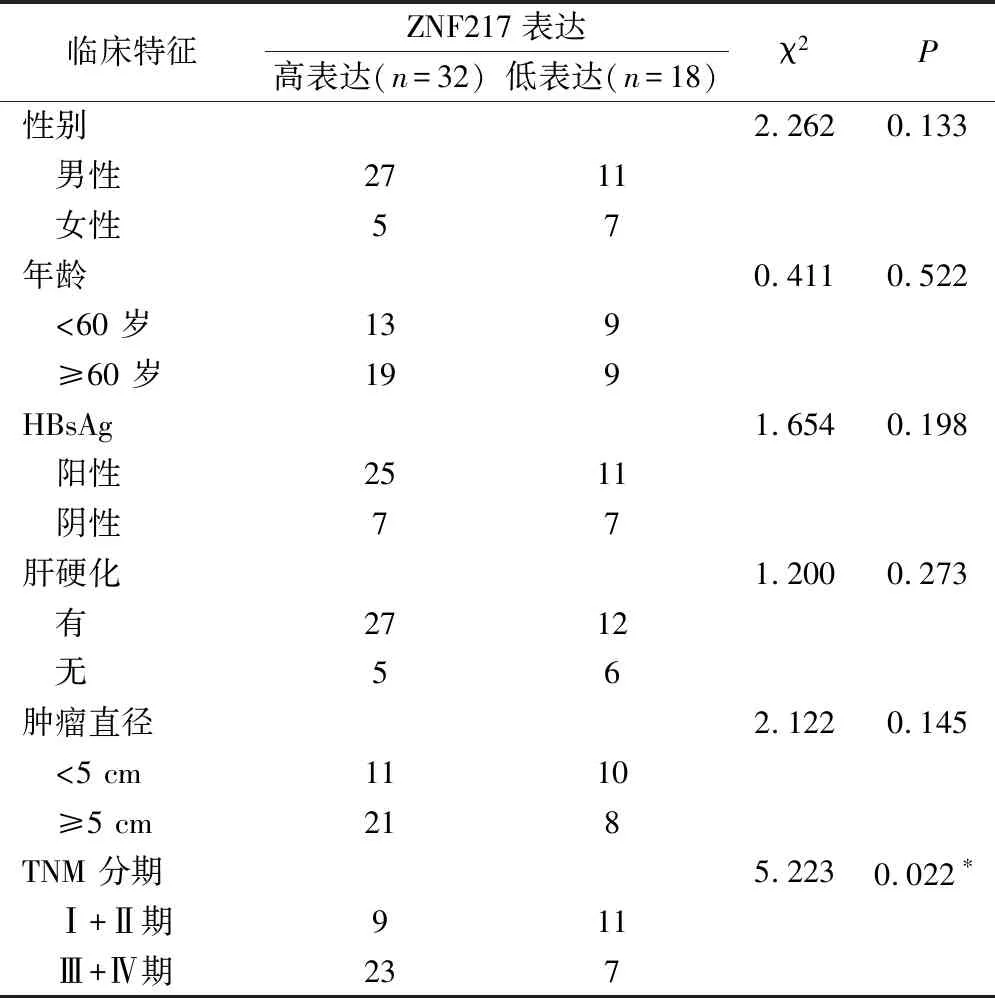
表1 ZNF217表达与肝癌临床特征的相关性/例
注:*为P<0.05。
2.3 siRNA沉默MHCC97-H细胞中ZNF217表达
以LO2中ZNF217 mRNA的表达水平标准化4种肝癌细胞中ZNF217 mRNA的表达水平后发现,除HepG2细胞外,ZNF217 mRNA在其余3种肝癌细胞中的水平均显著高于LO2细胞,差异具有统计学意义(P<0.05,图1A)。向ZNF217 mRNA表达量最高的MHCC97-H细胞内转染入ZNF217特异性siRNA。qRT-PCR及蛋白免疫印迹检测结果证实,siRNA转染下调了MHCC97-H细胞中ZNF217 mRNA(1.00 vs 0.31±0.10,P=0.008,图1B)及蛋白(0.61±0.11 vs 0.17±0.09,P=0.030,图1C)的表达水平,成功建立了肝癌细胞ZNF217敲除模型。
2.4 下调ZNF217的表达抑制MHCC97-H细胞侵袭及EMT现象
如图2A所示,下调ZNF217表达后,侵袭至小室下室面的细胞数目较对照组明显减少[(48.81±7.11)vs (17.42±8.02),P=0.024,图2B)]。上皮-间质化转变(epithelial-mesenchymal transition,EMT)是肿瘤细胞侵袭能力发生变化的众多分子机制之一。如图2B所示,沉默ZNF217后MHCC97-H细胞内E-cadherin蛋白表达水平显著提高[(0.31±0.07) vs (0.78±0.11),P=0.039)],而Vimentin表达水平显著降低[(0.39±0.05)vs (0.09±0.05),P=0.011)]。

A为不同肝癌细胞中ZNF217 mRNA相对表达量;B为siRNA沉默MHCC97-H细胞内ZNF217 mRNA的表达;C为siRNA沉默MHCC97-H细胞内ZNF217蛋白的表达。
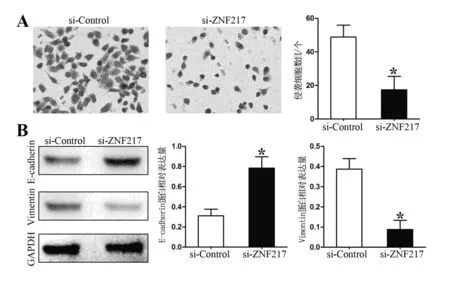
A为沉默ZNF217抑制MHCC97-H细胞的侵袭数目;B为沉默ZNF217对MHCC97-H细胞内E-cadherin及Vimentin表达的影响。
3 讨论
ZNF217位于人类染色体20q13区域,这一区域的基因在人类肿瘤中常常出现异常扩增[7]。目前研究结果[8]也表明,ZNF217也是1种具有促癌作用的蛋白,并且在不同的肿瘤类型中存在异常表达并具有多样化的生物学功能。
首先,ZNF217在包括乳腺癌[9]和前列腺癌[10]在内的多种肿瘤中的表达异常升高,且高表达ZNF217的患者手术后或者化疗后的无病生存率和总生存率较低表达ZNF217的患者更低。在本研究中,我们通过检测50例肝细胞癌组织中ZNF217的表达水平显著高于癌旁组织,高表达ZNF217的患者临床分期(TNM分期)更晚,提示这部分患者预后不良。但是,由于长期随访未完成,我们暂不能得出肝癌组织中ZNF217的表达与患者临床预后间的确切关系,这需要在今后的研究工作中进一步完善。
其次,有证据表明,在卵巢癌[11]及乳腺癌[12]中,ZNF217能够通过持续激活PI3K/Akt及MAPK信号通路维持肿瘤细胞的增殖状态。除此之外,ZNF217还能通过与CoREST形成转录抑制复合物来阻滞细胞周期抑制因子p15ink4b的转录,从而使更多的肿瘤细胞处于DNA复制的S期[13]。但是,ZNF217对于肿瘤细胞侵袭及EMT形成的作用尚不完全明确。在本研究中,我们通过小RNA干扰技术在肝癌细胞中下调ZNF217的表达后,通过transwell侵袭小室模型证实MHCC97-H细胞的侵袭能力受到抑制,创新性的证明了沉默ZNF217表达能够发挥一定的抗肿瘤侵袭作用。上皮间质化转变(epithelial-mesenchymal transition,EMT)是改变肿瘤细胞侵袭能力的重要分子机制之一[14]。目前已确证,Snail、Slug及TWIST等转录调节因子均能够促进肝癌细胞EMT现象的发生,而这些转录因子与ZNF217相似,均具有锌指结构[15]。在本研究中,我们通过蛋白免疫印迹检测证实,在下调ZNF217后,MHCC97-H细胞中上皮标志物E-cadherin的表达显著升高而间质标志物Vimentin的表达显著下调。因此,我们推测ZNF217促进肝癌细胞侵袭可能是通过促进肝癌细胞EMT而实现的。
综上,ZNF217在肝癌组织中表达异常升高,其作为一种癌蛋白,在促进肿瘤侵袭方面具有重要作用。
