食源性抗凝血肽的活性作用机制 及检测方法研究进展
2019-04-12,,,,,,,*,,,*
,,,, , ,,*, ,,*
(1.哈尔滨工业大学化工与化学学院,黑龙江哈尔滨150001; 2.大连工业大学国家海洋食品工程技术研究中心,辽宁大连116034)
心血管疾病(Cardiovascular Disease,CVD),又称循环系统疾病,居全球死亡率首位,预计到2030年将会有超过2360万人死于心血管疾病[1-2]。血栓类疾病是典型的心血管疾病,具有高发病率、高死亡率、高致残率及并发症多的特点。抗凝治疗是预防和治疗血栓的主要手段。目前用于治疗此类疾病的药物主要有肝素、华法林及阿加曲班等。但这些药物都存在一定的副作用,例如引起血小板减少、出血及骨质疏松等。目前,一些肽类化合物已被报道具有显著的抗凝血活性[3]。同时,食源性生物活性肽凭借其吸收性好[4-5]、副作用小[6]等优点日益受到研究者的重视。食源性抗凝血肽主要来源于乳类蛋白[7]、蛋清蛋白[8]及水产蛋白[9-10]等。
由于人体内凝血系统极为复杂,不同抗凝血肽的抗凝机制也不尽相同,主要分为抑制凝血酶活性、抑制除凝血酶之外的其他凝血因子活性及抑制血小板聚集活性。目前体外抗凝血活性肽的筛选检测方法并不成熟完善,没有相对统一且高效的检测方法用于量化评价抗凝血物质的活性效果,因而阻碍了食源性抗凝血肽的研究步伐。本文将从抗凝血肽的活性机制及活性检测方法方面进行综述,以期为食源性抗凝血活性肽的筛选研究奠定基础。
1 抗凝血肽的活性作用机制
1.1 抑制凝血酶
凝血酶(thrombin,EC 3.4.21.5)是一种丝氨酸蛋白酶,也是人体凝血系统中的一种活化的凝血因子(FIIa)[11],在人体内凝血系统中起到重要作用。它能够将纤维蛋白原转变成纤维蛋白,进而纤维蛋白聚集形成血栓;激活部分凝血因子;诱导血小板聚集;主要通过和血管内皮细胞表面PAR1受体结合激活血管内皮细胞。因此,通过抑制凝血酶的活性可以起到抑制血栓形成的作用。
如图1所示,凝血酶共有4个结合位点,包含2个外结合位点,1个Na+结合位点及1个活性中心[12-13]。外结合位点I又称为纤维蛋白原结合位点,带有正电荷氨基酸及部分疏水氨基酸,能识别纤维蛋白原、凝血酶受体等底物带有负电荷的区域。此位点被公认为是许多底物甚至抑制剂的主要结合位点[14]。外结合位点Ⅱ,又称为肝素结合位点,为正电荷氨基酸残基区,它可以与带负电荷的配体如水蛭素、肝素、硫酸软骨素等相互作用[14-15]。因而,凝血酶可以作为抗凝治疗的理想靶点,通过抑制凝血酶的活性可以有效阻碍凝血过程的发生,凝血酶抑制剂是调节血栓形成过程的有效工具。
目前,部分肽类化合物已被发现具有显著的抗凝血活性,部分活性肽的结构也得到进一步鉴定。例如,水蛭素可以在凝血酶的催化位点以及纤维蛋白结合位点与凝血酶1∶1结合形成非共价复合物[16],阻止凝血酶进一步水解纤维蛋白原,从而抑制纤维蛋白聚集。采采蝇凝血酶抑制剂,分子量为3530 Da,除为凝血酶抑制剂之外,也能抑制凝血酶诱导的血小板聚集[17]。此类凝血酶抑制肽尽管抗凝效果良好,但成本较高且较难获得。目前,一些食源性蛋白水解、发酵等产物已被证实具有抗凝血活性,如鱼皮蛋白水解物[18]、豆类蛋白水解物[19]、酪蛋白水解物[7]及贻贝蛋白水解物[20]等。进而,从食物源中深入研究开发具有抗凝血功能的肽类具有广泛的前景。
1.2 抑制除凝血酶外的其他凝血因子
迄今为止,在人体凝血系统中共发现含纤维蛋白原、凝血酶原、组织因子等在内的12种主要凝血因子[21]。它们中绝大多数为蛋白酶类,经活化后在人体凝血止血过程中发挥着重要的作用。因此,只要抑制其中某一种因子的活性就可以起到直接或者间接抑制凝血的作用。其中,FXa因其存在于外源性、内源性及共同凝血途径中被广泛关注。针对FXa的抑制剂研究也随即而来。如,蜱抗凝血肽(Tick Anticoagulant Peptide,TAP)[22],含60个氨基酸并以剂量依赖性方式抑制FXa的活性,其抑制常数Ki为(0.588±0.054) nmol/L。蜈蚣毒液抗凝肽(TNGYT,554.3 Da)也以剂量依赖性方式抑制FXa,其IC50值为41.14 mg/mL,同时体内实验结果表明它能够显著延长小鼠的凝血时间和出血时间[23]。
1.3 抑制血小板聚集
血小板是血液中的一种组成成分,来源于骨髓巨核细胞的细胞质碎片。其无细胞核结构,直径约为2~3 μm[24-25]。血栓形成过程中一般包含血小板黏附、颗粒释放、激活及血小板聚集过程。如图2所示,血小板表面存在很多受体[26],ADP、凝血酶、U46619、花生四烯酸及胶原等通过与受体相互作用,进一步引起血小板的级联反应,促进血小板聚集。凝血酶主要通过与血小板表面PAR1、PAR4受体结合激活血小板;ADP特异性结合G蛋白偶联膜受体P2Y1、P2Y12,刺激细胞内信号级联[27];胶原则与GPVI受体结合;U46619为血管收缩剂血栓素A2的类似物,同血管收缩剂血栓素A2(TXA2)一样,其与TP-α特异性结合。在血小板表面也存在一种重要的糖蛋白受体GPIIb/IIIa(整合素αIIbβ3),当其配体结合到整合素αIIbβ3上后,介导血小板黏附聚集并起始一系列胞内信号转导,这些信号将引起血小板一系列反应[28]。三肽RGD(Arg-Gly-Asp)是典型的GPIIb/IIIa受体拮抗剂,同时也是细胞外基质和血液中多种粘附蛋白所共有的细胞粘附识别位点。血小板膜糖蛋白GPIIb/IIIa复合物在血小板活化后形成黏附分子受体,其能识别纤维蛋白原配体上的RGD序列而与纤维蛋白原结合,是血小板聚集和血栓形成的最后共同通路。利用RGD肽竞争性地阻断GPIIb/IIIa与纤维蛋白原的结合,从而抑制血小板的聚集,是防治血栓性疾病的一种有效手段[29]。目前,牛奶蛋白[30]、蜈蚣蛋白[31]及大豆蛋白[32]中均有抑制血小板聚集的活性肽报道。特别地,大豆蛋白水解物显示出较好的抑制ADP诱导的抗血小板聚集活性(IC50=2 mg/mL),肽SSGE、DEE均为高度亲水性且抑制ADP诱导的血小板聚集的IC50分别约为480和460 μmol/L[32]。
2 抗凝血肽的活性分析方法研究进展
2.1 凝血酶抑制剂活性分析方法
2.1.1 分光光度法 近年来,Yan等[33]建立了一种测定抑制凝血酶活性的分光光度法。该方法因其成本低、易操作及效率高等优点在国内外受到广泛认可。其主要原理是通过考察抑制物对凝血酶水解纤维蛋白原的抑制率来判断其对凝血酶的抑制活性。其主要的过程为:在37 ℃,405 nm波长下测定在加入凝血酶前后,纤维蛋白原与抑制剂的混合液的吸光值变化。Qiao等[20]通过采用分光光度法测定贻贝蛋白水解物的抗凝血活性,再利用UPLC-Q-TOF-MS/MS质谱技术鉴定水解产物中的肽段,并进一步结合分子对接技术模拟凝血酶与水解肽的相互作用,最终从贻贝(Mytilusedulis)中筛选预测到一种新型潜在的凝血酶抑制十肽(ELEDSLDSER),其可能是其通过与凝血酶分子上的氨基酸Lys36-Gln38-Arg67-Arg73-Thr74-Lys81-Ile82-Lys110相互作用,从而抑制凝血酶活性。Feng等[34]同样结合UPLC-Q-TOF-MS/MS、分子对接及分光光度抗凝血活性测定法成功从贻贝蛋白中分离、鉴定出一种具有抑制凝血酶活性的13肽(KNAENELGEVTVR),并且此肽在9 mg/mL的浓度时对凝血酶的抑制率可达到89.96%±5.30%。类似地,Tu等[35]通过结合序列对比预测、UPLC-Q-TOF-MS/MS、分子对接及分光光度抗凝血活性测定法从β-酪蛋白中预测出一种抗凝血16肽(FQSEEQQQTEDELQDK),并阐述了其与凝血酶相互作用的可能活性机制。Rojas-Ronquillo等[7]通过采用干酪乳杆菌发酵牛乳蛋白,并采用此方法鉴定出一条同时兼具抑制凝血酶及ACE活性的17肽(YQEPVLGPVRGPFPIIV)。Ren等[36]运用分光光度法测定蝎子蛋白水解物的抗凝血活性后,再结合MALDI-TOF/TOF-MS等技术从蝎子蛋白中筛选出一种具有抗凝血活性的10肽(VEPVTVNPHE)。Yu等[37]从蛋清蛋白中鉴定到一种具有降血压、抗氧化及抗凝血活性的5肽(RVPSL),分光光度法测定结果表明当此肽浓度为100 mmol/L时能够完全抑制凝血酶活性。虽然此方法具有较多的优点,但是一些缺点也不容忽视。例如,此方法检测灵敏度低、重复性差、测量结果易受时间影响。
2.1.2 基于凝血酶活性的发色底物法 凝血酶发色底物法的主要原理是:凝血酶能够水解发色底物(S-2238,HD-Phe-Pip-Arg-pNA)使发色基团硝基苯胺(pNA)被释放,并在405 nm显色,其颜色深浅与凝血酶活性成正相关。因而,通过分析待测抑制物对凝血酶水解产生发色底物的抑制率来评价其抗凝血活性。Motoyashiki等[38]采用凝血酶发色底物法验证了水蛭素对凝血酶较强的抑制效果。Cleary等[39]采用凝血酶发色底物法证实了含9个氨基酸的缓激肽(RPPGFSPFG)能够直接与凝血酶的活性位点结合而达到抑制凝血酶的效果。Francischetti等[40]结合凝血酶发色底物法等从动力学角度阐述了anophelin肽(6.5 kDa)的抗α-凝血酶机制,结果表明anophelin可逆、缓慢的竞争性抑制α-凝血酶。
2.2 凝血途径及凝血因子抑制活性分析方法
2.2.1 活化部分凝血活酶时间、凝血酶时间、凝血酶原时间指标测定 活化部分凝血活酶时间(partial thromboplastin time,APTT)、凝血酶时间(thrombin time,TT)及凝血酶原时间(prothrombin time,PT)常被用来分析抗凝血物质作用的凝血途径。Nasri等[41]采用地衣芽孢杆菌NH1蛋白酶水解虾虎蛋白并结合APTT和TT方法测定水解物的活性,同时采用ESI-MS/MS鉴定出4种抗凝血活性组分肽段(LCR、HCF、CLCR及LCRR)。研究者通过分析比较已报道的抗凝活性肽,发现其中3个肽的C端均为精氨酸(Arg,R),其结果与一些研究报道的抗凝血肽的结构特性相符,因而推断当肽的C端为精氨酸时可能有助于其具有抗凝血活性。Indumathi等[42]采用APTT、PT、TT为筛选指标,从紫菜中筛选鉴定出一种仅能够延长APTT时间的抗凝血14肽(NMEKGSSSVVSSRM),其IC50为0.3 μmol/L。该研究结果表明,此肽抑制了内源性凝血途径的凝血因子。Kong等[31]从蜈蚣(Scolopendrasubspinipes)蛋白中鉴定出3种能够延长APTT的抗凝肽(FSAPAVY、IRDL、DLDHYSF)。Jung等[9]从贻贝(Mytilusedulis)蛋白中鉴定出一种抗凝血22肽(EADIDGDGQVNYEEFVAMMTSK),其能够延长TT及APTT。进一步研究结果表明其能与凝血因子FIX、FX及FII相互作用。此外,有研究表明海参蛋白水解物也具有抗凝血活性[43]。
虽然此方法比较成熟、省时且可信度高,但是此方法不能表明活性肽是具体抑制哪一种凝血因子,只能表明抑制的凝血途径。且因为此方法需用到凝血分析仪及特定的分析试剂盒,所以其费用昂贵。
2.2.2 基于凝血因子测定的发色底物法 同研究凝血酶抑制物的发色底物法类似,针对除凝血酶外其他凝血因子的抑制效果测定只需替换成相应的发色底物。S2765(S2222/S2732)、S2302、S2366、S2288分别是针对凝血因子FXa、FXIIa、FXIa、FVIIa。通过此方法,Deng等[44]从线虫中鉴定出一种具有抑制凝血因子FXIa、FVIIa共同作用的多功能活性肽,研究表明其抑制活性较高,对FXIa及FVIIa的抑制活性IC50值分别为(25.76±1.06) nmol/L及(123.9±1.71) nmol/L。Gan等[45]从十二指肠虫中鉴定出一种能够同时抑制凝血因子FXa和FXIa的抗凝血活性肽,抑制动力学结果表明其抑制常数分别为(7.34±1.74) nmol/L 及(42.45±3.25) nmol/L。
2.3 血小板聚集抑制剂筛选方法
1995年,Qian等人[46]研究发现绵羊κ-酪蛋白的糖肽能够抑制凝血酶及胶原诱导的血小板聚集,并呈显著的量效关系,其IC50分别为215和100 μmol/L。Silva等[47]从大豆蛋白中分离纯化出一种具有抑制血小板凝聚和抗凝血的功能蛋白组分。1986年,Jollès等[30]发现来源于κ-酪蛋白106~116的氨基酸残基片段(MAIPPKKNQDK)具有抑制ADP诱导的血小板凝集以及与纤维蛋白结合等抗凝血作用。同时,他们研究发现采用胰蛋白酶将这个11肽水解为更短的片段(MAIPPKK、NQDK)后,其抗凝血活性减弱。这可能与其发挥抑制作用的关键性氨基酸有关,文中研究表明Ile108-Lys112-Asn113-Asp115可能为发挥活性的关键氨基酸。不过,2000年Clare等[48]报道,来源于κ-酪蛋白112~116片段(KNQDK)仍具有较好抗凝血功能。
本文总结了目前常用的体外筛选抗凝血活性肽的方法及已报道的食源性抗凝血肽,如表1及表2所示。虽然针对抗凝血物质的研究由来已久,但是目前还没有一种十分完美的方法供相关研究使用。分光光度抗凝血活性筛选法虽然便宜、易操作,但是其灵敏度低、稳定差,只适用于如已经药物化的高活性物质的活性检测。发色底物法虽然重复性高,但是其测定结果易受实验人员影响,且大部分凝血因子价格昂贵。APTT、TT、PT三个临床常用的凝血检测指标,具有稳定性强、可信度高的优点,但是,其价格昂贵,且检测过程中需要血小板,并且检测结果只能表明抑制某一种或多种凝血途径,而不是具体某个凝血因子。血小板聚集法需要新鲜血小板或全血(2 h内)及血小板聚集仪,且成本较高、易发生溶血,但稳定性较好,通过筛选能够知道抑制剂针对的具体血小板聚集途径。近年来,随着细胞表面受体的深入研究,抗凝血抑制剂也开始着重于对细胞表面受体靶向抑制剂的开发。典型的凝血信号通路受体RAR1、P2Y12和GPIIb/IIIa等已被报道。但是,目前食源性的受体蛋白拮抗剂的开发还很罕见。综上所述,目前的抗凝血活性物质的筛选方法有待进一步开发与完善。

表1 凝血抑制剂检测方法比较Table 1 Comparison of anticoagulant inhibitor detection methods
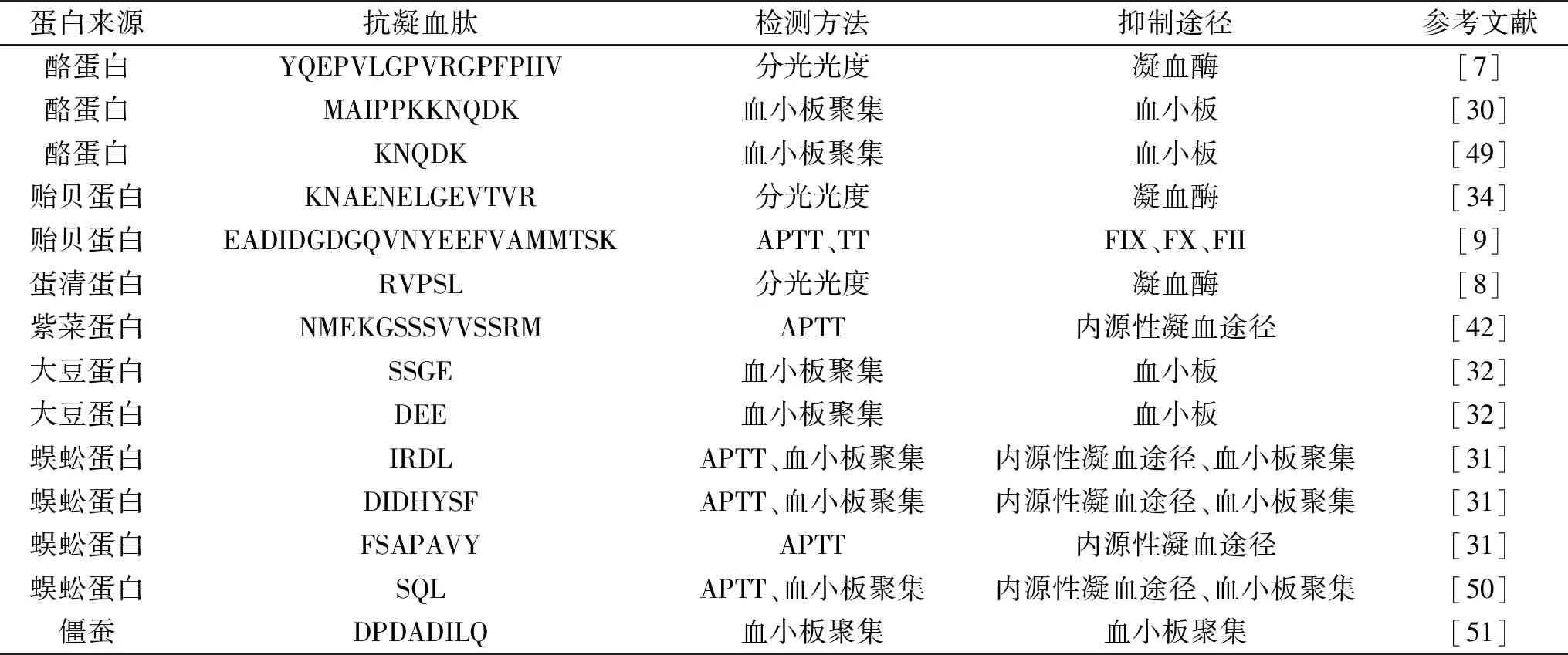
表2 食源性抗凝血肽Table 2 Food-derived anticoagulant peptides
3 前景及展望
血栓类疾病正严重威胁着人类的健康与生命。食源性抗凝血活性肽的分离、鉴定及制备尤为重要。因而,掌握体内凝血机制、开发高效可靠的抗凝血肽筛选方法凸显出重要意义。目前,各类抗凝血活性物质筛选分析方法都存在自身的缺陷并且关于细胞表面受体抑制剂的研究较少,并未建立完善的分析体系;抗凝血活性物质的功能机制阐述将是未来研究中的热点问题,如结合蛋白组学、蛋白翻译后修饰等技术阐述抗凝血肽的活性机制等均值得深入研究;同时,以Caco-2等细胞模型为载体,阐述抗凝血活性肽的体内吸收机制也将是未来的研究热点之一。
综上所述,围绕新型抗凝血活性物质的筛选、分析检测及多种技术组合活性机制阐述方法开发等均具有良好的应用前景。相信随着科技进步,未来能够建立出一套更高效、灵敏、准确、成熟的体外抗凝血肽的筛选技术,促进食源性抗凝血肽的研究。
