等温扩增技术 在食源性致病菌检测中的研究进展
2019-04-12,,,,,,,,*
,, , ,,,,,*
(1.内江职业技术学院农业技术系,四川内江 641000; 2.陕西科技大学食品与生物工程学院,陕西西安 710000)
2014年,国务院食品安全委员会提出“食品安全示范城市”建设工作,要求食品抽检量较原来提高50%左右,给当下食品检测技术、人员、设备带来了巨大考验。目前食品中致病菌检测国标方法-生化培养法,虽然较准确,但耗时长。如沙门氏菌检测周期一般为5~7 d,相对流程较为简单的金黄色葡萄球菌的检测也需要3~5 d,无法适应当下食品安全检测的大环境。因此,探寻高效、快速、准确的检测方法成为了学者们当下的一个重要研究方向。
分子检测技术是致病菌检测的一种重要手段,其精准度高、检测速度快。80年代问世的PCR技术,在近30年间已被广泛应用于食源性致病菌的检测中。随着分子生物学技术的不断发展,等温扩增技术的出现,使得扩增反应不再依赖于精密的金属浴,大大降低了反应时间,提高了反应效率。
目前常用于食源性致病菌检测的等温扩增技术包括环介导扩增技术(loop-mediated isothermal amplification,LAMP)、依赖核酸序列的扩增技术(Nuclear acid sequence-based amplification,NASBA)、链置换扩增技术(strand displacement amplification,SDA)、缺口依赖酶链置换扩增技术(nickase-dependent amplification NDA)、网状分支扩增技术(ramification amplification method,RAM)、依赖解旋酶扩增技术(Helicase-dependent isothermal amplification,HDA)、重组酶聚合酶扩增技术(Recombinase Polymerase Amplification,RPA)等,本文对上述各种等温扩增技术的原理、应用现状及其优缺点进行综述。
1 环介导扩增技术
LAMP是2000年问世的一项等温扩增新技术[1],其特点是针对靶基因设计4个特异引物,利用链置换DNA聚合酶可在恒温60~65 ℃,60 min内完成扩增,灵敏度高,且对设备要求低。该技术现已广泛应用于食品中金黄色葡萄球菌[2-4]、单增李斯特菌[5]、沙门氏菌[6-7]、铜绿假单孢菌[8]等的检测。依靠RT-LAMP,可同时对病毒进行检测[9],结合荧光探针,可同时进行定量分析[10]。由于LAMP扩增产物电泳呈阶梯状,结果不易判断,限制了基础LAMP检测技术的应用,但某种程度上也促进了学者们对LAMP可视化配套检测手段的研究。如在DNA延伸合成时,从脱氧核苷三磷酸基质(dNTPs)中析出的焦磷酸离子与反应溶液中的镁离子结合,会产生一种焦磷酸镁衍生物的白色沉淀,利用这一特点用肉眼即可判断扩增与否,然而,该法虽然实现了可视化检测,但其结果不易判断。随后,有学者在反应液中加入荧光染料,再将扩增产物置于荧光下,可见阳性产物为绿色,阴性产物为橙色,提高了判断的精度,但却要依赖于荧光透色仪[11]。对此,又有学者提出,在体系中加入MgSO4、MnCl2及Ca2+使阳性反应结果直接出现肉眼可见的绿色钙锰复合物,判断结果更为方便精准[12];此外,Gong等[13]在反应液中加入羟基萘酚蓝(HNB),使得阳性结果为深蓝色,而阴性结果为绿色,提高了判断的精度,且检测限能达到100 copies/μL;唐毓祎[14]利用LAMP与免疫金技术相结合,先将LAMP的引物进行巯基化修饰后,再利用一种特殊的加金方式,即利用金溶液来稀释引物,让巯基修饰的引物与金先进行自我组装,扩增后使得阳性反应为红色,阴性为蓝色。
总体而言,LAMP是一种实用性强且高效的等温扩增技术,然而也有其劣势,如加入环引物后,易出现假阳性,虽然可通过降低环引物的浓度降低假阳性的出现效率[16];却无法避免LAMP引物设计要求高,难度大的缺陷,建立的方法需经过大量的工作进行引物验证;此外,LAMP只能扩增300 bp左右的产物,不适合扩增较长片段;且其产物不均一,不易回收;反应过程中开盖易污染。尽管有着上述不足之处,但LAMP依然备受学者们青睐,可见其独到之处,随着技术的发展,其不足也将会慢慢规避。
2 依赖核酸序列的扩增技术
NASBA是一种依赖于T7RNA聚合酶、RNAseH、AMV逆转录酶相互作用完成扩增的方法[17],可在42 ℃,2 h内,将RNA扩增109~1012倍,具有灵敏度高、特异性强的特点,其扩增产物为RNA。该方法的原理为65 ℃ RNA预热后恢复42 ℃时,引物P1(5′端含T7RNA酶识别的启动子)与RNA模板退火结合后被AMV催化逆转录生成DAN-RNA杂交链,RNAseH水解杂交链上的RNA,引物P2再与剩余的DNA链退火结合,AMV再次催化生成双链DNA。此双链DNA带有一个T7RNA酶识别的启动子,被T7RNA识别并催化其转录,生成更多单链模板RNA,再次进入循环。
自NASBA问世以来,大量学者将其应用到致病菌的检测中,Fykse等[18]和Borst等[19]利用NASBA方法检测水样中霍乱弧菌和食品中的念珠菌,以琼脂糖凝胶电泳作为检测手段,分别经过3和2 h的扩增反应,其检测限可达到50 cfu/mL和60 cfu/mL。然而,NASBA产物主要为单链RNA,电泳时非常容易降解,因此,易出现假阴性,这限制了基础NASBA方法的推广。
正因NASBA产物主要为单链RNA,这为探针检测提供了便利[20],学者们建立了大量NASBA-探针法的致病菌检测方法。雷质文等[21]和倪鑫等[22]分别在P2引物5′端标记生物素,在探针3′端标记FITC,利用商品化的试纸条进行检测,建立可视化分析方法,用以检测食品中的沙门氏菌和副溶血性弧菌污染,其检测限分别为710、510 cfu/mL,且均无交叉污染。王立朋等[23]根据曲霉菌18S rRNA保守序列区设计引物,建立NASBA-荧光探针法,定量分析食品中曲霉菌污染。杜丽等[24]将NASBA与ELISA结合,首先用链酶亲和素包被微孔板,引物用地高辛标记,探针用生物素标记,再加入碱性磷酸酶标记的地高辛抗体显色,即链酶亲和素-生物素标记探针-地高辛标记的产物-碱性磷酸酶标记的地高辛抗体,检测曲霉菌感染,结果表明,灵敏度可达到1 cfu/mL,其结果可通过颜色进行可视化分析,又可根据OD值用于定量分析。该法虽然检测精准,然而检测成本高,且操作较为繁琐。同时,杜丽团队[25]还利用巯基化的探针,再将纳米金材料直接加入到体系中,建立另一种曲霉菌感染的检测方法(NASBA-巯基修饰探针-纳米金),其结果同样既能直接可视化分析又能定量分析,且简化了操作。其他方面,有学者利用NASBA原理,设计检疫芯片,用以快速分析水及食品样品中酵母菌、大肠杆菌、金葡菌污染[26]。还有学者[27]将NASBA与荧光共振能量转移技术相结合,用于检测曲霉菌污染,灵敏度可达到6×104copies/μL,但设备要求高,耗时长。
此外,若将NASBA用于DNA的检测,则需要额外预热处理,使得它与其他等温扩增技术相比处于劣势。然而,正是因其扩增子与产物均为RNA,使得NASBA具有独特之处,才使其成为一项值得长期关注、值得深入研究的方法。
3 链置换扩增技术
SDA是一种酶促DNA体外等温扩增技术[28],其原理是在引物5′端加上经化学修饰(如dCTPas)的限制性内切酶位点,加入的耐高温限制性内切酶(如HsoBI、Hinc II等)无法完全酶切经过化学修饰的位点,而是产生单链缺口,此时强链置换聚合酶(如exo-Klenow或exo-Bca)从缺口处启动延伸反应并将旧链剥离,最终达到指数级扩增。包括DNA模板预热分离、生成两端带酶切位点的扩增子、SDA循环三个阶段,整个反应一般耗时30 min左右。其常用配套检测技术有琼脂糖凝胶电泳荧光偏振检测法、荧光定量、DNA传感器、免疫层析等。陈斌等[29]将SDA与DNA传感器检测技术相结合对33份样品中铜绿假单胞菌进行检测,并以荧光定量PCR相比较,结果显示,两种方法准确率一致,但SDA-DNA传感器法以成本低廉、检测速度快更胜一筹。梁炜等[30]以霍乱弧菌ompW为靶向检测基因,结合琼脂糖凝胶电泳检测检测食品中的霍乱弧菌,其检测限为700 cfu/mL,并以创伤弧菌、志贺氏菌、沙门氏菌等7种常见细菌为对照,未发现交叉反应。然而SDA产物不均一,配合琼脂糖凝胶检测时,结果必然出现拖带现象,虽然有学者对其进行过优化[31],然而效果不太理想。吴薇等[32]以核酸适体为靶向检测对象,建立了一种SDA与免疫层析双标检测法相结合的方法,用以检测肠炎沙门氏菌,其检测限为10 cfu/mL,可在1 h内完成检测。吴薇团队[33]以同样的方法,即一种核酸适体进行富集分离,以另一种核酸适体为靶向检测对象,建立了SDA与免疫层析相结合的方法检测食品中的大肠杆菌,其检测限同样为10 cfu/mL。该法较其他SDA-base法存在明显优势,即核酸适体存在于菌体表面,无需进行DNA提取,节约了时间及经费;此外,因先经过了免疫磁珠富集分离,可显著减少假阳性的出现。Ning等[34]以mecA为靶向检测对象,建立了SDA与荧光定量相结合的方法检测耐甲氧西林金黄色葡萄球菌,检测限为300 cfu/mL。但该法同经典SDA-荧光偏振法一样,对设备依赖高,无法适用于设备情况不理想的地方检测机构。
随着研究的深入,学者们发现了SDA存在某些不足,因此对SDA进行了优化以规避其劣势,如对体系中离子浓度等进行优化,以减少其拖带现象[31];优化体系中酶、Buffer的pH及加入特殊物质DTT等以提高扩增效率及特异性[35]。此外,还有学者[36]发现了一种新型链置换酶SD DNA polymerase,它除了具备普通DNA扩增酶的特性外,还有较Bca更强的链置换活性,可显著提高SDA的扩增效率。即便如此,SDA依然存在其无法避免的弊端,如产物两端带修饰性的酶切位点且产物不均一,无法用于克隆;现有链置换酶不能经受高温预热,需在预热后加入;酶切位点需经过修饰,且修饰成本高等。
4 缺口依赖酶链置换技术
NDA与SDA同样以链置换扩增为根本,但其原理略有区别。针对SDA必须加入非正常碱基,90年代末,美国NEB公司开发出一系列缺口酶,它们可以识别特定位点的双链DNA,并将其切割产生单链缺口,而无需依赖于修饰的碱基,降低了反应成本。且模板无需进行变性,简化了操作,提高了效率[37]。即便如此,也未见其在食品检测方面的应用研究,可能原因是缺口酶会刺激不依赖模板的DNA合成[38],易出现非特异性扩增[39]。
机器视觉处理和识别图像,颜色是重要因素。RGB和HSI是比较常见的两种颜色模型。RGB颜色模型是基于三基色原理,而HSI颜色模型则是基于色调、饱和度、和亮度理论原理。采集到的红枣图像为RGB图像,但HSI颜色模型能够更加自然和直观地反映人类视觉系统感知色彩的方式[9]。因此,本文首先将获取的红枣RGB图像转换成HSI图像,利用其颜色的色度、饱和度和亮度3个基本分量的均值来衡量红枣的颜色特征。
5 网状分支扩增技术
RAM是利用环形寡核脱氧核苷酸探针进行核酸扩增的方法,即探针5′端和3′端首选与靶基因结合,在DNA连接酶的作用下形成环状探针。以环状探针为模板,设计引物在链置换酶的作用下进行扩增[40]。为了降低背景和提高检测的精准度,学者们将其与滚环扩增(RCA)相结合,并增加一个捕获基因,其上连接生物素标记用以荧光或可视化检测。如赵春燕等通过利用该法检测食品中大肠埃希氏菌和志贺氏菌污染,检测限可达10 cfu/mL[41-42],该法虽然较准确,但过程复杂,因其除了RAM反应外,还包括环形探针与捕获探针的孵育,捕获探针与磁珠孵育、洗涤、连接、扩增、酶切等。其次,设计环形探针与捕获探针难度大(RAM法最早用于检测基因突变,若有一个碱基不符合要求便无法连接)。因此限制了该法在食源性致病菌检测中的应用。
另一方面,由于RAM扩增产物均为ssDNA,若将RAM与免疫金技术相结合,有望实现可视化检测,这也是RAM用于食源性致病菌检测的新途径。
6 依赖解旋酶扩增技术
HDA是2014年问世的一项等温扩增技术,其原理为依靠解旋酶(UVR D)的解旋双链形成单链DNA,再依靠单链结合蛋白SSB的作用,使模板链始终处于单链状态,便于引物与之结合,在65 ℃条件下,90 min内完成扩增。
目前,HDA已被用于溶血性弧菌[43]、单增李斯特菌[44]及沙门氏菌[45]的检测,其检测限分别可达到19.9 ng、780 cfu/mL、460 pg。上述研究均以琼脂糖凝胶电泳为检测手段,然而HDA依赖于解旋酶的解旋作用,目前常用的大肠杆菌UvrD解旋速率在20 bp/s左右,连续性一般为100 bp,使得扩增目的片段长度受限,仅为70~120 bp,使得琼脂糖凝胶电泳检测辨识度降低,特别是若引物存在二聚体,或体系中引物加入量过大,造成假阳性的出现。对此,Jeong等[46]发现了一种T7噬菌体GP4解旋酶,该酶解旋速率及连续性均较UvrD高,提高了HDA的扩增速度与目的片段长度。
此外,Chen等[47]将HDA与免疫磁珠相结合,建立荧光定量HDA法检测食品中金黄色葡萄球菌,检测限提高为50 cfu/mL;Gill等[48]将HDA与纳米金技术相结合建立了幽门螺杆菌可视化检测方法,检测限可高达10 cfu/mL。
其主要缺陷在于,相比其他等温扩增方法如RPA,HDA的反应时间稍长。因此,开发高效且优质的新型解旋酶应该是其今后的重点研究方向。
7 重组酶聚合酶扩增技术
近年来,随着分子生物技术的发展,RPA技术的出现,将致病菌核酸水平的检测推上一个新高度。其原理为:重组酶与引物结合形成的蛋白-DNA复合物,能在双链DNA中寻找同源序列。一旦引物定位了同源序列,就会发生链交换反应形成并启动DNA合成,对模板上的目标区域进行指数式扩增。被替换的DNA链与SSB结合,防止进一步替换。上述3种酶在37 ℃时活性高,因此使得RPA技术可在常温下进行扩增,降低了对仪器设备的要求,同时大大缩减了检测时间,可以在15 min内完成扩增,提高了检测效率。其配套检测方法一般包括琼脂糖凝胶电泳、荧光定量、测流层析、纳米金等。近几年广泛应用于疾病诊断[49-51]、转基因作物筛选[52-54]、致病菌检测[14,55-58]等。
在致病菌检测方面,刘立兵[55]以侵袭蛋白invA作为检测基因,建立了基础RPA检测食品中沙门氏菌的方法,并与荧光定量PCR法进行对比,准确性一致,其检测限能达到1.1×10-3ng/μL。经过8 h的增菌处理后,4 cfu/mL的污染可以被检出。但较普通PCR,其缺陷在于,不仅增菌之后需要DNA提取纯化,且扩增后的产物在琼脂糖凝胶电泳检测前,还需再纯化一次,操作过于繁琐。随后,有学者[56]以蜡样芽孢杆菌16S RNA设计引物与探针,建立了荧光定量PRA的方法检测食品中蜡样芽孢杆菌。检测限为1.0×10-3ng/μL,可在39 ℃ 20 min完成扩增。并与沙门氏菌、志贺氏菌等28种细菌做对比,未发现交叉反应。荧光法虽无需进行DNA纯化和电泳,但对设备要求高。
为降低对设备的要求,学者们结合免疫金技术,建立了一种地高辛与生物素双标的测流层析RPA法检测食品中李斯特菌[57]与沙门氏菌[58],经过20 min的扩增,检测限分别能达到15、10 cfu/mL,且可以达到可视化要求。然而,由于免疫金及双标试纸条制作繁琐且价格昂贵,可能限制该法的推广。
为降低检测成本和简化操作,唐毓祎[14]将未修饰的纳米金颗粒,直接加入到RPA体系中,建立了一种未修饰AuNPs-RPA的方法,用于检测水产品中的弧菌污染。根据AuNPs与酶、及单链DNA的相互结合的原理,扩增后的阳性管呈现出蓝色,而未扩增的阴性对照AuNPs与酶及引物的作用始终在一个恒稳的状态,最终还是紫色。该法实现了可视化检测,且经20 min的扩增反应后检测限可达到50 cfu/mL,较LFD法极大地降低了检测成本,同时也缩短了检测时间。
总之,RPA是一种新兴技术,在近三年间急速发展起来,在食源性致病菌检测方面也具有广阔前景。
8 结论与展望
上述各等温扩增技术温度要求、反应时间、引物对数及其产物类型总结见表1;相比传统PCR,等温扩增技术具有一个最显著的特点,无需依赖于昂贵的金属浴仪器,可在硬件设施不理想的基层食品检测中心推广;并且等温扩增引物不同于传统PCR引物,不受退火温度的限制,因此,其在多重扩增上的优势也是传统PCR无法超越的;此外,等温扩增技术的精确性或特异性依赖于扩增反应所用酶的保真性以及引物和靶向基因选择的合理性,因此引物的优化和靶向基因的合理选择是方法是否适用的关键;目前等温扩增技术常用配套检测手段包括琼脂糖凝胶电泳、荧光检测、免疫层析技术、免疫磁珠技术、纳米金技术、基因芯片、荧光偏振、化学可视化反应等,因不同等温扩增技术特点不同,在实际操作过程中需根据其特点和检测的具体要求选择恰当的配套检测手段,如LAMP扩增产物呈阶梯状凝胶电泳检测极其不准确,RPA扩增产物需纯化回收才能进行琼脂糖凝胶电泳,又如RAM产物多为单链DNA,为纳米金可视化检测提供了条件,而NASBA产物为单链RNA,为探针法检测提供了方便;另一方面,等温扩增技术相比与传统PCR,在检测细菌时必须进行DNA提取纯化,使其依然难以实现现场化快速检测,且目前未见关于DNA提取过程优化的相关研究报道,因此,对该步骤的优化改良是其重要的研究方向之一。
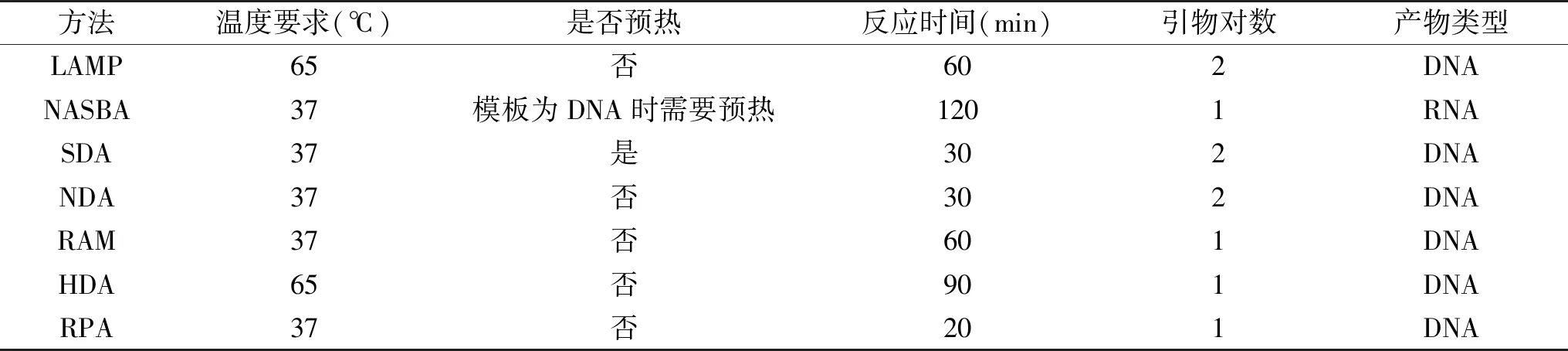
表1 各等温扩增技术的温度要求、反应时间、引物对数及其产物类型Table 1 Temperature requirements,reaction times,primers,and it’s products for each isothermal amplification technique
食品是人类赖以生存的物质基础,食品安全是关系到社稷民生的重大问题,对致病菌的监控检测是食品安全的重要任务,分子生物方法是致病菌检测的重要手段之一。随着现代分子生物技术的不断发展,DNA及基因组测序技术的不断成熟,各种致病菌基因信息的获得将更廉价、更快捷,等温扩增技术在食源性致病菌检测中扮演的角色也将越来越重要。随着越来越多食源性致病菌的基因信息被获得,有望直接通过多重等温扩增实现致病菌定量检测、细菌分型、毒力分析、生化特性分析的“一条龙服务”,取代目前常用的繁琐的血清型试验及生化试验。
等温扩增技术作为致病菌检测的后起之秀,以现代高通量测序技术的快速发展作为其坚实的后盾,随着研究不断的深入,其缺陷被不断完善改良,相信在不久的将来,等温扩增技术将成为致病菌检测中一个重要的方法。
