双歧杆菌胞外多糖的特性 及与宿主关系的研究进展
2019-04-12,,
,,
(光明乳业股份有限公司乳业研究院,上海乳业生物工程技术研究中心, 乳业生物技术国家重点实验室,上海 200436)
人类肠道是一个高度复杂的生态系统,密集定殖了大量的微生物,从而影响着宿主的生理机能、免疫功能以及健康状态。在构成人类肠道微生物的大量成员中,存在一部分和宿主共同进化的有益生作用的微生物,其中包括双歧杆菌[1]。双歧杆菌作为人类肠道菌群中的重要菌群之一,该菌属中的特定菌株能够对人类产生益生作用,因而被认为是益生菌。特定双歧杆菌菌株具有抗癌作用和抗菌活力,能够抵制致病菌、降低溃疡性结肠炎复发频率等。尽管双歧杆菌的功能宣称已存在推断性证据,但关于其促进健康作用的分子机制很大程度上仍不明确,其可能的分子机制之一是和菌株产生的胞外多糖(exopolysaccharides,EPS)有关[2-3]。虽然目前尚未确定识别双歧杆菌胞外多糖(bifidobacterial exopolysaccharides,B-EPS)的特异性宿主受体,但B-EPS被推测是双歧杆菌和宿主互作的效应物[4]。
EPS是复杂的碳水化合物,位于细胞的外侧,一些双歧杆菌菌株以及其他的微生物均能产生这类聚合物[5]。在双歧杆菌菌种/株中,合成B-EPS相关的基因簇具有多样性[6]。目前报道的B-EPS基本都属于由两种或两种以上不同类型单糖组成的重复单元构成的杂多糖,且不同菌株产生的EPS结构也具有高度差异[7-8]。此外,B-EPS能够提高双歧杆菌在肠道中酸/胆盐耐受力,影响菌株的黏附和定殖、调节肠道菌群、调节免疫应答,具有抗氧化活性、抗癌等作用[9-10]。B-EPS对于理解双歧杆菌与宿主间的共生关系具有十分重要的作用,在功能食品领域具有十分广泛的应用前景[11-12]。因此,本文总结了B-EPS的来源、组成及结构特点,并重点分析了B-EPS与宿主关系的研究进展,以期为产B-EPS的双歧杆菌菌株的筛选、构效关系的研究及B-EPS在益生产品和功能食品中的开发应用提供理论指导。
1 双歧杆菌胞外多糖的性质
1.1 来源
相比于乳酸菌,产EPS的双歧杆菌的报道和研究相对较少。目前已确定的产EPS的双歧杆菌菌种,包括动物双歧杆菌(Bfididobacteriumanimalis)、短双歧杆菌(Bfidobacteriumbreve)、长双歧杆菌(Bifidobacteriumlongum)、两歧双歧杆菌(Bifidobacteriumbifidum)、婴儿双歧杆菌(Bifidobacteriuminfantis)、青春双歧杆菌(Bifidobacteriumadolescentis)、假链状双歧杆菌(Bifidobacteriumpseudocatenulatum)和链状双歧杆菌(Bifidobacteriumcatenulatum)等[13-14]。在乳酸菌中,乳酸菌胞外多糖基因簇(LAB-eps clusters)通常拥有编码和调控、合成重复单元的糖基转移酶相关蛋白的基因,以及编码决定EPS链长、聚合度和释放等蛋白的基因。相反地,双歧杆菌属基因组中epsclusters没有表现出类似于乳酸菌中的保守结构,且种间和种内存在较高的差异[11]。双歧杆菌中合成EPS的基因簇具有菌株特异性,基因在种/株间存在高度差异,可能会影响EPS的结构以及免疫应答等功能[6]。
1.2 分子量和产量
B-EPS的分子量分布范围较广,约在10~1000 kDa之间。由于目前双歧杆菌各个种中菌株的分子量分析数量较少,因此无法准确建立EPS分子量分布和产EPS双歧杆菌菌种之间的直接联系。通常一株双歧杆菌菌株合成的EPS可同时产生大小不同的色谱峰,而分子量大小可能是影响宿主与菌株关系的重要因子[11]。在产量方面,EPS的产量具有菌株依赖性,可以通过改变培养基的组成、pH、培养温度、培养时间等因素来优化产量。B-EPS产量的报道较少,其产量和乳酸菌EPS产量范围较为接近[11]。在双歧杆菌中,B.longum是最常见的产EPS的双歧杆菌菌种,其产量也相对更高。其中,源自B.longumBCRC14634菌株的B-EPS产量高达4100 mg/L,生长在含葡萄糖培养基中的B.longumsubsp.longum菌株产生的B-EPS产量为616 mg/L,此外生长在含乳糖培养基中的B.longum菌株产生的EPS产量达到466 mg/L[15-16]。
1.3 单糖组成和结构特点
根据EPS的化学组成,可将EPS分为两种类型:同多糖和杂多糖,分别由同一种单糖组成的重复单元构成和由两种或两种以上不同类型单糖组成的重复单元构成。在乳酸菌中,两种类型EPS均存在。而在双歧杆菌中,只有合成杂多糖的基因被报道,而催化同多糖合成相关酶的编码基因尚未检测到,因此双歧杆菌合成的B-EPS普遍都属于杂多糖[17-18]。大部分B-EPS含有葡萄糖和半乳糖,部分含有鼠李糖。在少数双歧杆菌中,检测到甘露糖、阿拉伯糖、果糖和半乳糖醛酸等(表1)。B-EPS一般不含有6-脱氧-L-塔罗糖,该糖主要存在于悬钩子土壤杆菌(Agrobacteriumrubi)等革兰氏阴性菌株中,目前仅在B.adolescentis菌株和B.longumsubsp.longum菌株中检测到该糖[19]。
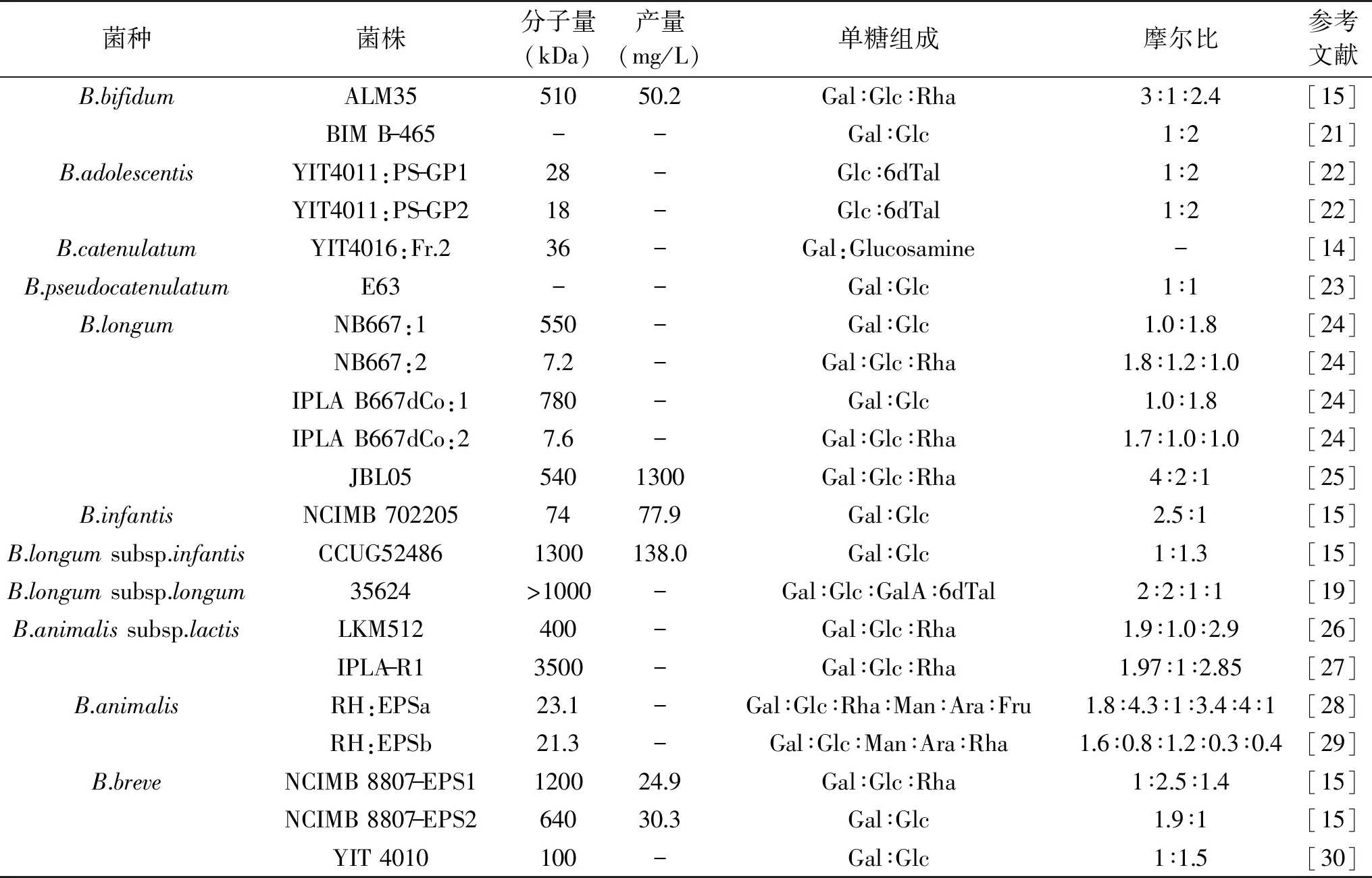
表1 双歧杆菌胞外多糖的特点Table 1 Characteristics of bifidobacterial exopolysaccharides
B-EPS的单糖比例和菌种尚未发现显著的关系,具有菌株特异性。研究推测,相比于食源菌株,人源菌株产生的EPS通常含有较高比例的鼠李糖,例如B.animalissubsp.lactisIPLA-R1菌株产生的HMW-EPS,含有50%的鼠李糖[8]。此外,结合核磁共振(Nuclear magnetic resonance,NMR)等分析手段,目前仅解析了十多种构成B-EPS的重复单元结构。重复单元主链的不同单糖通过不同糖苷键连接,包括α-1,2、α-1,3、α-1,4、α-1,6、β-1,2、β-1,3、β-1,4和β-1,5多种糖苷键,连接在主链上的侧链基团也是如此,从而使得不同菌株产生的B-EPS结构具有高度差异性(表2)。之后的研究需深入探究B-EPS具有结构多样性的原因,及其和菌株的多种生理功能之间的联系[20]。
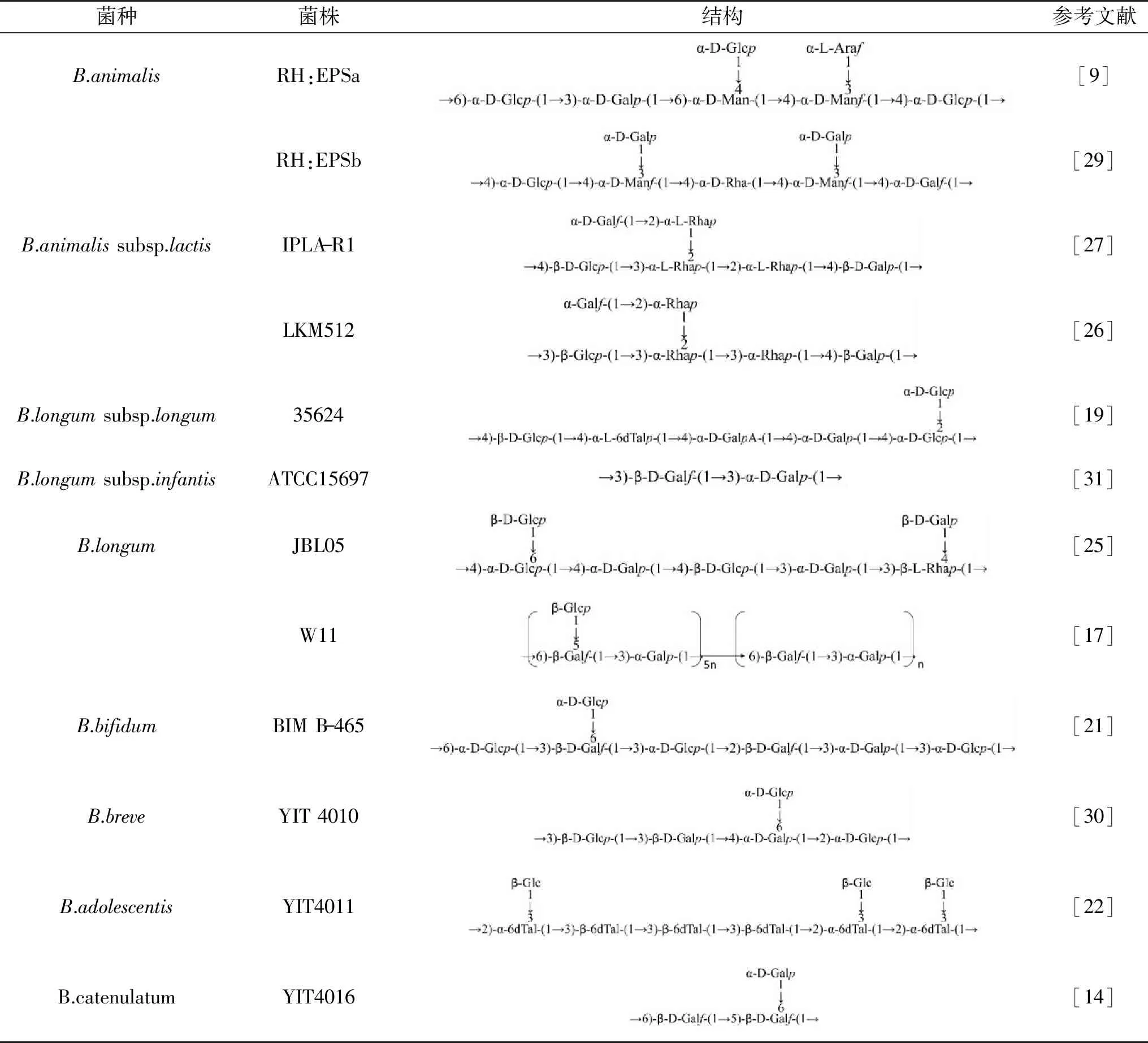
表2 双歧杆菌胞外多糖的结构Table 2 Structure of bifidobacterial exopolysaccharides
2 双歧杆菌胞外多糖与宿主的关系
2.1 B-EPS对双歧杆菌的作用
相关研究表明,B-EPS在双歧杆菌菌株和宿主(人类)间的相互作用关系中起到重要作用。B-EPS可通过影响双歧杆菌菌株肠道耐受能力和肠道定殖能力,影响菌株在宿主体内功能的发挥,进而调节人类健康[32]。
2.1.1 B-EPS对双歧杆菌肠道耐受能力的影响 宿主口服双歧杆菌后,菌体经过胃肠道到达结肠受到一系列胁迫作用,包括胃部低pH造成的酸胁迫和十二指肠分泌的胆盐造成的胁迫[33]。耐酸和耐胆盐的能力对于菌株的保持和定殖具有非常重要的作用,测定菌株耐胆盐和耐酸的能力是筛选新型益生菌菌株的标准之一[7]。
研究发现,在酸、胆盐等极端环境下,双歧杆菌产生的EPS对菌株具有保护作用。Yan等[12]探究了B.longum菌株的EPS产量与人工胃肠液耐受性的关系,研究发现,三株EPS产量最高的菌株在模拟胃肠液中耐受力最高,而两株只产生连接在细胞表面的胞外多糖(cell-surface-bound exopolysaccharide,EPS-b)的菌株,在经过模拟胃肠液处理后也具有相对较高的存活率,表明菌株的耐受性和EPS的产量相关,尤其是和EPS-b产量有关。相比分离自婴儿的菌株,分离自老年志愿者菌株的EPS-b产量更高,这表明双歧杆菌和宿主发生共同进化,其对于双歧杆菌在不利环境(胃肠道)中的生存具有十分重要的作用。Fanning等[2]监测了B.breveUCC2003菌株(EPS+)及EPS-突变株在低pH和胆盐条件下的生长情况,相比于EPS+对照株,两株EPS-菌株生长率显著下降,且终点OD600 nm值更低,表明了EPS层对菌株在低pH和胆盐条件下具有保护作用。同样地,Taboun等[33]发现,B.longumsubsp.longum105-A菌株产生的EPS也能够保护菌株抵抗宿主环境的胁迫。
相关报道表明,胆盐和酸能够诱导/影响特定菌株B-EPS的产量,从而影响菌株的肠道耐受性[4]。例如,Ruas-Madiedo等[34]首次提出胆汁能够诱导双歧杆菌属中EPS的合成,其研究结果表明,胆汁可以诱导gtf01207基因(EPS合成相关)的表达,显著促进B.animalissubsp.lactis菌株合成EPS。双歧杆菌酸耐受能力也会影响B-EPS的合成,近年来Yang等[35]结合转录组学和生理学的方法发现,相比其亲本菌株B.breveBB8,菌株B.breveBB8d的pH酸耐受能力提高和合成细胞壁成分肽聚糖和EPS的基因表达,以及碳水化合物运输、代谢和能量产生途径相关。同样地,菌株B.longumsubsp.longumBBMN68经过酸预处理后,和EPS合成有关的几种基因的表达出现上调[36]。EPS的产量和胆盐、pH之间的关系表明,当双歧杆菌面临肠道中的严苛环境时,通过合成EPS聚合物作为一种保护自身的机制。
胆盐除了通过改变菌株产量、影响肠道耐受性以外,还可能影响B-EPS的组成,进而对菌株的肠道耐受产生影响。Salazar等[24]比较分析了B.longumNB667菌株和相对应的耐胆盐突变株B.longumIPLA B667dCo产生的EPS物化特性,突变株EPS中葡萄糖和半乳糖的比例更低,相应的EPS残基→4)-Glcp-(1→和3→)-Galp-(1→的比例更小。相比于原生株,菌株适应胆盐环境可能会对B-EPS的组成产生影响,从而影响菌株的肠道耐受性。
综上,B-EPS对保护菌株抵抗宿主肠道中酸、胆盐胁迫具有十分重要的作用,同时,肠道环境也会诱导和影响B-EPS的产量等性质,进而影响菌株的肠道耐受性。此外,在筛选肠道耐受性较好的益生菌株时,可重点关注EPS-b的产量,并进一步探讨EPS-b的结构和作用机理。
2.1.2 B-EPS对双歧杆菌肠道定殖的影响 影响双歧杆菌菌株定殖肠道的因素包括胆盐/酸耐受力、碳水化合物利用能力、黏附素(adhesins)、菌毛(pili)、EPS等[7]。下文将详细阐述B-EPS对双歧杆菌肠道定殖的影响。
菌株黏附到肠黏膜的能力是影响菌株定殖宿主肠道的重要因素,和菌株与宿主间的互作能力相关,且菌株能够黏附到肠粘膜常被认为是筛选益生菌株的标准之一[37]。研究表明,B-EPS可能诱导双歧杆菌黏附到肠上皮,进而影响菌株的定殖[4]。Lopez等[38]通过体外实验发现,产生富含鼠李糖高分子量EPS的B.animalissubsp.lactisIPLA-R1菌株对肠道上皮细胞(Caco-2和HT29)的黏附能力显著高于原生株,可能有利于菌株在肠道中的短暂定殖。此外,Fanning等[2]的研究结果表明,B.breveUCC2003菌株产生的表面EPS能够调节B细胞,对于菌株的长期定殖具有十分重要的作用。大部分B.breve菌株存在于肠腔和上皮表面,B细胞应答被认为是免疫清除这类菌株非常重要的机制。UCC2003菌株(EPS+)表面的EPS结构通过避免补体级联反应或其他激活的免疫细胞,使得菌株逃避宿主的驱逐。同时,EPS掩盖菌株表面其他重要的抗原,而在EPS-菌株中,抗原处于暴露状态,导致被宿主发现,从而引起更强的免疫应答。综上,B-EPS可能诱导双歧杆菌黏附到肠上皮或者通过调节B细胞,从而对菌株的肠道定殖过程发挥作用。
双歧杆菌菌株的黏附和定殖具有菌株特异性,不同B-EPS对菌株的黏附和定殖产生的影响存在差异。例如,Taboun等[33]发现,B.longumsubsp.longum105-A菌株产生的EPS对菌株结合到Caco-2细胞具有抑制作用,菌株和单层培养Caco-2细胞不发生结合,而突变株可与Caco-2细胞结合,数值达到7.8±2.3。该结果与Fanning等[2]的研究结果完全相反,其原因可能是由于B.longum105-A菌株的EPS结构完全不同于源自B.breve的EPS,105-A菌株的EPS可能通过覆盖细胞器或者抑制细胞器的表达(例如能够促进菌株结合到上皮细胞的菌毛),而成为菌株定殖的屏障。Ruas-Madiedo等[39]研究了LactobacillusrhamnosusGG、B.longumNB667、B.animalisIPLA-R1菌株产生的EPS对益生菌黏附人类肠黏液的影响,结果显示,高浓度GG-EPS轻微促进了B.animalisIPLA-R1菌株的黏附,而NB667-EPS和IPLA-R1菌株产生的EPS则显著降低了IPLA-R1菌株的黏附,B-EPS的物化或者结构特性的差异可能对菌体的黏附产生不同作用。因此,建议探究双歧杆菌菌株产生的B-EPS的结构特点及物化特性,在基本性质研究充分的基础上,深入挖掘菌株黏附、定殖能力和结构之间的联系,进而探明菌株发挥益生作用的具体机制。
2.2 B-EPS调节宿主肠道菌群
B-EPS具有调节宿主肠道菌群的作用,可被肠道菌群中的特定种属作为可发酵底物(或益生元),从而调节肠道菌群[8]。将分离自11种分别属于B.animalis、B.longum和B.pseudocatenulatum菌株(分离自人类肠道)的B-EPS作为碳源,添加在未调节pH的粪浆中分批培养,其结果表明,B-EPS能够促进培养物中双歧杆菌水平的适度增长。当和B.longum和B.animalis菌株的B-EPS培养时,大肠杆菌(Escherichiacoli)的数量出现显著降低[40]。Salazar等[41]通过体外实验,结合调节pH的分批培养方式,分析分离自人类肠道的B.longumsubsp.longumIPLA E44和乳源的B.animalissubsp.lactisIPLAR1菌株产生的EPS对肠道菌群的影响,发现两种来源的B-EPS均能够调节肠道菌群,促进相关微生物菌群数量和代谢上发生改变。进一步通过体内实验(Wistar鼠)验证这两种菌株的菌群调节能力,结果表明,相比于IPLA E44和安慰剂组盲肠内容物PCR-变性梯度凝胶电泳(PCR-DGGE)的实验结果,IPLA R1菌株能够显著增加肠道菌群多样性[42]。此外,在肠道体系中,B-EPS能够作为菌群的碳源,通过不同的互养方式利用B-EPS,从而改变短链脂肪酸的谱图,最终影响宿主健康。例如,乙酸和丙酸比例的降低被认为是降血脂的表征因子,研究发现,B.longumE44和B.longumC52B-EPS的乙酸/丙酸比例值甚至显著低于菊粉[11]。Rios-Covian等[5]以纯化的B-EPS作为唯一碳源,首次发现脆弱拟杆菌(Bacteroidesfragilis)可以利用 B-EPS作为发酵底物,释放代谢产物短链脂肪酸和有机酸。将该结果外推到人类肠道,可以推测出B-EPS和Bacteroides之间的关系可能会影响肠道中短链脂肪酸的平衡,最终影响人类的健康。
近年来,大量的研究致力于探究B-EPS对致病菌的抑制/驱逐作用[4]。分离自B.bifidumWBIN03菌株的EPS,促进乳杆菌以及其他厌氧菌的生长,同时抑制肠杆菌、肠球菌以及B.fragilis的生长[10]。源自B.longumBCRC 14643菌株的EPS,浓度为80 μg/mL时,可抑制食物的腐败变质和致病菌的生长[16]。EPS的益生作用在于EPS干扰致病菌的细胞分裂过程而不是细胞裂解过程。Serafini等[43]发现,分离自婴儿粪便的菌株B.bifidumPRL2010能够黏附到Caco-2和HT-29细胞上,从而防止致病菌E.coli和阪崎肠杆菌(Cronobactersakazakii)的黏附。Fanning等[2]也发现,B-EPS能够保护宿主抵制入侵的致病菌,B.breve(EPS+)菌株产生的EPS能够降低致病菌鼠类柠檬酸杆菌(Citrobacterrodentium)在小鼠肠道中定殖。EPS+菌株相比于EPS-菌株能够抑制致病菌水平的原因,可能是由于菌株具有形成生物膜的能力,而EPS-菌株由于缺乏EPS可能被宿主识别为外来细菌,从而引起强烈的免疫应答。目前,仍需要通过更多的研究进一步准确详细地阐明B-EPS抵抗致病菌的机制。
2.3 B-EPS调节宿主免疫功能
B-EPS作用的准确分子机制尚不明确,但是B-EPS能够对宿主免疫功能产生显著影响[6]。不同的双歧杆菌菌株对免疫系统刺激能力不同,一些菌株表现出促炎活性,而其他菌株表现出潜在的抗炎活力。Fanning等[2]通过小鼠实验研究发现,产EPS的B.breveUCC2003菌株,和黏膜中为了防止柠檬酸杆菌属(Citrobacter)感染的促炎因子IL12、INF-γ和TNFα水平的升高有关,且相比于不产EPS的菌株,没有引起强烈的免疫应答。Liu等[44]分析了B.animalisRH菌株产生的EPS在体外对吞噬细胞的免疫刺激活性,数据表明,EPS在体外通过提高巨噬细胞RAW264.7的增殖和吞噬作用的活力,从而发挥免疫调节作用。分离自B.animalissubsp.lactisIPLA-R1菌株的富含鼠李糖的高分子量EPS,能够增加PBMC模型中抗炎细胞因子IL-10的水平,降低人类结肠活检中TNFα的水平[45]。B.animalisRH菌株产生的一种分子量为23.1 kDa的中性多糖EPSa,通过体外促进免疫细胞增殖,维持小肠中派尔集合淋巴结(Peyer’s patch)的数量、稳定血清中促炎细胞因子的水平以及平衡体内Th1/Th2免疫应答,从而提高黏膜免疫。相比于其他大部分的B-EPS,EPSa分子量相对较小,分子量较低可能是其具有免疫刺激活性的重要因素之一[9]。Lopez等[38]发现,小分子量B-EPS诱导更高水平细胞因子的产生,而高分子量化合物通过释放更少的细胞因子或者降低TNFα/IL-10比例(作为抗炎指示物),从而降低免疫应答。因此,B-EPS的分子量等物化特性是决定免疫调节能力的关键因素。
目前,某些特定的双歧杆菌菌株产生的EPS在宿主免疫调节方面具有十分广泛的应用前景。B.longumsubsp.longum35624菌株能够对肠道黏膜免疫细胞产生积极作用,从而保护机体免受炎性疾病。35624菌株引起的抗炎作用和菌株表面的EPS有关,相比于EPS阴性突变株,该菌株能够防止TH17促炎反应的扩大[46]。35624菌株产生的EPS还能够调节小鼠气道过敏反应,可抑制卵清蛋白致敏小鼠肺部的Th2型免疫应答。TLR-2信号和IL-10的分泌对于抑制嗜酸性粒细胞增多和IL-4/IL-13基因表达具有十分重要的作用。呼吸道炎症小鼠模型经EPS处理后,EPS通过TLR-2/IL-10路径,减少小鼠肺部嗜酸性粒细胞的增多[47]。该EPS作为一种新型分子,能够调节呼吸道内Th2型炎症反应,防止TH17促炎反应的扩大,具有较大的应用前景。
综上,部分双歧杆菌菌株产生的B-EPS具有调节宿主免疫的功能,且B-EPS对免疫系统刺激能力具有菌株特异性。研究认为,B-EPS的分子量等物化特性是决定免疫调节能力的关键因素,但其具体作用的准确分子机制尚未完全研究清楚。因此,有待继续研究和建立B-EPS物化特性和免疫功能调节能力的关系。
3 展望
B-EPS和特定双歧杆菌菌株的多种益生功能密切相关,能够影响双歧杆菌的肠道耐受能力和定殖能力,具有调节宿主肠道菌群和免疫应答的功能,对理解菌株与宿主间的共生关系具有十分重要的作用。B-EPS的结构具有菌株特异性,其化学性质对菌株的功能特性可能具有十分重要的作用,例如聚合物分子量或者电荷等都可能是决定生物功能的关键性质。未来的研究需要解析更多的B-EPS结构(例如单糖组成、分子量、重复单元和构象等),建立聚合物的物化特性和其生物功能之间的关系,从而深入探究这些化合物在菌株和宿主关系中的具体作用机制。
此外,B-EPS作为潜在的益生元,在应用于食品工业和人类营养方面,其产量将是一个非常大的限制因素。而产EPS的双歧杆菌菌株,能够将益生元和益生菌结合起来,作为一种“合生元”的形式,在未来功能食品领域中将会是一种具有前景的应用方式,因此还需进一步通过人群干预实验,深入探究和阐明产B-EPS双歧杆菌对人类健康的作用机理,使其更好地应用于益生产品和功能食品等领域。
