外源次生代谢物结合冷水处理 对甜樱桃贮藏品质的影响
2019-04-12,,,,*
,, ,,*
(1.郑州轻工业大学食品与生物工程学院,河南郑州 450002; 2.俄勒冈州立大学园艺系,美国胡德里弗 97031)
甜樱桃(PrunusaviumL.),又称车厘子,是果树中成熟较早的优质高档水果之一,口感极佳,富含丰富的维生素及矿质元素,被国内外广大消费者所喜爱。但采后甜樱桃果实含糖量和呼吸代谢水平较高,极易受到高温、干燥、病原菌侵染等因素影响,导致贮藏过程中果面颜色暗淡、果肉褐变、果梗褐变干枯、口感发苦、甚至腐烂变质,严重限制其包装、运输和销售,失去其商业价值。目前,采收的甜樱桃须经预冷(0 ℃)处理,增加其果实硬度,才能有效地抵御清洗、消毒、分类、装箱等环节中的机械损伤[1]。包装厂通常采用0~2 ℃冷水结合含氯杀菌剂来清洗果面上的尘土及残留农药,杀灭致病菌。但是,含氯杀菌剂的使用会造成大量含氯化合物扩散或渗入果实,降低其贮藏品质,同时清洗后的水质如果处理不当,会对周围环境造成严重污染。因此,寻求一种有效、环保的甜樱桃采后保鲜技术尤为重要。
植物次生代谢物是植物与生物或非生物之间通过相互作用而产生的代谢产物,它能诱导或增强植物自身抵抗力,减轻胁迫伤害,并在正常生长发育过程中充当重要角色,根据其化学结构特征和生理作用可分为酚类、萜类、含氮类有机物、抗生素、生长刺激素、生物碱类、植物毒素和苯丙烷类等[2-4]。其中,草酸(OA)、水杨酸(SA)、茉莉酸甲酯(MeJA)、β-氨基丁酸(BABA)以及γ-氨基丁酸(GABA)被认为是植物体中重要的次生代谢物,除调控正常生长发育外,还可提高其抗氧化活性,减少病原菌侵染及腐烂,保持果实贮藏品质,延长货架期,属于环境友好型保鲜剂[5-9]。但目前为止,国内外鲜见利用外源植物次生代谢物结合冷水对采后甜樱桃果实品质方面的研究。因此,本文以甜樱桃为对象,将草酸(OA),水杨酸(SA),茉莉酸甲酯(MeJA)、β-氨基丁酸(BABA)以及γ-氨基丁酸(GABA)与0 ℃冷水结合分析处理后甜樱桃在冷藏过程中相关生理病害变化以及对贮藏品质、丙二醛含量和抗氧化活性的影响,为甜樱桃包装、贮藏、运输以及延长货架期提供理论依据。
1 材料与方法
1.1 材料与仪器
供试甜樱桃为“拉宾斯”(Lapins) 于2017年7月采自美国俄勒冈州胡德里弗农业研究和推广中心实验站果园,根据甜樱桃成熟色卡上所标注的果皮颜色,选择成熟度为5~6,直径为28.79 mm,无病虫害和机械损伤的甜樱桃果实,采后立即运回冷库并置于0 ℃下预冷;草酸、水杨酸、茉莉酸甲酯、β-氨基丁酸、γ-氨基丁酸、1,1-二苯基-2-苦基苯肼(DPPH)等试剂 购自美国Sigma-Aldrich公司。
甜樱桃成熟色卡 法国Ctifl果蔬研究中心;FirmTech-2无损型果实硬度计 美国BioWorks公司;6001型离心式榨汁机 美国Acme公司;PAL-1型手持数显折光仪 日本ATAGO公司;DL-15型终点滴定分析仪 瑞士Mettler-Toledo公司;Ultrospec 3100 Pro型紫外-可见分光光度计 英国Biochrom公司;Allegra 25R型高速离心机 美国Backman公司;PE打孔袋 美国Walter Wells & Sons公司。
1.2 甜樱桃的外源次生代谢物结合冷水处理
根据果实品质和外观,实验室前期已预筛选出5种次生代谢物最佳处理浓度,分别为:1 mmol/L草酸(OA)、1 mmol/L水杨酸(SA)、1 mmol/L茉莉酸甲酯(MeJA)、30 mmol/Lβ-氨基丁酸(BABA)和30 mmol/Lγ-氨基丁酸(GABA)。将预冷24 h后的果实随机分成6组,每组用果约20 kg,然后分别将各组果实浸到25 L含有上述次生代谢物浓度的0 ℃溶液中,浸泡10 min,以0 ℃冷水处理为对照组。处理后将果实取出晾干,装入开孔率为2%,厚度为4 mm的自封口PE打孔袋(28 cm×20 cm),置于0 ℃和相对湿度为90%的冷库中贮藏。甜樱桃在美国国内运输仅需5~7 d,但三分之二的太平洋西北甜樱桃会经空运或海运方式进入亚洲港口如青岛、上海、广州、香港等地,空运需要1~2周,海运则要4~5周。因此,本试验在冷藏后2、4周各取样一次,分别代表其经空运和海运后的果实品质。在各取样点,将各处理果实(每个处理3袋,每袋用果100个)移至室温20 ℃下放置5 h,待果实温度恢复室温后进行以下相关指标测定。
1.3 果实生理病害指标测定
考虑在贮藏第2周只有对照果实发生生理病害,其他处理均未观察,因此果实生理病害,丙二醛含量和抗氧化活性测定选择在贮藏第4周进行分析。
1.3.1 果实腐烂率测定 果实腐烂率(%)=发病果实个数/总果实数目×100,每个处理随机取100个果实,重复3次。
1.3.2 果梗褐变率 统计果实腐烂率后,对甜樱桃的果梗进行褐变统计。将果梗褐变面积占总果梗面积30%以上可定义为果梗褐变果实[10],果梗褐变率(%)=果梗褐变的果实/总果实数目×100,每个处理重复3次。
1.3.3 果面凹陷斑指数 根据果面凹陷斑数目以及凹陷斑直径[11],将果实分为5个等级:0级,果实表面无凹陷斑;1级,凹陷斑数目为1~2个且直径<1 mm;2级,凹陷斑数目为2~3个且直径在1~2 mm;3级,凹陷斑数目为3~4个且直径在2~3 mm;4级,凹陷斑数目>4个且直径>3 mm。果面凹陷斑指数=[∑(凹陷级值×果面凹陷果数)/总果实数目]×100,每个处理重复3次。
1.4 果实品质及生化指标测定
1.4.1 果实硬度和直径测定 使用FirmTech-2无损型果实硬度计测定甜樱桃果实硬度,测定速度为12 mm/s,每个处理随机测50个果实,重复3次,单位用g/mm表示。
1.4.2 可溶性固形物含量(SSC)测定 测定果实硬度和直径后,将果实去核,称取100 g样品用6001型离心式榨汁机进行榨汁,用200目尼龙滤布将果汁与果渣分离,使用PAL-1型手持数显折光仪测定SSC,每个处理重复3次。
1.4.3 可滴定酸(TA)的测定 使用DL-15型终点滴定分析仪测定可滴定酸含量,量取1.4.2制备的果汁10 mL,加入40 mL蒸馏水,放入终点滴定分析仪样品槽中,用0.1 mol/L NaOH溶液进行滴定,滴定终点设置为pH8.1,根据消耗的NaOH溶液体积,按下式计算果实中可滴定酸含量(%),每个处理重复3次。
式中:V-待测定样品液总体积,mL;c-NaOH标准溶液摩尔浓度,mol/L;V1-滴定样品液所消耗的NaOH标准溶液体积,mL;0.067-苹果酸折光系数;V2-所取果汁体积,mL;m-样品质量,g。
1.4.4 丙二醛(MDA)含量测定 采用硫代巴比妥酸法测定果实中MDA含量[12]。称取甜樱桃果肉样品2.0 g加入5.0 mL 100 g/L预冷的三氯乙酸溶液,将研磨后的样品在4 ℃下10000×g离心15 min,取2.0 mL上清液(对照为2.0 mL 100 g/L三氯乙酸溶液),再加入2.0 mL 6.7 g/L 硫代巴比妥酸溶液,混合3 min后煮沸30 min,将煮沸后样品迅速放入冰水中冷却,用Ultrospec 3100 Pro型紫外-可见分光光度计测定450、532、600 nm处吸光度,每个处理重复3次,并按下式计算MDA含量。
MDA含量(μmol/kg)=6.45×(A532-A600)-0.56×A450
1.4.5 抗氧化活性测定 采用DPPH法[13],取甜樱桃果肉样品0.5 g加入5.0 mL(7/3,v/v)乙醇/丙酮混合溶液,将研磨后的样品在4 ℃下12000×g离心15 min,收集上清液并置于-20 ℃下贮存。将上清液稀释5倍,取50 μL稀释液(对照为50 μL甲醇)加入3.0 mL 6.25×10-5mol/L DPPH溶液和0.95 mL乙醇/丙酮混合溶液,在37 ℃下暗反应30 min后,冷却至室温,在517 nm处测定吸光度值,每个处理重复3次。
1.5 数据统计与分析
本试验采用SPSS 19.0软件进行单因素方差分析(ANOVA),同时利用Fisher最小显著差异(LSD)进行多重比较分析。
2 结果与分析
2.1 外源次生代谢物结合冷水处理对甜樱桃果实生理病害指标的影响
冷水处理是甜樱桃采后最常见的快速降温方式,果实通过直接接触冷水实现热交换[14],且冷水可使果实冷却更均匀。为减少病原菌数量,防止潜在微生物侵染,需在水冷过程中添加杀菌剂,目前,最常用的杀菌剂是用次氯酸钠(NaOCl)或次氯酸钙(Ca(OCl)2),但其抗菌活性取决于使用浓度、溶液pH及处理时间。研究发现当溶液中有效氯含量在10~35 mg/L,pH在5.8~7.5之间,次氯酸主要以非电离状态存在并具有较高的抗微生物活性[14]。如果降低溶液pH,会导致大量Cl2释放,危害工人身体健康,因此,利用植物次生代谢产物替代传统含氯杀菌剂是本试验研究目的。由图1可知,0 ℃贮藏4周后,与对照组相比,OA、SA、MeJA、BABA和GABA处理均可显著抑制果实腐烂发生(p<0.05)。其中,OA、BABA和GABA处理组的腐烂率分别为2.1%、2.5%和2.8%;SA和MeJA处理效果略差,腐烂率分别为4.8%和5.3%,但仍低于对照组6.8%。

图1 外源次生代谢物结合冷水处理 对冷藏4周后甜樱桃果实腐烂率的影响Fig.1 Effects of exogenous secondary metabolites combined with hydrocooling water on decay rate of sweet cherry after 4 weeks of cold storage注:小写字母不同者表示经Fisher多重比较检验并 在0.05水平上差异显著;相同字母则表示 差异不显著(p<0.05)。图2、图6、图7同。
果实外观品质是影响消费者购买甜樱桃的重要因素之一。消费者主要通过对果实外观颜色、果梗以及果面情况进行挑选[15],此外,保持较好的甜樱桃外观品质不但能提高消费者购买欲,而且能延长果实贮藏寿命。如图2可知,0 ℃贮藏4周后,对照组果面颜色暗淡,果梗褐变率高达100%,且果实表面出现3~4或>4个凹陷斑,直径在2~3 mm或>3 mm以上。但OA、SA、MeJA、BABA和GABA处理能够抑制果梗褐变以及凹陷斑发生,其作用效果各不相同。其中,SA和MeJA处理后,果梗褐变率分别为85%和82%,对果梗褐变抑制作用较弱,与对照组无显著差异(p>0.05),而OA、BABA和GABA处理后,果梗褐变率分别为15%、38%和42%,对果梗褐变抑制作用较明显。果面凹陷斑指数在SA、MeJA、BABA和GABA处理中分别为2.5、2.3、1.5和1.9,显著低于对照组的3.2(p<0.05),其中OA处理效果最为明显,仅为0.9,完全处于商业销售可接受范围之内。
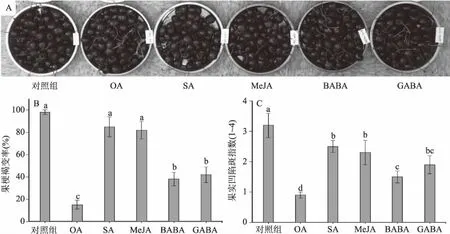
图2 外源次生代谢物结合冷水处理对冷藏4周后甜樱桃果实外观、果梗褐变及果面凹陷斑的影响Fig.2 Effects of exogenous secondary metabolites combined with hydrocooling water on appearance,stem browning,and surface pitting of sweet cherry after 4 weeks of cold storage
2.2 外源次生代谢物结合冷水处理对甜樱桃果实品质的影响
果实硬度和直径变化是反映甜樱桃其品质的重要指标。采后甜樱桃经低温处理后其果实硬度逐渐增加,Drake和Elfving等[16]推测可能与果面周围的水分损失有关,但这种水分损失与果实失重率之间无任何相关性,仍需进一步深入研究。由图3A可知,随冷藏时间延长,各处理组果实硬度均呈上升趋势。冷藏4周后,OA和MeJA处理的果实硬度比对照组果实分别高1.4%和4.6%,而SA、BABA和GABA比对照组果实低1.0%、1.1%和3.1%。由图3B可知,对照组和SA处理的果实直径均随着贮藏时间延长逐渐下降,且SA处理的果实直径比对照组低1.1%。虽然MeJA、BABA和GABA处理的果实直径高于对照组,但与浸泡处理前无显著变化(p>0.05)。与其他处理不同,经OA处理的果实直径与对照组相比增加了3.6%。Martínez-Esplá等[17]研究发现采前喷施OA不但可以增加采收时甜樱桃果实直径、体积及重量,而且可以提高果实硬度和果面着色。但在采后保鲜技术方面,鲜有文献提及OA能够增加果实直径,因此仍需试验做进一步验证。对比OA、SA、MeJA、BABA和GABA结合冷水对果实硬度和直径的作用效果可知,OA对维持较高的果实硬度和直径具有积极的作用。
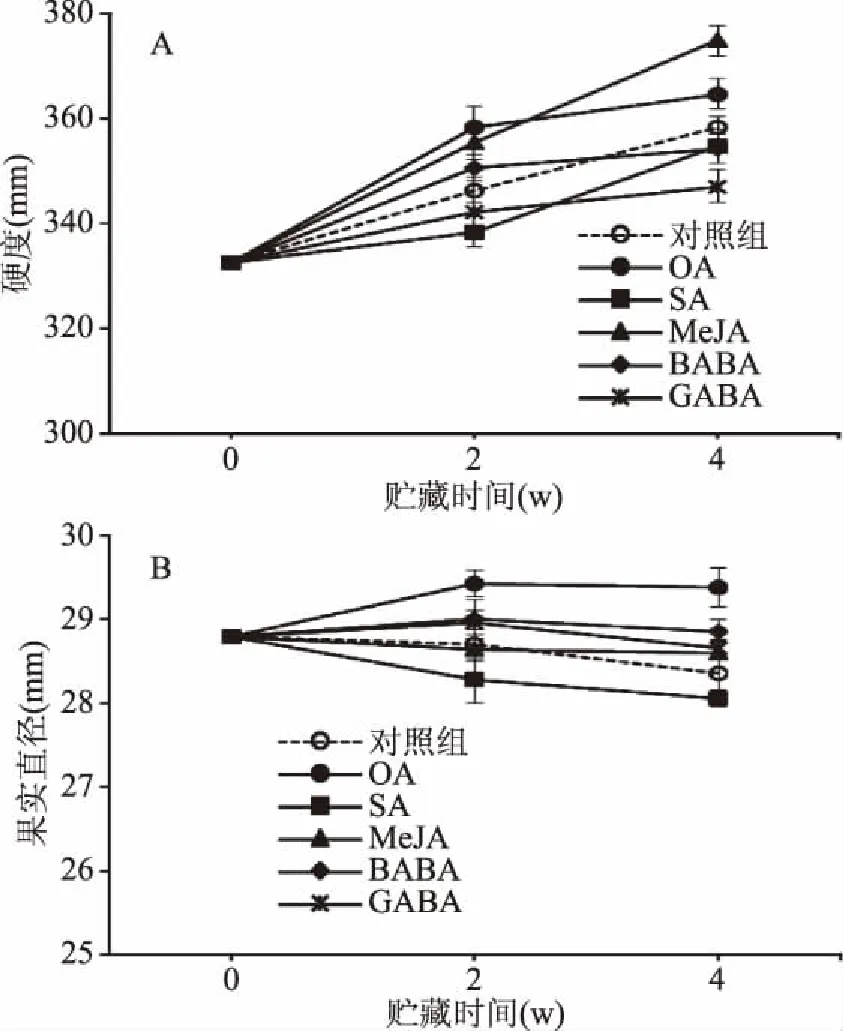
图3 外源次生代谢物结合冷水处理 对冷藏过程中甜樱桃果实硬度和直径的影响Fig.3 Effects of exogenous secondary metabolites combined with hydrocooling water on fruit firmness and diameter of sweet cherry during cold storage
SSC是甜樱桃采收重要标准之一。Serrao等[18]研究发现甜樱桃中糖源主要以葡萄糖、果糖、蔗糖和山梨醇为主,其中葡萄糖和果糖含量较高,且随着果实生长发育逐渐增加,而蔗糖和山梨醇含量较低,在发育过程中无明显变化。延缓采后甜樱桃果实中SSC变化对维持果实香气和贮藏品质具有重要作用[19]。由图4看出,在整个冷藏过程中,各处理组果实中SSC均呈下降趋势。这种SSC损失推测与果实品种有关,目前在“拉宾斯”(Lapins)[20]、“宾莹”(Bing)[21]、费罗维亚(Ferrovia)或夏卡(Sciazza)[22]等品种已观察到SSC随贮藏时间延长而降低,而其他甜樱桃品种中SSC无明显变化。本试验采收时果实中SSC为17.0%,贮藏4周后对照组下降至15.6%。与对照组相比,SA和MeJA处理中SSC下降较快,分别为15.1%和14.8%,而OA、BABA和GABA处理明显延缓SSC降低,在贮藏4周后仍高于对照组4.1%、3.9%和5.4%。上述结果表明OA、BABA和GABA结合冷水处理能够维持果实中较高SSC,延缓果实品质劣变进程。

图4 外源次生代谢物结合冷水处理 对冷藏过程中甜樱桃SSC的影响Fig.4 Effects of exogenous secondary metabolites combined with hydrocooling water on SSC of sweet cherry during cold storage
采收后甜樱桃中TA含量对保持其浓郁的香气具有同样重要作用,但其含量高低又受品种、采收时间、贮藏条件以及采后处理方式等因素影响[18]。由图5可知,各处理组中TA含量随贮藏时间延长呈下降趋势。相比对照组果实,OA、SA、MeJA、BABA和GABA处理在贮藏2周后仍维持果实内较高的TA含量,但在贮藏4周后,OA、SA、MeJA、BABA以及GABA处理果实TA分别下降至0.46%、0.45%、0.47%、0.43%和0.44%,与对照组0.46%之间差异不显著(p>0.05)。
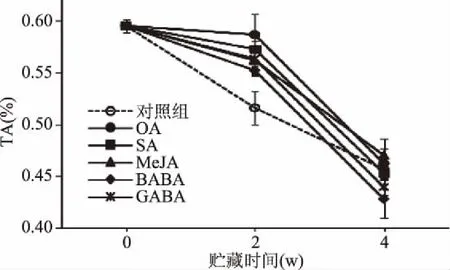
图5 外源次生代谢物结合冷水处理 对冷藏过程中甜樱桃TA的影响Fig.5 Effects of exogenous secondary metabolites combined with hydrocooling water on TA of sweet cherry during cold storage
2.3 外源次生代谢物结合冷水处理对甜樱桃生化指标的影响
果实中MDA变化直接反映其细胞内膜质过氧化程度以及体内活性氧自由基对细胞膜系统的伤害程度[23]。由图6可知,0 ℃贮藏4周后,对照组果实中积累了大量MDA,而OA、SA、MeJA、BABA和GABA处理均抑制了MDA在果实体内积累,其中SA、MeJA、BABA和GABA处理中MDA含量分别为对照组的71%、77%、63%和71%,OA处理的果实MDA含量最低(14.5 μmol/g),仅为对照组的40%。
随贮藏时间延长,果实逐渐积累大量MDA和活性氧自由基,但通过自身产生的酚类、黄酮类、类黄酮类及抗氧化酶系统等抗氧化相关物质,提高其防卫反应,减弱衰老对果实细胞造成的伤害[24-25]。由图7可知,0 ℃贮藏4周后,与对照组相比,OA、SA、MeJA、BABA和GABA处理均可提高甜樱桃果实抗氧化活性。其中,OA处理抗氧化活性最高为502 μmol/g,SA、MeJA、BABA、GABA处理抗氧化活性次之,分别为387、417、439和419 μmol/g,对照组抗氧化活性最低为339 μmol/g。Valero等[26]用1 mmol/L OA或SA分别浸泡处理甜樱桃后,2 ℃冷藏20 d后发现OA和SA均能延长采后果实贮藏品质,是通过抑制有机酸减少,提高其抗氧化物质含量。Yao和Tian等[6]研究发现采后MeJA浸泡甜樱桃可有效提高其果实贮藏早期抗氧化活性,抑制病原菌生长。Wang等[27]研究发现用20~50 mmol/L BABA浸泡甜樱桃,20 ℃货架贮藏5 d后能够明显抑制果实失重,维持较高TA含量以及抗氧化活性。上述结果表明,OA、SA、MeJA、BABA和GABA处理都能提高甜樱桃果实抗氧化活性,延缓果实品质劣变并增强果实抗病能力。
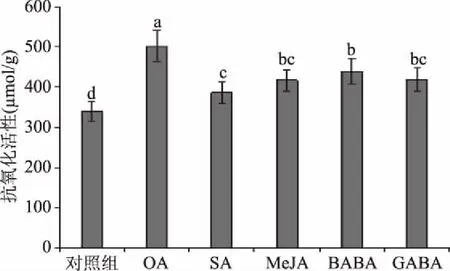
图7 外源次生代谢物结合冷水处理 对冷藏4周后甜樱桃抗氧化活性的影响Fig.7 Effects of exogenous secondary metabolites combined with hydrocooling water on antioxidant capacity of sweet cherry after 4 weeks of cold storage
3 结论
本研究发现0 ℃贮藏4周后,与对照处理相比OA、SA、MeJA、BABA和GABA结合冷水处理均可保持甜樱桃果面光泽,抑制果实腐烂率、果梗褐变及果面凹陷斑发生,延缓果实贮藏品质劣变、丙二醛积累并维持较高的抗氧化活性。通过对比不同次生代谢对果实贮藏品质的影响可知,SA效果较差,主要是由于其降低了果实直径和SSC,进而影响果实贮藏寿命;BABA和GABA虽能保持果实直径,抑制SSC降解,但对贮藏过程中果实硬度无明显作用;OA和MeJA处理均可提高果实硬度,有效地延长果实贮藏时间,但MeJA对SSC降解调控能力较弱。综上所述,建议在清洗和消毒环节使用1 mmol/L OA结合冷水处理甜樱桃,对延长果实贮藏寿命、抑制运输和销售环节中果实品质劣变及生病害发生具有重要作用。
