根皮素调控NF-κB对MRL/lpr狼疮性肾炎小鼠的保护作用①
2019-04-12胡义阳余鹏程
胡义阳 余鹏程
(泉州市第一医院,泉州362000)
系统性红斑狼疮(Systemic lupus erythematosus,SLE),也称为狼疮,是一种自身免疫性疾病的特征,是自身抗体产生,免疫复合物沉积,白细胞浸润,补体激活和炎症细胞介导的组织损伤。狼疮性肾炎(Lupus nephritis,LN),也称为SLE肾炎,是肾脏的炎症由SLE引起的。 LN是SLE最严重的并发症之一,并且是SLE患者发病率和死亡率的主要原因。虽然免疫治疗改善SLE肾病患者的预后疾病,最终LN患者的比例很大进展为终末期肾病[1]。目前研究认为,免疫调节失衡与炎症等关键致病环节是狼疮性肾炎的主要特征,同时也是狼疮性肾炎的重要发病机制[2]。因此,探寻新的治疗手段来调节免疫功能以及控制炎症反应可能为治疗狼疮性肾炎损伤提供新思路。
根皮素是一种天然化合物,广泛存在于苹果树的树皮、叶子和果实中[3]。根皮素有许多生物活性,其中抗炎和免疫调节作用最为突出[4]。有研究显示,根皮素能够显著抑制炎症基因的表达[5]。Chang等[6]在脂多糖(Lipopolysaccharide,LPS)刺激的巨噬细胞中观察到,根皮素预处理能够显著抑制NF-κB的活化。既往研究证实,NF-κB的活化以及下游TNF-α、IL-1β的产生能够显著促进狼疮性肾炎的发展[2]。然而,根皮素是否通过调控NF-κB通路在狼疮性肾炎中发挥保护功能尚未阐明。因此,本研究建立小鼠狼疮性肾炎模型,拟观察根皮素对狼疮性肾炎的影响及其可能的分子机制。
1 材料与方法
1.1材料 P-IκB、NF-κB、Fibrillirin、F4/80、CCL2、NALP3、Caspase-1p20、GAPDH抗体购自Cell signaling technology 公司。根皮素购自上海融禾(纯度≥99%,批号:161229)。羧甲基纤维素钠(CMC-Na)购自国药集团化学试剂有限公司(Sinopharm Chemical Reagent Co.Ltd.,China)。HE染色试剂盒由北京海德创业公司提供。IL-1β、TNF-α检测试剂盒购自上海蓝基生物公司。
1.2方法
1.2.1动物及实验分组 10周龄 C57BL/6 雌性小鼠,15只,体质量(27.0±1.6)g。纯种10周 MRL/lpr 雌性小鼠,30只,体质量(27.0±1.5)g。2 种小鼠均由南京大学-南京生物医药研究院提供,合格证号 SCXK( 苏) 2017-0008。饲养环境为温度(23±1)℃,湿度(55±5)%,12 h 循环光照,给予清洁级无菌垫料、饲料和饮水,让其自由摄食、饮水。实验规范严格按照实验动物规范条例进行。分为对照组:C57BL/6 雌性小鼠,15只,给予同等剂量0.5% CMC-Na;模型组: MRL/lpr 雌性小鼠,15只,给予同等剂量0.5% CMC-Na;治疗组:MRL/lpr 雌性小鼠,15只,根皮素(400 mg/kg,溶于0.5% CMC-Na溶液)灌胃处理8周[7]。
1.2.2尿蛋白检测 将所有尿液标本用双蒸水稀释10 倍后使用,用BCA法检测样本中蛋白含量。使用BCA蛋白浓度检测试剂盒进行,按说明书操作,加入样本和标准品后,加入BCA 200 μl工作液,37℃孵育30 min。酶标仪(波长562 nm)测定吸光度A。根据标准品计算样品的蛋白浓度。
1.2.3免疫荧光检测各组肾脏IgG沉积情况 肾组织冰冻切片PBS漂洗3次,每次5 min;滴加Alexa Fluor-546标记的IgG抗体,室温避光孵育2 h。PBS漂洗后,避光条件下甘油封片,在荧光显微镜下观察并拍照,应用Image Pro Plus 6.0 软件进行荧光强度分析。
1.2.4肾脏组织病理形态学 观察取肺组织,常规冲洗后多聚甲醛固定,石蜡包埋切片并经HE染色法显微镜下观察各组肾脏的炎症浸润情况。
1.2.5ELISA验证实验检测 小鼠肾脏组织以及血清中抗ds-DNA、IL-1β、TNF-α的含量,3组的小鼠肾脏组织,浸泡于预冷的PBS缓冲液中,研磨后制成匀浆液,离心后取上清。按相应试剂盒说明书操作,配置梯度标准品与检测试剂,每孔加入的样品/对照品100 μl,每个样品重复2次,4℃孵育过夜,洗板后加入检测抗体100 μl,室温孵育1 h,洗板后加入HRP-Streptavidin工作液,室温45 min,洗板后加入TMB显色液,室温30 min;洗板后每孔加入终止液 50 μl,在450 nm波长处读数A,绘制标准曲线,计算出样品浓度,每个样品重复的 2 孔取均值用于数据分析。血清样本离心后,方法同上。
1.2.6Western blot 检测 小鼠肾脏组织P-IκB、NF-κB、F4/80、CCL2、NALP3、Caspase-1p20、蛋白表达将提取后的蛋白进行上样、电泳、转膜、封闭、洗膜、一抗4℃过夜孵育,用洗膜液漂洗后,二抗杂交1 h,清洗后加上化学发光剂(ECL)显色,上机检测。
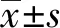
2 结果
2.1小鼠尿蛋白含量 每2周分别留取模型组以及治疗组小鼠的尿液,检测尿蛋白的含量。模型组小鼠尿蛋白含量呈时间依赖性升高,而治疗组中给予根皮素后16、18周的尿蛋白含量较模型组显著降低(表1,P<0.05)。
2.2肾脏组织病理学观察 较对照组相比,HE染色下模型组小鼠肾小球增生,肾小球硬化以及肾小球周围炎症明显加重,而给予根皮素治疗后治疗组肾脏病理改变明显缓解(图1)。
2.3肾组织IgG沉积观察 较对照组相比,模型组小鼠肾小球大量IgG免疫复合物沉积,荧光强度明显增加,而给予根皮素治疗后治疗组肾小球免疫复合物沉积情况缓解(图2,P<0.05)。
2.4各组小鼠血清抗ds-DNA、尿素氮(BUN)、肌酐(CRE)水平比较 模型组小鼠血清抗ds-DNA、BUN、CRE水平较对照组明显增加(P<0.05),而给予根皮素治疗后血清抗ds-DNA、 BUN、CRE增加水平明显得到缓解,说明根皮素减轻了肾损伤(图3,P<0.05)。

表1 两组小鼠各时间点尿蛋白检测
Note:Compared with model group,1)P<0.05.

图1 肾组织HE染色Fig.1 HE staining

图2 肾组织IgG荧光染色Fig.2 IgG fluorescent staining in renal tissueNote: Compared with control group,*.P<0.05;compared with model group,#.P<0.05.

图3 各组小鼠血清抗ds-DNA,BUN,CRE水平比较Fig.3 Comparison of serum anti-ds-DNA,BUN and CRE levels in different groups of miceNote: Compared with control group,*.P<0.05;compared with model group,#.P<0.05.
2.5根皮素对狼疮肾NF-κB激活影响 NF-κB活化与SLE的发病机制有关[8]。模型组中NF-κB活化显著增强,表现为胞溶质蛋白中IκB的磷酸化与对照组相比显著增加,同时NF-κB p65的核转位也较对照组小鼠相比显著增加(图4,P<0.05)。而给予根皮素干预后IκB的磷酸化以及NF-κB p65的核转位明显受到了抑制(图4,P<0.05)。

图4 肾组织中NF-κB的激活情况Fig.4 Activation of NF-κB in renal tissuesNote: Compared with control group,*.P<0.05;compared with model group,#.P<0.05.

图5 肾组织中F4/80,CCL2,NALP3和Caspase-1p20蛋白表达情况Fig.5 Expression of F4/80,CCL2,NALP3 and Caspase-1p20 proteins in renal tissuesNote: Compared with control group,*.P<0.05;compared with model group,#.P<0.05.

图6 肾组织以及血清中TNF-α和IL-1β的水平Fig.6 Renal tissue and serum levels of TNF-α and IL-1Note: Compared with control group,*.P<0.05;compared with model group,#.P<0.05.
2.6根皮素对狼疮肾炎症的影响 免疫组化结果显示,与对照组相比,模型组中巨噬细胞标记物F4/80表达明显增加,提示模型组中巨噬细胞浸润增加,而根皮素治疗能明显改善巨噬细胞的浸润(图5A,P<0.05)。此外,Western blot结果显示,模型组中F4/80、炎症趋化因子CCL2、炎症小体NALP3和Caspase-1p20蛋白表达明显增加(图5B,P<0.05),而给予根皮素干预后F4/80、CCL2、NALP3和Caspase-1p20蛋白的增加水平明显降低(图5B,P<0.05),提示根皮素抑制了狼疮肾组织的炎症反应。
2.7根皮素对肾组织以及血清中TNF-α和IL-1β的影响 TNF-α和IL-1β作为NF-κB及NALP3的下游,因此我们检测了TNF-α和IL-1β在血清以及肾组织中的水平,与对照组相比,模型组肾组织以及血清中TNF-α和IL-1β显著增高(图6,P<0.05),而给予根皮素干预后TNF-α和IL-1β在肾组织以及血清中的水平明显降低(图6,P<0.05)。
3 讨论
LN是导致SLE患者病情恶化的主要原因。目前针对LN的新药物尚不能满足临床需求[9]。在本研究中,我们证明根皮素治疗可以改善MRL/lpr小鼠中LN的严重程度。 经过根皮素治疗后的MRL/lpr的小鼠其肾损伤明显得到了缓解。表现为尿蛋白评分,血清尿素氮和肌酸酐水平显著降低。同时经过根皮素干预后的MRL/lpr小鼠,其血清抗dsDNA抗体减少,减轻了免疫复合物在肾小球的沉积。进一步探讨根皮素作用机制发现,根皮素能够显著抑制NF-κB的活化和NLRP3炎性体激活,减少了下游炎性细胞因子TNF-α和IL-1β的产生与释放。根皮素治疗也显著降低CCL2的表达和巨噬细胞浸润。NF-κB与包括LN在内的几种自身免疫性疾病的发病机制有关[10]。多项研究表明,NF-κB的激活能够加重LN患者肾小球的破坏以及伴随大量炎症因子的产生。 NF-κB的激活需要IKKβ活性使IκB磷酸化。抑制IKKβ能够减轻缺氧诱导大鼠肾小管的损伤[11]。 IKK选择性抑制剂Bay11-7082能够通过抑制NF-κB活化改善狼疮肾炎小鼠的肾损伤[9]。 A20负面调节NF-κB活化和泛素结合蛋白ABIN1,通过促进A20的作用和抑制NF-κB信号传导[12]。表达无活性形式的ABIN1的敲入小鼠能够激活NF-κB并促进狼疮性肾炎的发展[13]。因此,NF-κB信号通路能够作为LN治疗的潜在靶点。我们的数据显示根皮素能够显著抑制NF-κB活性,抑制炎性细胞因子TNF-α,IL-1β的产生。这些结果表明根皮素可抑制NF-κB的活化从而达到对LN的保护作用。
同时,NLRP3炎症小体也被多项研究证明参与了LN的发生发展,并在LN中发挥了重要作用[14]。 抑制NF-κB也能够抑制NLRP3表达,减少IL-1β和IL-18在肾脏中的分泌,从而保护MRL/lpr小鼠肾功能。在除了NLRP3之外,caspase-1也在小鼠LN中发挥了重要性。 有研究表明,caspase-1缺陷型小鼠能够减缓LN的发生发展。通过抑制P2X7受体,从而抑制NLRP3和capase-1的激活,达到保护LN的目的[15]。本研究中我们发现根皮素治疗后显著抑制NLRP3和caspase-1活化,影响了白介素1β的成熟。因此,根皮素能够抑制炎性体的激活,从而在LN中发挥保护作用。有研究认为肾巨噬细胞作为LN疾病的标志物,巨噬细胞的浸润与LN发生发展密切相关[16]。CCL2(MCP-1)是单核细胞有效的趋化因子。MCP-1、CCR2的受体能够使单核细胞迅速聚集于炎症部位。抑制MCP-1/CCR2信号传导也能够减轻炎性巨噬细胞对LN肾组织的破坏。本实验中证明根皮素治疗可抑制CCL2的表达,从而抑制巨噬细胞浸润,达到保护LN的目的。
综上所述,根皮素可以通过抑制NALP3,NF-κB的激活,从而抑制炎症细胞的浸润,炎症因子的产生,减轻LN的肾损害,改善小鼠预后。本实验通过多个途径研究根皮素对LN小鼠的影响,为目前LN治疗提供了新的思路,并揭示潜在的分子机制,为根皮素的临床应用提供了一定的理论基础。