荔枝核总皂苷对脂多糖诱导的神经细胞损伤的影响研究
2019-04-12马凤巧王卫娜薛士鹏
马凤巧 张 珊 王卫娜 薛士鹏
(南阳医学高等专科学校基础医学部,南阳473000)
中枢神经系统退行性疾病(Neurodegenerative diseases,NDD)包括帕金森氏病、阿尔茨海默病(AD)等,是一组慢性进行性中枢神经组织退行性疾病,给人们的生活质量造成严重影响。随着我国老龄化人口增加,患病率呈现日益升高趋势,目前NDD的发病机制尚未完全明确[1,2]。选择有效的防治该组疾病的药物尤为重要。荔枝核是荔枝的干燥成熟种子,具有抗肿瘤、抑菌、抗氧化、抗炎等多种作用。荔枝核总皂苷(Lychee seed saponins,LSS)是荔枝核的提取物,有研究显示,LSS可降低Aβ在AD大鼠海马中的沉积,减少Cyt-C释放,从而减轻由STZ诱导的海马神经元凋亡[3]。这提示LSS可能在NDD治疗中发挥重要作用。脂多糖(Lipopolysaccharide,LPS)是一种细菌内毒素,被认为是刺激大脑产生炎症的一种炎症原,可促进NDD的发生及进展[4]。PC12细胞是大鼠的嗜铬细胞瘤细胞,目前被广泛用作神经元模型,用于神经系统疾病的研究。有研究显示,LPS可诱导PC12细胞凋亡[5]。LSS是否可降低由LPS诱导的PC12细胞损伤目前还未明确。因此,本研究通过LPS刺激PC12细胞,检测LSS对细胞存活率、凋亡率及免疫的影响,并研究其可能的分子机制,为NDD的防治提供理论基础。
1 材料与方法
1.1主要试剂和仪器 LSS由郑州大学药学院制备;LPS及MTT购自美国Sigma;DMEM培养基、胎牛血清购自美国Gibco;H2DCFHDA购自碧云天生物技术研究所;Annexin V-FITC/PI双染细胞凋亡试剂盒及流式细胞仪均购自美国BD;PI3K、p-AKT、cyclinD1、Bax、HIF-1α、VEGF抗体购自美国Abcam;分光光度计购自上海光谱仪器有限公司;自动酶标仪购自美国Bio-Tek。
1.2方法
1.2.1细胞培养 PC12细胞(大鼠嗜铬细胞瘤细胞)购自中国科学院上海细胞库。细胞复苏后在DMEM培养基(含有5%胎牛血清、10%马血清及1%双抗)中,于5%体积分数CO2培养箱中37℃培养,每2 d换液一次,按照实验需要传代。实验为生长至对数期的细胞。
1.2.2LSS对PC12细胞存活率的影响 以2×104ml-1接种生长至对数期的PC12细胞于96孔板,每孔中加入100 μl,于5%体积分数CO2培养箱中37℃培养过夜,随机分为对照组(加入细胞悬液)和LSS组(3.75、7.5、15、30、60 mg/L的LSS处理细胞),每组设置6个复孔,24 h后,每孔中加入50 μl的MTT溶液(5 mg/ml),培养4 h后将培养液吸弃,在每孔中加入150 μl的DMSO,充分混匀后,490 nm处,酶标仪测定吸光度(A)。计算细胞存活率。根据LSS对PC12细胞的抑制率选择LSS的最佳作用浓度,用于后续试验。
1.2.3LSS对LPS诱导的PC12细胞存活率的影响 随机将PC12细胞分为对照组(细胞不做任何处理)、LPS处理组(用终浓度为1 mg/ml的LPS处理PC12细胞24 h)、LSS处理组(终浓度为3.75 mg/L的LSS孵育细胞24 h后,再用1 mg/ml的LPS处理PC12细胞24 h)。每组设置5个复孔,参照1.2.2方法检测各组细胞存活率。
1.2.4LSS对LPS诱导的PC12细胞凋亡的影响 取1.2.3分组处理至规定时间的3组细胞,胰酶消化细胞,离心后用预冷的PBS洗涤细胞,收集约105个细胞,在每500 μl中分别加入5 μl的Annexin V-FITC和5 μl的PI,轻轻混匀,避光环境室温孵育10 min,1 h内上机,流式细胞仪检测。实验重复3次。
1.2.5LSS对LPS诱导的PC12细胞ROS含量的影响 将生长至对数期的PC12细胞制备成细胞悬液,以(1~2)×104个/ml细胞密度接种于培养瓶内,观察到细胞贴壁生长达80%~90%时,按照1.2.3分组处理细胞,收集处理至规定时间的细胞,悬浮细胞于含有10 μmol/L终浓度的H2DCFHDA的无血清培养液中,培养箱内37℃孵育20 min,无血清的培养液及PBS洗涤细胞,PBS重悬细胞后,于488 nm激发波长,525 nm发射波长,通过荧光分光光度计检测各组的相对荧光强度(OD值),从而可反映出细胞内的ROS水平。实验重复3次。
1.2.6PI3K、p-AKT、cyclinD1、Bax、HIF-1α、VEGF蛋白表达检测 适量的RIPA裂解液提取1.2.3分组处理至规定时间的3组细胞总蛋白,BCA试剂盒对蛋白浓度测定。取40 μg总蛋白,经12%SDS-PAGE电泳后通过电转至PVDF膜上,将转好的膜用5%的脱脂奶粉封闭,2 h后加入稀释好的PI3K、p-AKT、cyclinD1、Bax、HIF-1α、VEGF抗体,4℃摇床孵育过夜,将一抗弃去,加入二抗稀释液,室温孵育2 h,弃去二抗,洗膜,ECL显色,显影后,以GAPDH为内参蛋白,通过凝胶图像处理系统分析目的蛋白相对于内参GAPDH蛋白的光密度值。
2 结果
2.1LSS对P12细胞存活率的影响 0、3.75、7.5、15、30、60 mg/L的LSS处理P12细胞24 h,细胞存活率检测结果如图1所示,各浓度细胞存活率分别为100%、(97.18±1.67)%、(95.45±3.77)%、(78.45±6.56)%、(63.69±5.08)%、(51.34±6.12)%,0、3.75、7.5、15、30、60 mg/L的LSS处理P12细胞24 h,细胞存活率检测结果整体比较差异具有统计学意义(F=58.905,P=0.000);3.75 mg/L和7.5 mg/L的LSS对PC12细胞存活率的影响与0 mg/L LSS比较差异无统计学意义(P>0.05),而15、30和60 mg/L的 LSS均能显著降低PC12细胞存活率,与0 mg/L LSS比较差异具有统计学意义(P<0.05)。因此,选择3.75 mg/L的 LSS为研究对象。
2.2LSS对LPS诱导的PC12细胞存活率的影响 对照组、LPS组和LSS组细胞存活率分别为100%、(54.68±5.62)%、(78.86±6.13)%,整体比较差异具有统计学意义(F=66.919,P=0.000),LPS组细胞存活率显著低于对照组(P<0.05),而LSS组细胞存活率显著高于LPS组(P<0.05)。见图2。
2.3LSS对LPS诱导的PC12细胞凋亡率的影响 对照组、LPS组和LSS组细胞凋亡率分别为(1.53±0.21)%、(22.16±1.45)%、(10.47±0.74)%,三组整体比较差异具有统计学意义(F=357.533,P=0.000),LPS组细胞凋亡率显著高于对照组(P<0.05),而LSS组细胞凋亡率显著低于LPS组(P<0.05)。见图3。
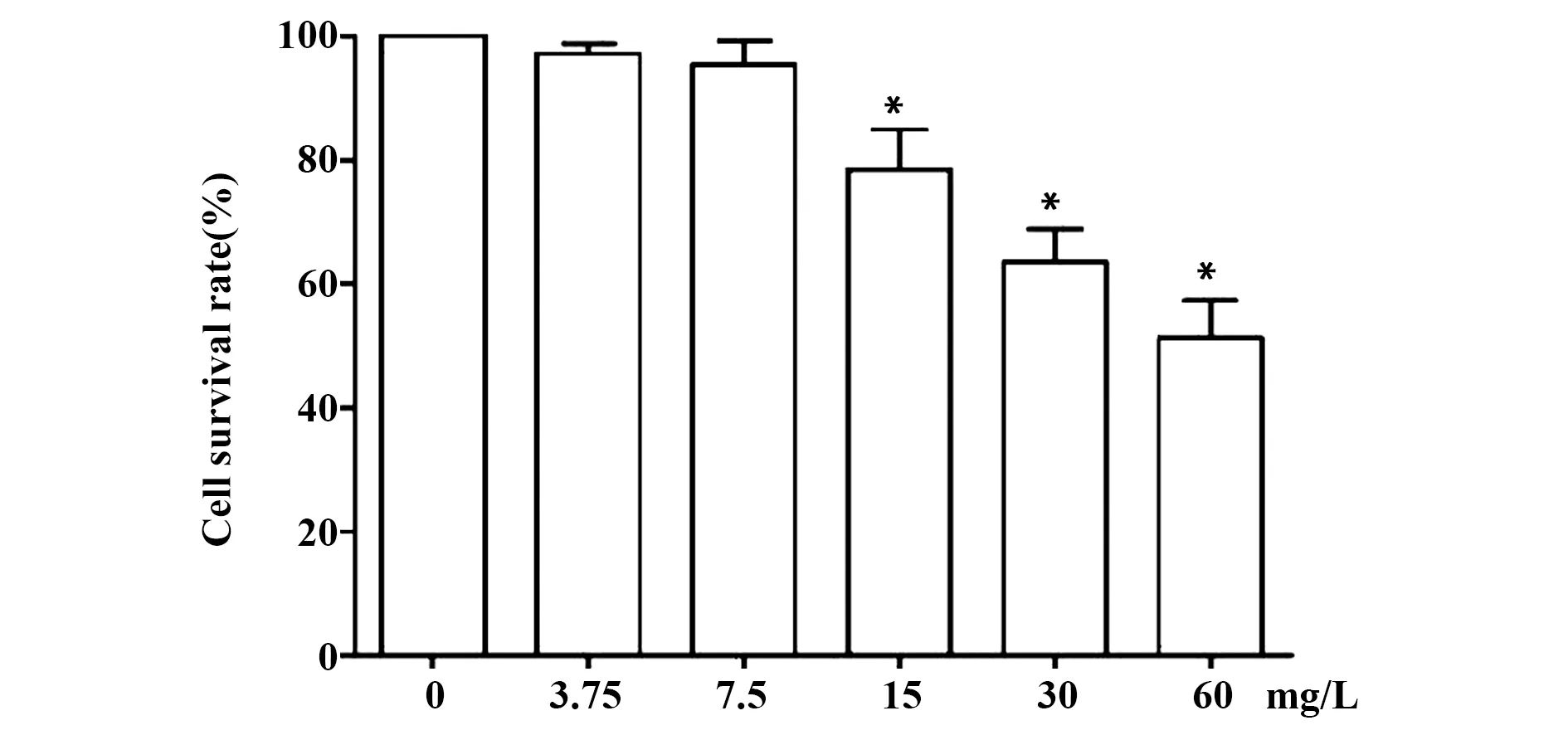
图1 LSS对P12细胞存活率的影响Fig.1 Effect of LSS on survival rate of P12 cellsNote: *.P<0.05 vs 0 mg/L LSS.

图2 LSS对LPS诱导的PC12细胞存活率的影响Fig.2 Effect of LSS on survival rate of PC12 cells induced by LPSNote: *.P<0.05 vs Control group;#.P<0.05 vs LPS group.
2.4LSS对LPS诱导的PC12细胞ROS水平的影响 对照组、LPS组和LSS组细胞的ROS含量分别为323.45±12.39、447.83±20.67、368.26±16.74,3组 的ROS含量整体比较差异具有统计学意义(F=41.481,P=0.000),LPS组细胞ROS含量明显高于对照组(P<0.05),而LSS组细胞ROS含量明显低于LPS组(P<0.05)。见图4。
2.5LSS对LPS诱导的PC12细胞HIF-1α和VEGF表达的影响 通过Western blot检测各组细胞免疫抑制因子HIF-1α和VEGF的蛋白表达,结果如图5所示,对照组、LPS组和LSS组HIF-1α的蛋白表达分别为(0.062±0.010)、(0.278±0.032)、(0.162±0.024),VEGF的蛋白表达分别为(0.130±0.015)、(0.579±0.043)、(0.244±0.021),3组HIF-1α的蛋白表达和VEGF的蛋白表达比较差异具有统计学意义(FHIF-1α=61.864,PHIF-1α=0.000;FVEGF=194.924,PVEGF=0.000), LPS组细胞HIF-1α和VEGF的蛋白表达均明显高于对照组(P<0.05),而LSS组细胞HIF-1α和VEGF的蛋白表达均明显低于LPS组(P<0.05)。

图3 LSS对LPS诱导的PC12细胞凋亡率的影响Fig.3 Effect of LSS on apoptosis rate of PC12 cells induced by LPSNote: A.The rate of apoptosis was detected by flow cytometry;B.The rate of apoptosis in each group of cells;*.P<0.05 vs Control group;#.P<0.05 vs LPS group.

图4 LSS对LPS诱导的PC12细胞ROS水平的影响Fig.4 Effect of LSS on ROS level of PC12 cells induced by LPSNote: *.P<0.05 vs Control group;#.P<0.05 vs LPS group.
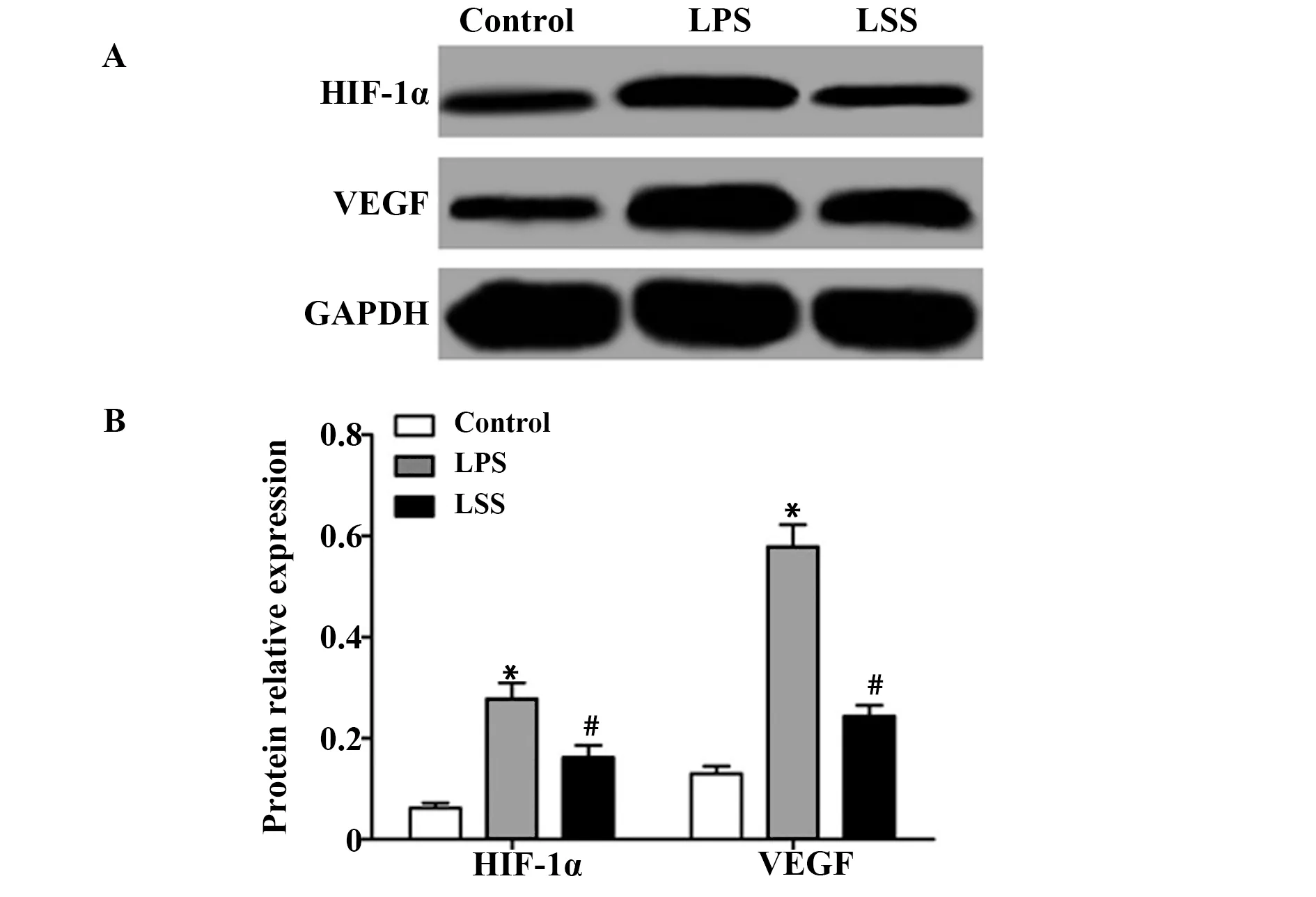
图5 LSS对LPS诱导的PC12细胞HIF-1α和VEGF表达的影响Fig.5 Effect of LSS on expression of HIF-1α and VEGF induced by LPSNote: A.HIF-1α and VEGF protein expression electrophoresis;B.The relative expression of HIF-1 α and VEGF protein;*.P<0.05 vs Control group;#.P<0.05 vs LPS group.
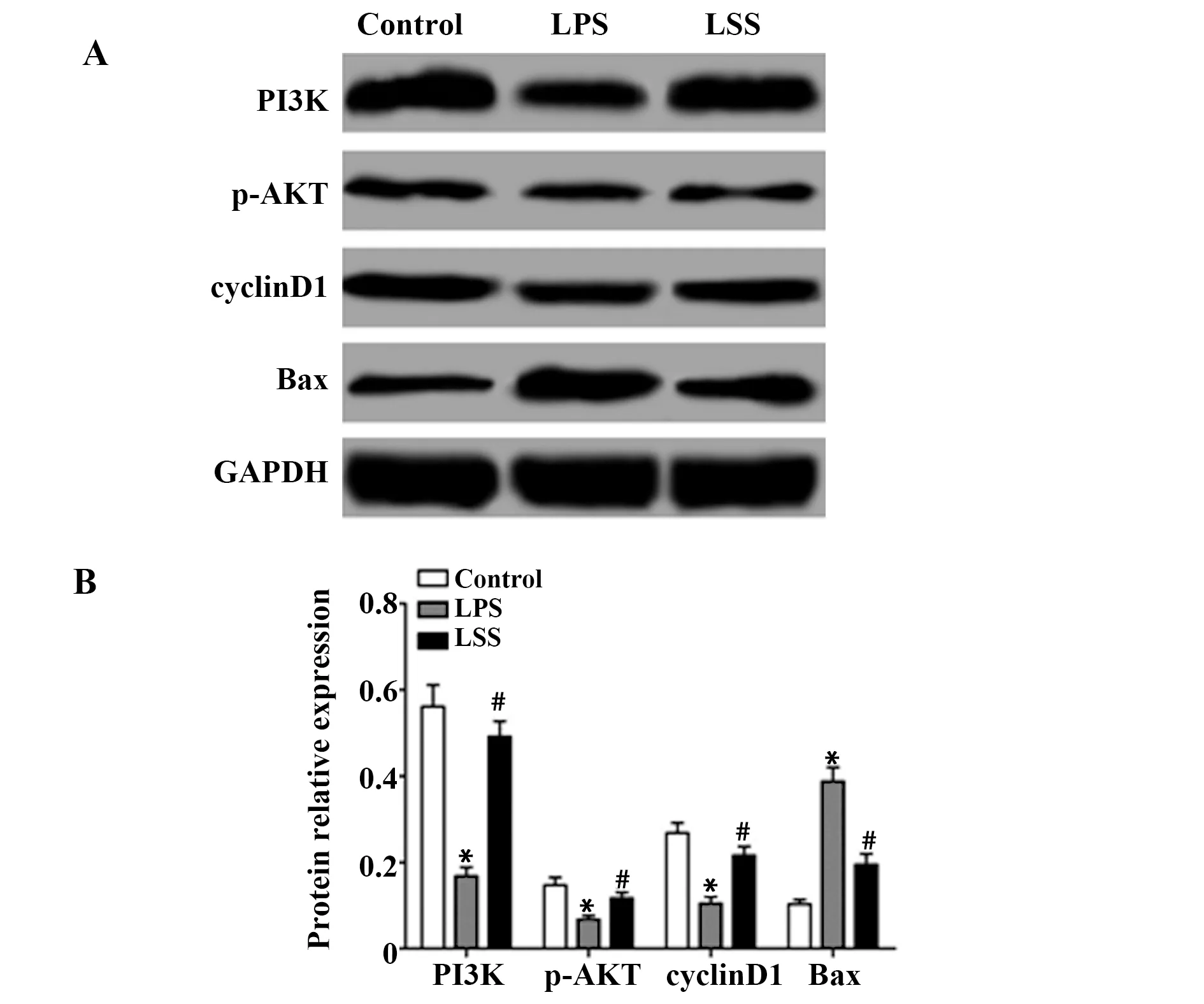
图6 LSS对LPS诱导的PC12细胞PI3K/AKT信号通路的影响Fig.6 Effect of LSS on PI3K/AKT signaling pathway induced by LPSNote: A.Protein expression electrophoresis;B.Relative expression of protein;*.P<0.05 vs Control group;#.P<0.05 vs LPS group.
2.6LSS对LPS诱导的PC12细胞PI3K/AKT信号通路的影响 通过Western blot检测各组细胞PI3K/AKT信号通路PI3K、p-AKT和下游cycyinD1、Bax的蛋白表达,结果如图6所示,对照组、LPS组和LSS组PI3K的蛋白表达分别为0.561±0.050、0.168±0.021、0.492±0.035,p-AKT的蛋白表达分别为0.147±0.018、0.068±0.009、0.117±0.013,cycyinD1的蛋白表达分别为0.268±0.024、0.105±0.015、0.216±0.021,Bax的蛋白表达分别为0.103±0.011、0.388±0.032、0.195±0.025,3组p-AKT、cycyinD1和Bax的蛋白表达比较差异具有统计学意义(Fp-AKT=95.122,Pp-AKT=0.000;FcycyinD1=50.234,PcycyinD1=0.000;FBax=107.575,PBax=0.000),LPS组细胞PI3K、p-AKT和cyclinD1的蛋白表达均明显低于对照组(P<0.05),Bax的蛋白表达高于对照组(P<0.05);而LSS组细胞PI3K、p-AKT和cycyinD1的蛋白表达均明显高于LPS组(P<0.05),Bax的蛋白表达低于LPS组(P<0.05)。
3 讨论
荔枝核是无患子科植物荔枝的干燥成熟种子,现代的药理学发现,其有抗氧化、改善胰岛素抵抗、降血糖等多种作用[6]。有研究显示,荔枝核的提取物可降低T2DM认知障碍大鼠高胰岛素血症和高血糖,从而改善由此引起的大鼠的学习和记忆障碍[7]。这提示荔枝核提取物在神经系统疾病治疗中发挥重要作用。LSS为荔枝核的一种提取物,有研究显示,LSS可对Aβ25-35诱导的AD大鼠海马神经元损伤起保护作用[3]。LPS为一种细菌内毒素,目前广泛用于NDD中神经元模型的建立[8]。PC12细胞为一种儿茶酚胺样细胞,作为一种体外的细胞模型,在神经系统疾病(如AD)、神经元发育分化、神经再生等发病机制方面具有广泛应用[9-11]。有研究发现,LPS可增加PC12细胞的毒性,诱导细胞凋亡[12]。本研究中试图证实LSS对LPS诱导的PC12细胞增殖、凋亡、免疫的影响。3.75~60 mg/L的LSS处理PC12细胞,细胞存活率检测发现,3.75 mg/L和7.5 mg/L的LSS对细胞存活率无影响,15~60 mg/L的 LSS均能显著降低PC12细胞存活率,这提示≥15 mg/L的LSS可能对PC12细胞产生毒性作用,因此本研究中选择3.75 mg/L的 LSS为研究对象。通过MTT及流式细胞仪分别检测LSS对LPS诱导的细胞存活率及凋亡的影响,发现LSS可明显提高由LPS引起的PC12细胞存活率降低,也降低细胞凋亡率。这提示LSS可降低由LPS引起的PC12细胞损伤。
氧化应激是体内的氧化还原反应失调而引起NO、H2O2等活性氧物质增多现象,其最终的归宿为细胞的坏死和凋亡。有研究表明,氧化应激可直接参与包括AD在内的多种NDD疾病的病理过程[13,14]。LPS可通过升高PC12细胞内ROS水平,诱导细胞发生凋亡,而降低ROS水平可抑制PC12凋亡[15]。本研究发现,LSS可降低由LPS诱导的ROS水平升高,这提示LSS对PC12凋亡的一个影响机制可能是降低ROS含量。HIF-1α和VEGF为两个免疫抑制因子,可发挥免疫抑制作用[16]。本研究结果显示,LSS可降低由LPS引起的HIF-1α和VEGF表达水平的升高,这提示LSS对PC12免疫的影响可能与降低HIF-1α和VEGF表达有关。PI3K/AKT信号通路对细胞增殖、迁移、物质代谢等多种生物学功能具有调控作用,也是神经元存活的一个主要途径[17]。其激活对于神经元保护发挥重要作用。如在I/R损伤模型中,激活PI3K/AKT信号可明显降低小脑损伤面积及神经元凋亡指数[18];激活PI3K/AKT可降低PC12损伤[19]。本研究检测结果显示,LSS可上调PI3K/AKT信号通路PI3K、p-AKT及下游细胞增殖相关蛋白cyclinD1表达,下调促凋亡蛋白Bax表达。这提示LSS对PC12细胞的损伤保护可能与PI3K/AKT信号通路的激活有关。综上所述,LSS可提高PC12细胞存活率、降低细胞凋亡、提高免疫,其机制与激活PI3K/AKT信号通路、提高细胞ROS水平及抑制HIF-1α和VEGF的表达有关。该研究可能为LSS在NDD中的作用研究奠定了一定基础,值得进一步深入探究。