膦甲酸钠对大鼠肝肾组织及相关生化病理指标的影响
2019-04-11温海燕宋金春
温海燕 宋金春
(武汉大学人民医院药学部,湖北省武汉市 430060,电子邮箱:wenhaiyan2000@126.com)
膦甲酸钠为非核苷类的抗病毒药物,可有效阻断病毒DNA复制,具有广谱抗病毒作用[1]。膦甲酸钠在临床上主要以注射液进行全身给药,常用于治疗艾滋病相关的巨细胞病毒感染、抗耐核苷类药物病毒等,疗效显著。膦甲酸钠在体内主要的毒性靶器官为肾脏,因此在临床抗病毒治疗过程中易产生肾毒性[2-5]。此外,肝脏也是药物代谢的一个重要器官。目前,尚无膦甲酸钠对肝肾功能影响的研究。本研究分析不同剂量膦甲酸钠对大鼠肝肾组织及相关生化病理指标的影响,为临床安全应用膦甲酸钠提供参考依据。
1 材料与方法
1.1 主要试剂 膦甲酸钠氯化钠注射液(批号:21707072-1;规格:3 g:250 ml)与膦甲酸钠原料药均由武汉大安制药有限公司生产(批号:1704261),无菌生理盐水,甲醇、乙腈(色谱纯),4%多聚甲醛溶液。
1.2 主要仪器 ADVIA 2400型全自动生化分析仪由西门子公司生产,Sorvall Fresco型微量台式离心机由德国贺利氏公司生产,YXJ-1型高速离心机由深圳天南海北实业有限公司生产,XW-80A型涡旋混合仪由上海医科大学仪器厂生产,TG328A型电子分析天平由上海天平仪器厂生产,ECLIPSE Ti-SR型倒置荧光显微镜由日本尼康公司生产,DS-U3型成像系统由日本尼康生产。
1.3 实验动物及分组 无特定病原体级SD大鼠40只由湖北省实验动物研究中心提供[湖北省实验动物质量合格证号:42000600025186;许可证号:SYXK(鄂)2015-0018],雌雄各半,体重(200±30)g。以标准饲料和饮用水喂养,室内温度为(23±2)℃,相对湿度为60%~70%,12 h交替照明。待适应环境后采用随机数字表法将大鼠分为对照组、低剂量组、中剂量组、高剂量组,每组10只。低剂量组、中剂量组、高剂量组大鼠分别给予腹腔注射300 mg/kg、600 mg/kg、900 mg/kg的膦甲酸钠注射液,对照组给予腹腔注射等体积生理盐水。每日上午10时称大鼠体重后,根据体重给予药物,连续注射2周。
1.4 观察指标
1.4.1 一般情况:在给药期间内观察动物的状况,包括毛发、粪便与尿液、行为动作、体重变化等。每天给药后称重计算当天的体重增长率,最终取2周体重增长率的平均值,体重增长率=(给药后的体重-未给药前的体重)/未给药前体重×100%。
1.4.2 尿液指标:给药2周后,用代谢笼收集大鼠24 h尿液,采用全自动生化分析仪测定尿总蛋白、尿肌酐指标,计算内生肌酐清除率(creatinine clearance,CCr),CCr=尿肌酐/血肌酐×每分钟的尿量(ml/min)。
1.4.3 血液指标:给药2周后,自大鼠心脏抽取全血3 ml后处死,置离心管中于室温静置1 h后,于3 500 r/min离心10 min,分离血清,用全自动生化分析仪检测血清ALT、AST、尿素氮、肌酐、TG及AKP浓度。
1.4.4 肝肾组织形态学改变情况: 大鼠处死后完整分离肝脏及双侧的肾脏组织,用生理盐水冲洗去除多余组织和污血,用纱布轻轻吸干多余水分后称量,根据脏器质量及大鼠体重数计算相应的脏器系数。脏器指数(%)=脏器重量(g)/大鼠体重(g)×100%。取大鼠肝脏的同一部位组织及同一侧的肾脏组织,用4%多聚甲醛进行固定,依次进行脱水、包埋、切片、脱蜡、苏木精-伊红(hematoxylin-eosin,HE)染色后,于光学显微镜下观察组织形态学变化。
1.5 统计学分析 采用SPSS 22.0软件进行统计分析。计量资料以(x±s)表示,组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况 给药期间,对照组及低剂量组大鼠一般情况良好,饮食、毛发、行为均正常,未出现死亡。中、高剂量组大鼠出现脱毛,每次给药后的2~3 h内出现四肢抽搐,精神状况差,食欲不振的现象,当日下午该现象基本消失。此外,高剂量组大鼠还存在腹泻,尿液变黄,消瘦等现象,其中中剂量组大鼠未出现死亡,高剂量组在后期给药过程中出现4只死亡,补入相应数量的大鼠继续进行给药满2周。
2.2 4组大鼠体重增长率及脏器指数比较 与对照组相比,低剂量组体重增长率和肝脏指数差异均无统计学意义(均P>0.05),但肾脏指数高(P<0.05);与对照组及低剂量组相比,中剂量组和高剂量组的体重增长率均低,而肝脏及肾脏指数均高(均P<0.05)。见表1。

表1 4组大鼠体重增长率及脏器指数比较(x±s,%)
注:与对照组比较,*P<0.05;与低剂量组比较,#P<0.05。
2.2 4组大鼠肝、肾病理组织形态改变 (1)正常对照组的大鼠肝脏结构完整清晰,肝细胞呈多面体型,肝细胞索排列清晰,从中央静脉向四周呈辐射状整齐排列,细胞核清晰可见,部分存在双核,内皮细胞扁平,环绕在中央静脉周围,血窦清晰,组织无肿胀坏死现象;低剂量组大鼠肝脏与对照组形态相似;而中、高剂量组大鼠肝细胞肿胀变大,细胞间界限模糊,肝细胞索排列趋于紊乱,血窦模糊,中央静脉变小。见图1。(2)对照组大鼠的肾脏结构完整,肾小球清晰无破损,肾小球囊腔大小均匀,肾小管刷边界正常;低剂量组大鼠的肾小球囊腔变大,肾小管排列形态发生改变,肾小管刷边界模糊;中、高剂量组大鼠的病变加重,肾脏结构完整性破坏,肾小管与肾小球排列紊乱,肾小管上皮细胞和肾小球细胞出现空泡样病变,肾小管囊腔面积很大,近曲小管上皮细胞发生脱落,肾脏结构严重受损。见图2。
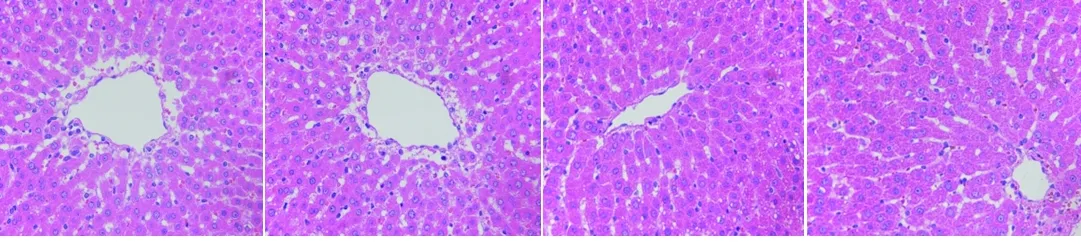
对照组 低剂量组 中剂量组 高剂量组
图1 4组大鼠肝脏病理组织切片(HE染色,×400)
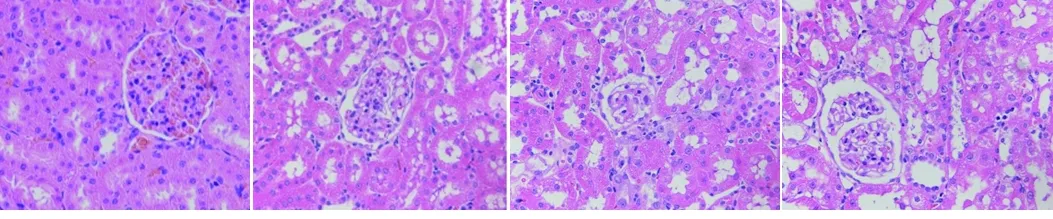
对照组 低剂量组 中剂量组 高剂量组
图2 4组大鼠肾脏病理组织切片(HE染色,×400)
2.3 4组大鼠肝肾功能相关指标比较 (1)肝功能:给药2周后,与对照组相比,低剂量组的AST及AKP均高(均P<0.05);与对照组及低剂量组相比,高、中剂量组的ALT、AST、AKP及TG水平均高(均P<0.05),见表2。(2)肾功能:与对照组相比,低高剂量组血尿素氮及肌酐、尿液总蛋白均高(均P<0.05),而尿肌酐以及CCr值均低(均P<0.05); 与对照组及低剂量组相比,中、高剂量组血尿素氮及肌酐、尿液总蛋白均高(均P<0.05),而尿肌酐以及CCr值均低(均P<0.05),见表3。

表2 4组大鼠给药后肝功能比较(x±s)
注:与对照组比较, *P<0.05;与低剂量组比较,#P<0.05。
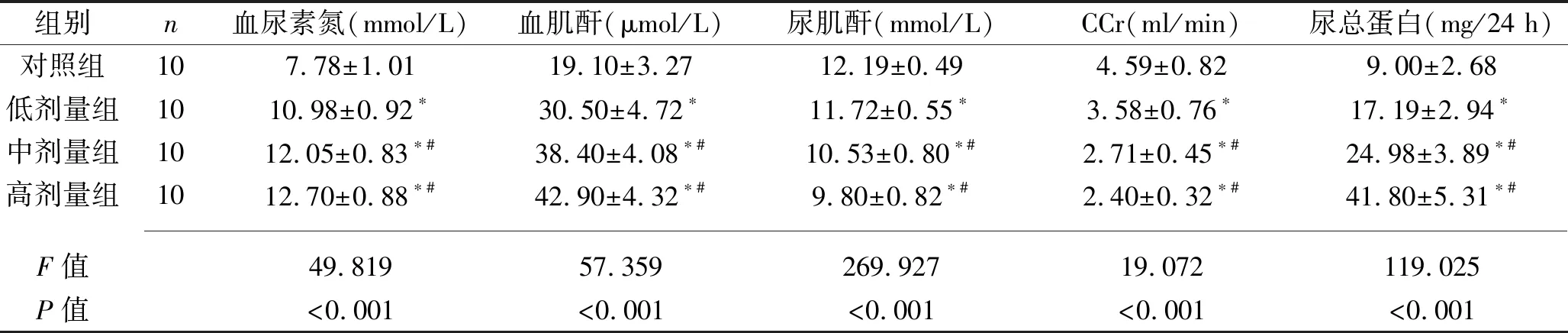
表3 4组大鼠给药后肾功能比较(x±s)
注:与对照组比较,*P<0.05;与低剂量组比较,#P<0.05。
3 讨 论
3.1 给药剂量的确定 参考文献[6-7]及膦甲酸钠的说明书,根据治疗疾病及患者状况对其剂量进行个体化调整。膦甲酸钠用于病毒感染诱导治疗的剂量为60 mg/kg,维持剂量为90~120 mg/kg,而用于皮肤感染治疗的剂量为40 mg/kg。根据人与大鼠等剂量之间的换算[8],成人的体重视为标准体重60 kg,成人剂量按皮肤感染治疗(40~60 mg/kg)的中间剂量,即50 mg/kg计算,将成人剂量与大鼠剂量按体表面积等效剂量进行换算得大鼠剂量为299 mg/kg,同时,为便于计算给药,按300 mg/kg给药,并设该剂量为低剂量。此外,根据膦甲酸钠的最大溶解度及大鼠腹腔注射的最大注射量,中、高剂量则分别设为低剂量的2、3倍,即600 mg/kg、900 mg/kg。
3.2 膦甲酸钠对大鼠体重增长率及脏器系数的影响 在给药期间,所有大鼠均给予常规的饮食饲养。对照组与低剂量组大鼠的体重增长稳定,而中剂量组大鼠的体重增长较慢,高剂量组大鼠体重则降低。功能正常的动物脏器与体重变化较为稳定,两者的比值即脏器指数也较为恒定[9]。当脏器受损后,可能会出现充血、水肿、组织异常肥大增生等,这使得脏器系数增大;而出现器官萎缩时,则脏器指数减小。本研究中,与对照组比较,中剂量组和高剂量组的体重增长率均低,而肝脏及肾脏指数均高(均P<0.05);低剂量组体重增长率和肝脏指数与对照组比较,差异均无统计学意义(均P>0.05),但肾脏指数高(P<0.05)。其原因可能为中、高剂量大鼠在给药过程中出现明显的腹泻,食欲不振的现象,体重变化大,使得脏器指数变大;另外,在给药后期,高剂量的大鼠出现4只死亡,解剖后发现其肝脏出现轻微肥大,肾脏颜色变白,出现异常水肿肥大现象,而其他组织正常,这也导致脏器指数变大。这表明中、高剂量的膦甲酸钠对大鼠肝脏和肾脏均具有损害作用,而低剂量组对肝脏无显著的损害作用,但对肾脏具有一定的损害。
3.3 膦甲酸钠对肝、肾功能及组织形态学的影响 当肝细胞受损时,存在于其中的ALT、AST会释放入血,导致其血液含量升高,两者是评价肝功能的常见指标[10]。AKP主要存在于肝、肾、骨骼等组织,通过肝脏向胆排出。当发生肝胆病变时,由于肝内胆道胆汁排泄障碍,肝细胞过度产生的AKP无法顺利排出而反流入血,导致血液中AKP含量升高。TG含量的变化可能与脂肪肝、高血脂等疾病有关[11]。肌酐与尿素含量的变化与肾功能密切相关,两者都主要通过肾小球滤过排出体外,当肾小球受损时,两者在血液中无法正常滤过导致含量升高。其中,血肌酐和尿肌酐的变化可通过CCr来反映,当CCr显著降低时,表明肾小球过滤功能受损。此外,在正常情况下,尿液中不含或仅含微量的蛋白,当肾脏受损时,导致尿蛋白无法重吸收,使得尿液中的蛋白含量上升。
本研究结果显示,与对照组相比,低剂量组部分肝功能指标高,但数值变化在合理范围之内,且肝脏系数无明显变化,组织理形态也较为完整,提示低剂量膦甲酸钠对肝脏的损害作用较小;中、高剂量组的ALT、AST、AKP及TG水平均高于对照组(均P<0.05),且大鼠肝脏的组织形态存在一定的破坏,但在病理组织图中肝脏纹路较为清晰,提示中、高剂量膦甲酸钠可损害肝脏,但损害作用较轻,该作用机制还待进一步研究。而与对照组相比,不同剂量组血尿素氮及肌酐、尿液总蛋白均高(均P<0.05),而尿肌酐以及CCr值均低(均P<0.05),肾小管和肾皮质均出现不同程度的破坏,其中中、高剂量组大鼠的肾脏结构严重受损,提示不同剂量膦甲酸钠均可损害肾脏,且较肝脏损害更为严重。这可能是由于高剂量的膦甲酸钠经肾脏排泄过程中产生结晶,从而造成肾脏损伤,但通常这种损伤都是可逆的,停药一段时间后恢复[12-13]。有研究表明,静脉注射一定量的生理盐水或饮用大量水可水化膦甲酸钠,明显降低肾毒性[14-15]。此外,与低剂量组相比,中、高剂量组ALT、AST、AKP、TG、血尿素氮及肌酐、尿液总蛋白均高(均P<0.05),而尿肌酐以及CCr
值均低(均P<0.05),提示随着剂量增大,膦甲酸钠对肝脏及肾脏的损害越显著。
综上所述,连续使用膦甲酸钠可损害肝肾功能,对肾脏的损害更严重,而中、高剂量膦甲酸钠的作用更为明显。在临床应用中,需个体化调整膦甲酸钠的给药剂量和疗程,最大限度地保证疗效和用药安全性,减少不良反应。
