反相高效液相色谱法测定枸杞干果及枸杞籽油中玉米黄质·β-胡萝卜素和叶黄素
2019-04-11马桂娟汤丽华王紫昕朱燕燕
马桂娟,朱 捷,汤丽华,谢 芳,王紫昕,朱燕燕
(宁夏回族自治区食品检测中心,宁夏银川 750001)
枸杞是药食同源的功能性特色植物资源,富含类胡萝卜素、黄酮类和枸杞多糖等生物活性物质,被广泛应用于保健食品行业[1-3]。超临界 CO2流体萃取的枸杞籽油,也富含类胡萝卜素、不饱和脂肪酸等成分,从其功能成分上分析,属于具有保健作用的油脂。目前的药理研究证实,枸杞子具有抗氧化、抗衰老、提高免疫力的作用[4],其活性成分如枸杞多糖、类胡萝卜素物质均有抗氧化作用。
叶黄素、β-胡萝卜素和玉米黄质是类胡萝卜素物质中最重要的物质之一,广泛分布于人体多个组织,对维持健康起到重要作用。玉米黄质和叶黄素具有预防光损伤和防治老年性黄斑衰退症的功能。β-胡萝卜素是一种重要的维生素 A 来源,通过摄入 β-胡萝卜素可以有效地对维生素 A进行补充[5]。因此准确测定枸杞干果和枸杞籽油中玉米黄质、β-胡萝卜素和叶黄素的含量,对于正确评价枸杞的营养价值和枸杞籽油功能性成分,开展营养学研究十分必要。高效液相色谱法是测定多种类胡萝卜素的方法,在不同的样品中已有相关研究报道[6-8]。但对枸杞干果及枸杞籽油中玉米黄质、β-胡萝卜素和叶黄素检验方法鲜见报道。笔者建立能同时测定枸杞干果及枸杞籽油中3种功能性成分的方法,能够为枸杞干果及枸杞籽油的质量控制和质量监督提供适用的技术依据,也为保障枸杞深加工产业快速发展奠定基础。
1 材料与方法
1.1试材枸杞购于宁夏中宁,枸杞籽油由枸杞籽经超临界 CO2流体萃取制得,样品于干燥避光处保存。玉米黄质(纯度≥95%),美国ChromaDex公司;β-胡萝卜素(纯度≥97%),德国Dr.Ehrenstorfer公司;叶黄素(纯度≥95%),北京曼哈格生物科技有限公司;环己烷(色谱纯)、甲基叔丁基醚(色谱纯)、正己烷(色谱纯)、二氯甲烷(色谱纯),赛默飞世尔科技有限公司;乙醚(色谱纯)、无水乙醇(色谱纯),天津科密欧化学试剂有限公司;二丁基羟基甲苯(BHT,优级纯)、氢氧化钾(优级纯)、无水硫酸钠(优级纯)、抗坏血酸(分析纯),国药集团化学试剂有限公司;所有用水均为超纯水。
1.2仪器Aglient 1260高效液相色谱仪,美国安捷伦公司;IKA KS 4000i恒温振荡器,德国IKA公司;BUCHI V-850旋转蒸发仪,瑞士步琦实验室公司;BS 224 S电子天平,赛多利斯科学仪器公司;均质器,德国IKA公司;UV-2700紫外可见分光光度计,日本岛津公司。
1.3标准溶液的配制分别准确称取适量玉米黄质、β-胡萝卜素、叶黄素标准品,用二氯甲烷配制成500 μg/mL的标准储备液(标准储备液使用前需校正);分别移取标准储备溶液适量,用0.1% BHT乙醇溶液稀释成100 μg/mL的混合标准中间溶液;准确移取混合标准中间溶液适量,用0.1% BHT乙醇溶液提取液稀释成系列标准工作溶液。
1.4标准溶液的标定由于标准品的来源、工艺的差异,加上标准品在存储过程中受到温度、氧化等因素的影响,在每次测定前都应对标准储备液进行浓度标定。同时不同来源的标准品在不同试剂中有不同的比吸光系数,标定时应根据标准物质证书选择各自的比吸光系数[9]。
玉米黄质、β-胡萝卜素及叶黄素标准储备液在配制后,在使用前需要对其浓度进行校正,具体操作如下:取玉米黄质标准储备液(浓度约为500 μg/mL)20 μL,用10.0 mL甲醇稀释,混匀;采用1 cm比色杯,以甲醇为空白参比,测定其吸光度。取β-胡萝卜素标准储备液(浓度约为500 μg/mL)20 μL,用10.0 mL正己烷稀释,混匀;采用1 cm比色杯,以正己烷为空白参比,测定其吸光度。取叶黄素标准储备液(浓度约为500 μg/mL)20 μL,用10.0 mL无水乙醇稀释,混匀;采用1 cm比色杯,以无水乙醇为空白参比,测定其吸光度。试液中玉米黄质、β-胡萝卜素及叶黄素的浓度按公式计算:X=(A×10.02)/(E×0.02),式中,X为标准储备液的浓度,A为标准储备液的吸光度。
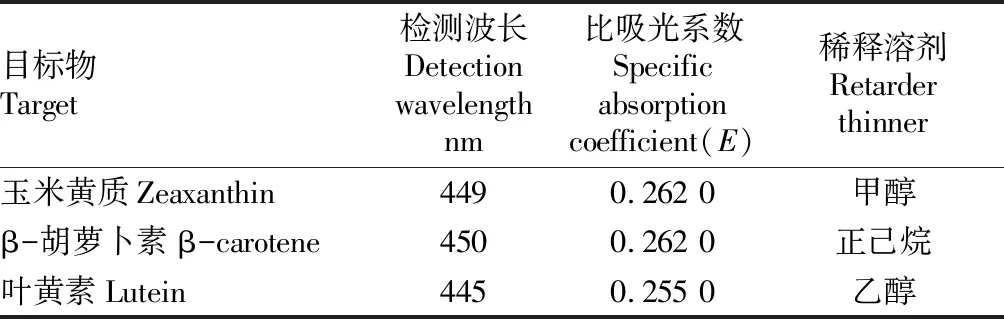
表1 测定波长及比吸光系数
1.5样品前处理
1.5.1试样制备。称取200 g枸杞样品加入400 g水,用均质器打浆后备用,枸杞籽油样品用前振摇或搅拌混匀。
1.5.2试样皂化。枸杞样品称取2 g(精确至0.1 mg),置于100 mL 具塞离心管中,加入1 g抗坏血酸、0.2 g BHT和30 mL无水乙醇,于(70±1)℃恒温振荡30 min,再加入10 mL氢氧化钾溶液,边加边振摇,盖上瓶塞。置于已预热至(54±2)℃恒温振荡箱中,皂化45 min。皂化后立即用冷水冷却至室温。
枸杞籽油试样:准确称取2 g(精确至0.1 mg),置于250 mL锥形瓶中,加入1 g抗坏血酸、0.2 g BHT和 30 mL无水乙醇。加入30 mL氢氧化钾溶液,边加边振摇,盖上瓶塞,置于已预热至(54±2)℃恒温振荡箱中,皂化45 min。皂化后立即用冷水冷却至室温。
1.5.3试样萃取。将皂化液转入250 mL分液漏斗中,加入60 mL萃取溶剂(1 g BHT,以200 mL环己烷溶解,加入400 mL乙醚和400 mL正己烷),轻轻摇动,排气,盖好瓶塞,室温下振荡10 min后静置分层,将水相转入另一分液漏斗中按上述方法进行第2次提取。合并有机相,用50 mL水洗有机相5~6次,直至水洗近中性。弃水相,有机相通过无水硫酸钠过滤脱水。滤液收入250 mL蒸发瓶中,于旋转蒸发仪上(40±2)℃减压浓缩至近干(不能蒸干)。用0.1% BHT乙醇溶液,充分溶解提取物并定容至10 mL。经0.45 μm滤膜过滤后供液相色谱仪分析。
1.6液相色谱条件色谱柱为C30色谱柱,250 mm×4.6 mm(内径),粒径5 μm;进样量50 μL;柱温30.0 ℃;流速1.0 mL/min;检测波长445 nm。流动相A为甲醇∶水(88∶12,V/V,含0.1% BHT),B为甲基叔丁基醚(含0.1% BHT)。梯度洗脱条件见表2。
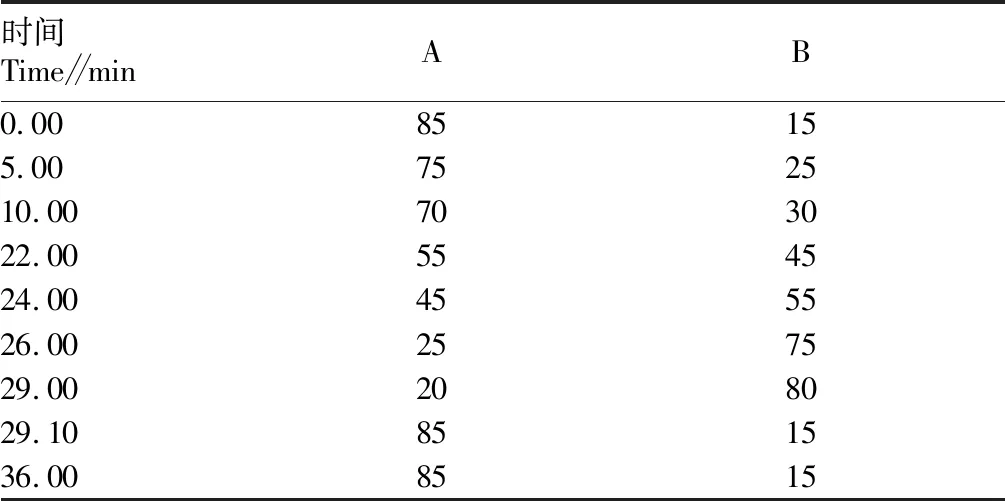
表2 流动相梯度洗脱程序
2 结果与分析
2.1检测波长的选择通过对10 μg/mL的叶黄素、玉米黄质及β-胡萝卜素标准溶液进行200~600 nm的光谱扫描,结果发现,叶黄素在445 nm有最大吸收(图1a);玉米黄质在450 nm有最大吸收(图1b);β-胡萝卜素在450 nm有最大吸收(图1c)。因此,该方法选择445 nm为检测波长。
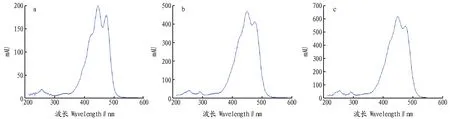
图1 叶黄素(a)、玉米黄质(b)、β-胡萝卜素(c)对照品全波长扫描曲线Fig.1 Spectrophotomentry chromatogram of standard of lutein(a),zeaxanthin(b)and β-carotene(c)
2.2流动相的确定根据玉米黄质、β-胡萝卜素及叶黄素的化学性质,参考GB5009.248—2016《食品中叶黄素的测定》[10]中色谱条件,该研究采用YMC C30(4.6 mm×250 mm,5 μm)色谱柱,以含0.1%BHT甲醇-水(88∶12)作为A相,含0.1%BHT甲基叔丁基醚作为B相,分离枸杞及枸杞籽油中3种类胡萝卜素物质,叶黄素、玉米黄质和β-胡萝卜素混合标准溶液色谱图见图2。
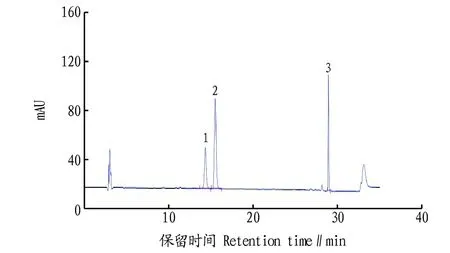
注:1.叶黄素;2.玉米黄质;3.β-胡萝卜素Note:1.Lutein;2.Zeaxanthin;3.β-carotene图2 叶黄素、玉米黄质和β-胡萝卜素混合标准溶液色谱图Fig.2 Chromatograms for zeaxanthin,β-carotene and lutein
2.3提取方式的确定枸杞子含有大量多糖成分,粉碎易结块,枸杞复水匀浆处理,可使枸杞中部分糖分溶解。同时对于枸杞植物细胞壁较厚的样品,在试样中先加入乙醇于60~80 ℃回流后再提取,可提高提取效果[9]。因此该研究将枸杞样品于70 ℃乙醇溶液中回流之后再皂化。
皂化是类胡萝卜素前处理的一个重要的环节。对于枸杞籽油脂肪成分过高的油脂样品,可采用皂化方式提纯净化;此外枸杞中大部分类胡萝卜素以酯化形式存在[11-12],皂化可使枸杞类胡萝卜素酯成为游离态的类胡萝卜素,这样可以简化色谱的分离。但由于类胡萝卜素对光、热、氧不稳定,在提取过程可通入氮气,加入抗坏血酸和BHT等抗氧化剂起到保护作用。
采用乙醚、乙醚-石油醚、乙醚-正己烷-环己烷为提取溶剂进行液液萃取对比试验,其中用乙醚、乙醚-石油醚为提取溶剂时,叶黄素的回收率仅为20%~30%,而用乙醚-正己烷-环己烷为提取溶剂,3种物质的提取效果回收率最高。因此将乙醚-正己烷-环己烷作为提取试剂。
2.4线性范围和检测限在选定的仪器条件下进行色谱分析,每个浓度点重复测定 3 次,测得峰面积平均值对浓度绘制标准曲线。从表3可看出,玉米黄质、β-胡萝卜素及叶黄素在其相应的线性范围表现出良好的线性关系。

表3 3种类胡萝卜素的线性回归方程、相关系数、线性范围及检出限
2.5回收率与精密度精密称取枸杞籽油、枸杞样品各6份,每份样品中分别加入3种标准物质,按“1.5”操作方法进行处理,并与标准溶液同时进行测定,结果发现(表4),回收率为70%~120%,相对标准偏差(RSD)小于 10%,可以满足日常监测中3种类胡萝卜素分析的准确度与精密度要求。
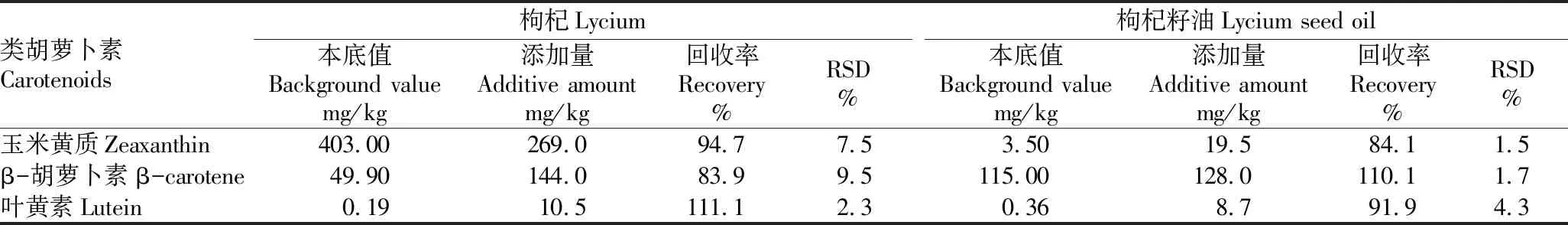
表4 枸杞和枸杞籽油中3种类胡萝卜素的回收率和精密度试验(n=6)
3 结论
该研究建立了高效液相色谱法同时测定枸杞干果及枸杞籽油中玉米黄质、β-胡萝卜素和叶黄素的检验方法。该方法前处理操作简单、皂化时间短、净化效果好,能够满足枸杞干果及枸杞籽油中3种类胡萝卜素的定性和定量分析,可用于实际样品的分析。
