14-3-3ζ和p-Bad在Lewis肺癌细胞株中的表达及意义
2019-04-11梁帅熊茂林王宇彤李福智侯阳
梁帅 熊茂林 王宇彤 李福智 侯阳
(锦州医科大学 1基础医学院,辽宁 锦州 121001;2附属第三医院;3生命科学研究院)
肺癌发生与吸烟、环境污染及遗传等密切相关,伴随多种癌基因过度表达及肿瘤抑制基因失活〔1〕。肺癌起病隐匿,进展迅猛,早期发现难,术后复发率高,现有放化疗药物治疗效果差,5年存活率只有15%~20%〔1〕。树突细胞(DC)具有免疫激活和诱导免疫耐受的生物学特性,在抗感染免疫、移植免疫、肿瘤免疫等方面意义重大。细胞因子诱导的杀伤(CIK)细胞不是一种单一的细胞群,而是几种细胞混合的异质细胞群。作为一种新型、高效的主要组织相容性复合体(MHC),CIK 细胞参与内源性抗原提呈、诱导对病毒感染细胞和肿瘤细胞的杀伤和溶解,因而作为非限制性免疫活性细胞得到了广泛应用。近年研究表明,磷酸化(p)-Bad在多种细胞中表达,可通过参与某些细胞信号转导通路影响细胞凋亡的全过程。本实验初步探DC调节的细胞因子诱导的杀伤细胞(DC-CIK细胞)对Lewis肺癌细胞的抑制作用及机制。
1 资料和方法
1.1细胞及试剂 Lewis肺癌细胞株由锦州医科大学高校分子细胞生物学与新药开发重点实验室苏荣健博士惠赠。DC-CIK细胞取自健康者外周血单个核细胞进行制备,用于实验研究。噻唑蓝(MTT),Sigma公司;胎牛血清(FBS)、DMEM培养基,GIBCO公司; p-Bad兔多克隆抗体、14-3-3ζ兔多克隆抗体,Santa Cruz公司。
1.2方法 从液氮中取出冻存的Lewis肺癌细胞株,复苏后使用。常规方法复苏后将Lewis细胞转入培养瓶中,贴壁生长者为存活细胞,按照1∶2~1∶4进行传代培养,至对数生长后即可用于实验。严格按照文献要求的步骤进行CIK细胞的体外培养〔2〕。第14天收获细胞。用无血清的RPMI1640培养液重悬制备DC,第0天加入粒-巨集落刺激因子〔含1 000 U/ml的重组人粒细胞-巨噬细胞集落刺激因子(rhGM-CSF)、500 U/ml的白细胞介素(IL)-4〕。每隔2~3 d换新鲜细胞培养液1次,并补加细胞因子,并加入rhTNF-α(200 U/ml),诱导DCs成熟。将DC、CIK细胞共培养,在第8天将收获的细胞按1∶5混合培养,共培养3 d。
1.3DC-CIK细胞与Lewis肺癌细胞株共培养体系的建立 利用Transwell培养板建立共培养体系。实验分四组,分别为DC-CIK组、CIK组、磷酸盐缓冲液(PBS)组和正常对照组。在Transwell系统上层小室中分别加入DC-CIK细胞、CIK细胞和PBS,另一组不加任何成分;下室加入Lewis肺癌细胞作为靶细胞建立共培养体系。置于5%CO2孵箱、37℃条件下培养。在3、5、7 d镜下观察细胞形态。
1.4检测指标及方法 MTT比色法检测Lewis肺癌细胞活力。细胞存活率=实验组A值/正常对照组A值×100%。
1.5Western印迹检测Lewis肺癌细胞中14-3-3ζ、p-Bad蛋白表达变化 严格按试剂盒说明操作。
1.6统计学方法 用SPSS17.0软件行单因素方差分析。
2 结 果
2.1DC及CIK细胞形态学观察 在400光镜下DC呈贴壁生长,散在分布,也有成簇聚团生长,表面伸出毛刺状不规则突起,具有DC典型的树突形状特征。CIK细胞在200倍光镜下细胞体积增大,胞核增大,胞质增多,部分细胞集落生长。
2.2共培养后CIK组、DC-CIK组Lewis肺癌细胞形态光镜观察 3 d时各组Lewis肺癌细胞没有显著改变,细胞轮廓清晰。5 d时CIK组Lewis肺癌细胞状态优于DC-CIK组;DC-CIK组可见细胞膨胀,胞质崩解,释放之后细胞萎缩,细胞间隙增大。7 d时CIK组出现突起萎缩,细胞间隙继续增大;DC-CIK组部分细胞出现死亡,可见死亡的细胞斑片,细胞形态改变较大,体积明显缩小并与周围细胞脱离,细胞间连接消失。
2.3各组Lewis肺癌细胞存活率 DC-CIK组细胞存活率〔(69.45±1.34)%〕明显低于CIK组〔(79.23±1.22)%〕、PBS组〔(95.52±0.22)%〕和正常对照组〔(100.00±0.00)%〕,差异均有显著性(P<0.01)。
2.4Western印迹检测14-3-3ζ、p-Bad蛋白的表达 以Transwell培养板共培养7 d,Lewis肺癌细胞中14-3-3ζ、p-Bad的表达均降低。见图1,2。
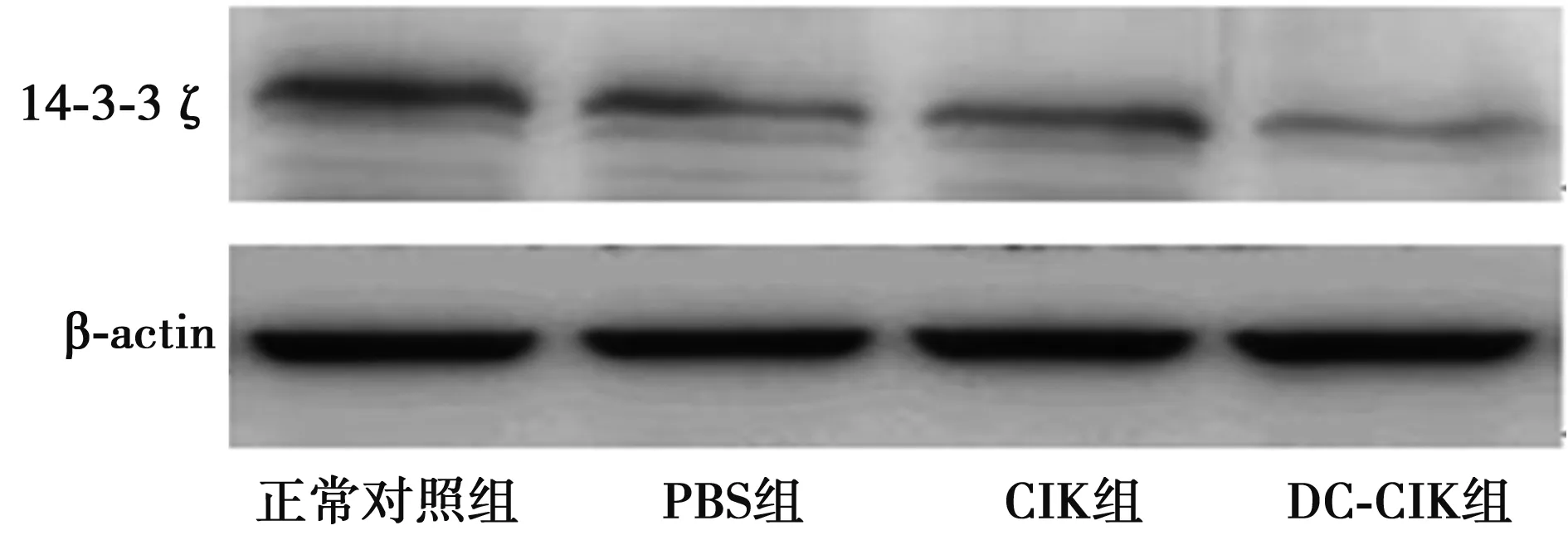
图1 Western印迹检测Lewis肺癌细胞中14-3-3ζ蛋白表达
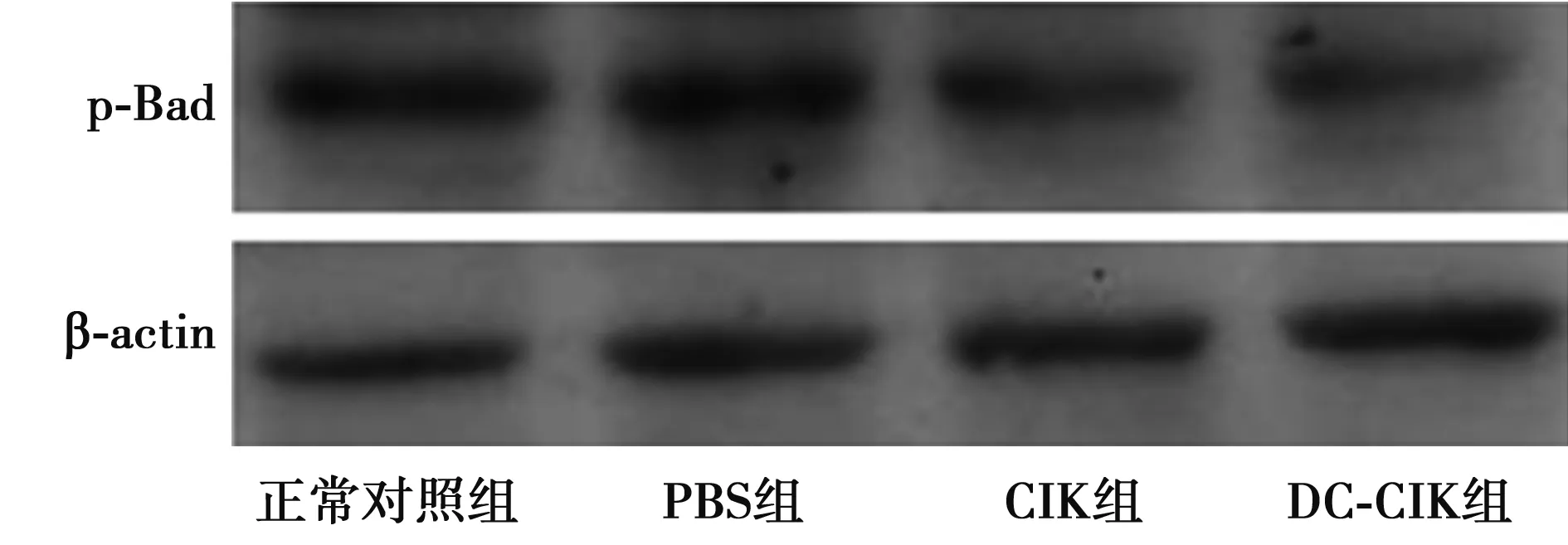
图2 Western印迹检测Lewis肺癌细胞中p-Bad蛋白表达
3 讨 论
肺癌是严重威胁人类健康的疾病之一,其恶性程度高、预后差,已经成为各种癌症中导致死亡的主要原因〔3〕。肺癌的病因尚不明确,无法达到病因治疗。手术切除是目前主要的治疗方式,结合放疗、化疗等综合治疗可提高病人的5年生存率。但放疗、化疗等治疗方式存在有效率的问题,未能做到所有患者均受益。因此,采用免疫治疗在内的多学科联合治疗,才有望达到彻底消灭肿瘤细胞或者带瘤生存的理想状态。多项研究〔4,5〕报道,DC疫苗、化疗和CIK细胞三者联合治疗肿瘤已经取得了一定成就,这有可能成为未来肺癌治疗的新趋势。因此,本文建立共培养体系将DC-CIK细胞与Lewis 肺癌细胞株共同培养,初步探讨DC-CIK细胞对Lewis肺癌细胞抑制增殖和诱导凋亡的作用机制。本研究表明,DC-CIK细胞能够降低体外培养Lewis肺癌细胞的存活率,且其作用比单纯应用CIK细胞明显增强。凋亡是细胞的程序化死亡过程。一般认为,正是由于凋亡受到抑制,才导致细胞出现异常增殖而发展为肿瘤细胞。因此,关于细胞凋亡与肿瘤关系的研究是目前肿瘤发生、发展机制研究的热点。本文利用Western印迹方法检测了Lewis肺癌细胞中14-3-3ζ蛋白含量的变化,发现DC-CIK组14-3-3ζ蛋白含量明显低于其他组,表明DC-CIK细胞可以降低体外培养Lewis肺癌细胞中14-3-3ζ蛋白的表达。本文还检测了另外一个凋亡相关因子p-Bad在Lewis肺癌细胞中的表达,发现DC-CIK组p-Bad蛋白含量也明显低于其他各组。抗肿瘤免疫以细胞免疫为主,其中具有免疫记忆功能和特异性杀伤作用这一从基因水平上证实肿瘤特异性抗原的存在。DC细胞具有免疫激活和诱导免疫耐受的生物学特性,在抗感染免疫、移植免疫、肿瘤免疫等方面意义重大。CIK细胞不是一种单一的细胞群,而是几种细胞混合的异质细胞群。作为一种新型、高效的主要组织相容性复合体(MHC),CIK 细胞参与内源性抗原的提呈,诱导对病毒感染细胞和肿瘤细胞的杀伤和溶解,因而作为非限制性的免疫活性得到应用。抗体参与的体液免疫不是抗肿瘤免疫的重要因素,有时甚至能促进肿瘤的生长。2006年世界卫生组织(WHO)对外宣布,肿瘤生物治疗(生物细胞免疫治疗)有望彻底消灭肿瘤细胞,最终实现“带瘤生存”的理想状况。普遍的观点认为肿瘤是一种全身性疾病而不是局部病变,只是表现在局部某个脏器而已,多学科综合治疗已广泛应用于临床,化疗辅助中药、微创及免疫治疗是中晚期肿瘤治疗的主要方法。
综上所述,笔者认为DC-CIK细胞可以降低Lewis肺癌细胞的存活率,促进Lewis肺癌细胞凋亡,这或许能为非小细胞肺癌的治疗提供一个新的思路。但是前述结果是在体外实验中得到的,在动物模型及人体中是否能够取得同样的结果还需要进一步研究才能明确。此外,关于DC-CIK细胞降低Lewis肺癌细胞存活率并促进其凋亡的具体机制尚不明确,有待于在今后的工作中深入研究。
