SATB2与miR-31、182对结直肠癌的靶向调控
2019-04-11杨洲刚海菊覃先蓬贾贵清周晓刚赵高平高本领
杨洲 刚海菊 覃先蓬 贾贵清 周晓刚 赵高平 高本领
(1四川省人民医院胃肠外科,四川 成都 610000;2成都市职业技术学院医护分院护理教研室;3广元市苍溪县中医院)
结直肠癌是消化系统一种常见的恶性肿瘤,是世界上仅次于肺癌和乳腺癌的第3大常见肿瘤〔1,2〕。不论早期或晚期,结直肠癌的临床症状均不明显或不典型,因而容易被患者及临床医生所忽略,一旦确诊多为晚期,错过治疗的最佳时机,患者多呈现转移或手术切除易复发致死〔3〕。如何早诊断及早治疗是结直肠癌的解决关键。随着分子生物学发展,人们对结直肠癌的研究焦点转移到基因层面。微小核糖核酸(miRNAs)是与肿瘤发生发展密切的一类小分子RNA,属于非编码的单链小分子RNA,主要参与基因转录后水平的调控〔4〕。miRNAs与肿瘤关系的研究主要在以下几方面:①miRNAs主要位于基因组不稳定区域及癌相关区域;②miRNAs在正常细胞和恶性肿瘤细胞中的表达不同,几乎所有的恶性肿瘤均呈异常表达。研究表明,miRNAs中既有致癌基因也有抑癌基因,通过参与调控细胞周期从而引发肿瘤〔5,6〕。另外,文献显示特定富含AT碱基DNA序列结合蛋白(SATB)2的低表达与结直肠癌的发生、发展及转移紧密相关〔7,8〕。但关于结直肠癌中靶向调控SATB2的miRNAs研究和报道还较少。本研究主要分析结直肠癌发生、发展及转移与靶向调控SATB2的相关miRNAs的内在联系,为结直肠癌的防治提供参考。
1 材料与方法
1.1实验对象 收集四川省人民医院病理科2015年9~10月收集的所有手术切除的结直肠标本,病检确诊为结直肠癌的标本6例为实验组,正常结直肠标本6例为对照组。从距离标本中心≤1 cm的组织提取RNA,制作成12株细胞株,保存于-80℃冰箱。两组标本的性别、年龄和体重指数等参数差异无统计学意义(P>0.05)。BALB/C 裸鼠,雌雄各半,购自上海肿瘤研究所动物实验中心,动物质量合格证号:0024556。结直肠癌细胞系SW480均购自上海素尔生物科技有限公司。
1.2实验仪器与试剂 TDM荧光偏振免疫自动分析仪(上海金鹏分析仪有限公司),ABI7300荧光定量PCR仪上海智岩科学仪器有限公司,LT-16alpha 恒温扩增基因检测系统仪(北京蓝谱生物科技有限公司)。CCK8(日本同仁化学公司),其余试剂均由强森科技提供。SATB2单克隆抗体(美国ABI公司),Trizol(美国Invitrogen公司),PrimeScript RT reagent Kit试剂盒(美国Promega公司)和TaqMan@MicroRNA Assay试剂盒(美国ABI公司),RPMI1640培养基和胎牛血清(美国Invitrogen公司)。
1.3研究方法
1.3.1筛选靶向调控SATB2候选miRNAs 利用miRBase、TargetScan和PicTar 3个常用的miRNA靶基因,结合miRNAs的芯片结果,使用预测数据库进行数据分析,在靶向调控SATB2基因结直肠区域的12株细胞株中选择候选miRNAs。
1.3.2测定候选miRNA表达 利用RT-PCR技术和荧光原位杂交技术,测定结直肠癌细胞系、结直肠癌组织及正常结直肠组织及细胞中miRNA表达。
1.3.3检测miRNAs对调控结直肠癌转移相关基因SATB2的靶效性 根据候选miRNAs预测结果,构建SATB2基因3′UTR突变性和野生型荧光素酶载体,与miRNA抑制物转染、报告基因检测和miRNA模拟物等技术手段相结合,检验候选miRNA是否对SATB2基因表达有靶向调控作用,确定miRNAs对调控结直肠癌转移相关基因SATB2的靶效性。
1.3.4平板克隆实验 慢病毒感染结直肠癌细胞SW480得到稳定过表达miR-31和miR-182的结直肠癌细胞株SW480/miR-31和SW480/ miR-182,以共同的空白细胞为对照SW480/Con。取细胞株,采用0.25%胰蛋白酶进行消化吹打成单个细胞并置于10%的胎牛血清的RPMI1640培养液中,稀释、接种于培养皿中,培养2~3 w,当可通过肉眼观察到培养皿中的克隆时,培养停止。弃上清液、浸洗并染色,放置在带网格的透明胶片,对>10个细胞的克隆数通过显微镜进行计数,计算克隆形成率。
1.3.5细胞周期检测 将SW480/miR-31、SW480/miR-182和对照SW480/Con细胞株消化成单个细胞悬液,离心、弃上清,浸洗、沉淀,于4℃固定24 h,离心、浸洗,加入500 μl磷酸盐缓冲液(PBS)含50 μg/ml溴化啶(PI)、100 μg/ml RNaseA、0.2%TritonX-100,避光孵育30 min上机。
1.3.6荧光素酶活性检测 根据构建的基因检测系统,即突变型SATB2基因3′UTR系统,检测转染miR-31和miR-182后细胞内荧光素酶的活性。
1.3.7测定SATB2的逆转作用 SATB2基因转染后,采用CCK8增殖实验检测降低miR-31及miR-182表达的细胞体外增殖能力。慢病毒感染结直肠癌细胞SW480得到稳定过表达miR-31和miR-182的结直肠癌细胞株SW480/miR-31和W480/ miR-182,以共同的空白细胞为对照SW480/Con。采用CCK8试剂盒法,收集SW480/miR-31和SW480/miR-182细胞及SW480/Con的细胞种植于96孔板中,待细胞贴壁后(4~12 h)加药,5%CO2,37℃孵育12 h,每孔中加入10 μl CCK8溶液,培养4 h,酶联免疫检测仪分析。
1.3.8细胞周期 SATB2基因转染后,采用流式细胞仪检测DLD1/miR-31和SW480/miR-31细胞的周期。
1.3.9运动能力 SATB2转染后,采用划痕实验检测细胞的运动能力。
1.3.10裸鼠成瘤实验 取皮下瘤组织进盲肠原位移植于裸鼠皮下,作为实验组,对照组皮下注射生理盐水,分别为6只/组,2 w后处死,测定瘤的最大直径和重量,采用免疫组化法检测瘤体的miR-31和miR-182的表达情况。
1.4统计学分析 采用SPSS19.0软件进行单因素方差分析、t检验。
2 结 果
2.1候选miRNA筛选 预测SW480细胞的miRNA表达谱和靶向调控SATB2基因的miRNAs生物信息学结果并进行分析,与SATB23′UTR的保守区相比较,SW480细胞的miR-182(0.8±0.2 vs 0.4±0.2,t=3.464,P=0.018)、miR-26(0.9±0.3 vs 0.5±0.2,t=2.717,P=0.042)及miR-31(0.9±0.2 vs 0.3±0.2,t=5.196,P=0.003)表达水平升高明显。导入miR-31和miR-182模拟物后,降低SW480细胞内SATB2表达水平(1.2±0.3 vs 0.8±0.2,t=2.717,P=0.042,n=6;0.9±0.2 vs 0.5±0.2,t=3.464,P=0.018,n=6),而将其抑制物导入后,可明显增加SW480细胞中的SATB2表达(1.2±0.3 vs 1.7±0.3,t=2.887,P=0.034,n=6;0.9±0.2 vs 1.5±0.4,t=3.286,P=0.022,n=6)。将miR-27b的抑制物和模拟物导入,SW480细胞内SATB2表达无明显改变(1.2±0.3 vs 1.0±0.3,t=1.155,P=0.300,n=6;0.9±0.2 vs 0.7±0.2,t=1.732,P=0.144,n=6;1.2±0.3 vs 0.9±0.3,t=1.732,P=0.144,n=6;0.9±0.2 vs 0.6±0.3,t=2.038,P=0.097,n=6),因此miR-31和miR-182是本次实验考察调控SATB2候选miRNAs。
2.2结直肠组织miR-31和miR-182的表达差异 与对照组比较,实验组癌组织中miR-182和miR-3表达明显偏高(2.8±0.9 vs 0.3±0.2,t=6.642,P=0.000,n=6;2.4±0.5 vs 0.5±0.3,t=7.982,P=0.000,n=6)。实验组中3例无淋巴转移,3例淋巴转移,与无淋巴转移相比,有淋巴转移的癌组织中miR-31和miR-182表达明显高偏高 (4.5±1.0 vs 1.1±0.8,t=4.599,P=0.044,n=3;4.1±1.1 vs 0.7±0.6,t=4.700,P=0.042,n=3)。
2.3SW480/miR-31和SW480/miR-182细胞增殖能力 SW480/miR-31和SW480/miR-182细胞的增殖能力〔(1.6±0.4)%,(1.5±0.4)%,n=6〕明显高于对照SW480/Con〔(0.9±0.4)%,n=6,t=3.429,P=0.019;t=2.598,P=0.048〕。实验组细胞增殖可见图1。

图1 增殖状态下的SW480/miR-31细胞
2.4SW480/miR-31和SW480/miR-182的平板克隆实验 SW480/miR-31〔(4.3±1.2)%〕和SW480/miR-182细胞〔(4.0±1.1)%〕形成的克隆较对照SW480/Con细胞多〔(2.1±1.0)%,t=3.450,P=0.018;t=3.131,P=0.026,n=6〕,见图2。
2.5SW480/miR-31和SW480/miR-182的细胞周期 与SW480/Con细胞G0/G1期(76.17%)、S期(14.36%)及G2/M期(9.47%)比较,SW480/miR-31,停留在G0/G1期的细胞减少(64.15%),S期的细胞增多(24.60%),G2/M期细胞增多(11.25%),SW480/miR-182,G0/G1期(62.17%)的细胞减少,S期(24.38%)细胞增多,G2/M期(13.45%)细胞增多。
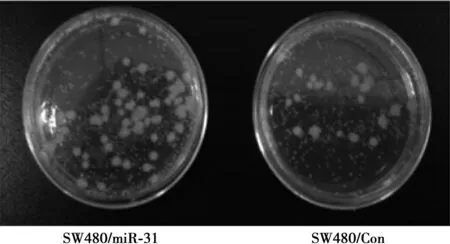
图2 SW480/miR-31和SW480/Con细胞克隆数比较
2.6SW480/miR-31和SW480/miR-182的荧光素酶活性 与对照SW480/Con细胞比较,SW480/miR-31和SW480/miR-182的细胞内荧光素酶的活性(3.4±0.8 vs 1.5±0.5,t=4.933,P=0.004,n=6;2.7±0.6 vs 1.6±0.4,t=3.737,P=0.013,n=6)明显降低,SATB2的表达(2.4±1.0 vs 0.9±0.5,t=3.286,P=0.022,n=6;2.5±1.1 vs 0.7±0.4,t=3.767,P=0.013,n=6)降低。
2.7SATB2的逆转 SATB2基因转染后,miR-31和miR-182细胞体外增殖能力均明显降低〔(1.5±0.5)% vs (0.7±0.3)%,t=3.361,P=0.020,n=6;(1.6±0.5)% vs (0.8±0.4)%,t=3.060,P=0.028,n=6〕。
2.8SATB2基因转染后细胞周期 与SW480/Con细胞G0/G1期(36.45%)、S期(27.95%)、G2/M期(20.14%)比较,SATB2基因转染后,SW480/miR-31和SW480/miR-182细胞进入G0/G1期(75.16%、76.45%)增多,S期(11.35%、18.36%)细胞减少,G2/M期(13.48%、5.19%)细胞减少。
2.9运动能力 SATB2转染后,SW480/miR-31和SW480/miR-182细胞的运动能力明显降低〔(3.7±1.0)cm vs (1.8±0.6)cm,t=3.991,P=0.010,n=6;(3.6±1.2)cm vs (1.5±0.7)cm,t=3.703,P=0.014,n=6〕。
2.10裸鼠成瘤实验结果 与对照组比,实验组裸鼠的瘤体积和瘤重量均明显增高〔(23.1±3.8)mm3vs (146.5±17.8)mm3,t=16.607,P=0.000,n=6;(1.0±0.3)g vs (2.9±0.5)g,t=7.982,P=0.000,n=6〕。
2.11裸鼠成瘤的miR-31和miR-182表达结果 与对照组比,实验组瘤的miR-31和miR-182表达均明显增高(1.2±0.6 vs 3.9±0.9,t=6.114,P=0.001,n=6;1.0±0.4 vs 2.8±0.6,t=6.114,P=0.002,n=6),见图3。实验组裸鼠体内出现大量肿瘤转移现象,淋巴转移、肺转移、腹腔转移及肝转移,对照组裸鼠无转移病灶。

A和B:实验组的miR-31和miR-182;D和E:对照组的miR-31和miR-182图3 裸鼠成瘤皮下miR-31和miR-182表达(×100)
3 讨 论
结肠镜检查和粪便隐血试验是结直肠癌主要的两种筛查方法〔9〕。结肠镜检查是结直肠癌诊断的金指标,可在镜下摘除病理组织送病检,但该方法具有侵入性,成本较高;粪便隐血试验可以帮助早期发现结直肠癌,而且使用广泛、费用较低,但敏感性和特异性均较低。因此急需探求新的诊断方法,以更好地对患者进行早期诊断和治疗。SATB2的特异AT 序列,是较重要的核基质结合蛋白的一种,与核基质附着区相结合,促进染色质重建和基因重组〔10〕。SATB2能通过甲基化水平和蛋白乙酰化等途径调控基因的表达,在肿瘤转移、凋亡调控及免疫调节等方面均发挥着重要作用〔11〕。因在外周血中发现高浓度稳定的miRNAs和其在不同肿瘤中的异常表达,miRNAs有潜力作为结直肠癌早期筛查的非侵入性标志物〔12〕。已有实验数据证实在多数肿瘤中存在特异的miRNAs的异常表达,同时发现来源于同一肿瘤个体不同组织的miRNAs的表达水平也有所不同,从而发挥抑癌基因或致癌基因作用〔13〕。本研究结果显示,miR-31和miR-182能负性调控SATB2的表达,结直肠癌细胞的转移与否与miR-31和miR-182密切相关,作用机制可能在于结直肠过表达miR-31和miR-182后,SW480细胞中的间叶标志物释放的神经钙黏素(N-Cadherin)增加,癌细胞的黏附能力、生存能力及运动能力增强。miR-31和miR-182能促进癌细胞增殖,并减少癌细胞凋亡,与结直肠的发生密切相关,由此可见通过观察miR-31或miR-182的表达,有助于判断结直肠癌患者的预后。SATB2能抑制miR-31和miR-182的体外繁殖和运动能力,促进癌细胞凋亡,减少癌细胞扩散。体内转移实验中将细胞悬液注射于裸鼠体内,观察到miR-31和miR-182大量表达,裸鼠大量发生肿瘤转移,而对照细胞组裸鼠无转移灶形成,可能机制在于miR-31和miR-182大量表达,SW480细胞中的间叶标志物能释放较多的促癌细胞分化因子波形蛋白(Vimentin)和Ki-67,进一步佐证miR-31和miR-182能通过抑制结直肠组织SATB2的表达,诱导上皮间质转化,促进结直肠癌的转移〔14,15〕。综上所述,miR-31和miR-182在结直肠癌中高表达与SATB2表达具有显著性相关,miR-31和miR-182可直接通过调控SATB2影响结直肠癌的增长侵袭。
