特发性肥厚性硬脑膜炎12例临床分析
2019-04-11陈银娟李洵桦陈衍贵范道丰
陈银娟, 郭 元, 李洵桦, 陈衍贵, 范道丰
肥厚性硬脑膜炎为慢性炎症刺激导致硬脑膜局灶性或全面性纤维组织增厚,增厚的硬脑膜压迫相关组织导致各种临床表现。根据肥厚性硬脑膜炎病因将肥厚性硬脑膜炎分为特发性及继发性两种。特发性肥厚性硬脑膜炎(idiopathic hypertrophic pachymeningitis,IHP)病因不明,既往研究表明,IHP考虑与自身免疫性相关[1],本文主要通过对IHP患者实验室检查、脑脊液分析进一步阐明特发性肥厚性硬脑膜炎与自身免疫的相关性。
1 研究对象和方法
1.1 研究对象 回顾性分析2008年6月~2017年8月在中山大学附属第一医院和福建医科大学附属龙岩第一医院神经内科诊治的特发性肥厚性硬脑膜炎患者。入组标准:(1)头部MRI表现为硬脑膜弥漫性增厚;(2)临床表现符合肥厚性硬脑膜炎表现;(3)血液及脑脊液等检查排除肿瘤、炎症、外伤、感染等继发因素导致肥厚性硬脑膜炎。符合上述标准患者共12例(见表1)。为排除颅高压对血脑屏障的影响,选取在中山大学附属第一医院神经内科及福建医科大学附属龙岩第一医院神经内科诊治的颅内静脉窦血栓患者18例,静脉窦血栓排除感染、肿瘤、炎症引起。
1.2 研究方法 所有患者入院后查血常规、生化、肿瘤指标、风湿组合、体液免疫组合、肿瘤指标、术前筛查组合、甲状腺功能全套、脑脊液常规、脑脊液生化、脑脊液找一般细菌、脑脊液找结核菌、脑脊液找隐球菌、脑脊液培养、脑脊液免疫蛋白组合(IgA、IgM、IgG)、同步血免疫蛋白组合(IgA、IgM、IgG)、头部磁共振等检查。比较特发性肥厚性硬脑膜炎与静脉窦血栓脑脊液相关指标差异。
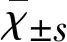
2 结 果
2.1 一般资料 IHP12例,男性8例,女性4例,年龄范围17~75岁,平均(50.00±17.81)岁;病程5 d至7 y,平均(1.11±1.94) y(见表1)。
2.2 临床症状 12例患者均表现为头痛,但头痛性质不定;2例(2/12)表现为小脑症状,即头晕和行走不稳;9例(9/12)表现为脑神经损害症状,其中视神经受累5例,动眼神经、外展神经、舌咽神经受累各3例,滑车神经、迷走神经、舌下神经受累各2例,面神经受累1例(见表1)。
2.3 实验室检查结果 所有检查结果正常2例(16.7%),血白细胞升高4例(33.3%),CRP、ESR、SAA升高均7例(58.3%),其中第1例抗DNP抗体(+),ANA(+/-),第7例和第10例RF(+),第8例ANA(+),第2例抗心磷脂抗体(+/-),第1例MPO(+)(见表1)。脑脊液同步血免疫指标均正常。
2.4 脑脊液检查结果 见表1。颅内压升高6例(50%),无颅内压降低患者。细胞数升高4例(33.3%),其中细胞数最高值为32×106/L,全部以单核细胞为主。脑脊液蛋白异常者10例(83.3%),范围249~1173 mg/L,Pandy阳性者8例(66.7%),1例Pandy(+/-)。所有患者脑脊液生化检查中糖和氯均正常,脑脊液均未找到细菌、结核菌、隐球菌,脑脊液培养菌正常。IgA升高患者11例(91.7%),IgM升高患者11例(91.7%),IgG升高患者8例(66.7%)。
2.5 头部MRI结果 所有患者头部磁共振表现为硬脑膜弥漫性增厚,其中1例患者有静脉窦血栓形成(见图1)。
2.6 治疗 所有患者均使用激素治疗,早期(240~500 mg甲强龙静滴,逐渐减量至口服量),3例患者使用免疫抑制剂治疗(硫唑嘌呤),经治疗后病情好转,但复发患者5例(41.7%),其中第8例患者经5次住院治疗,第9例患者经3次住院治疗。
2.7 IHP与静脉窦血栓脑脊液比较 IHP的脑脊液蛋白、IgA、IgM、IgG与静脉窦血栓脑脊液蛋白、IgA、IgM、IgG相比较,差异有统计学意义,P<0.05,脑脊液细胞数相比较差异无统计学意义,P>0.05(见表2);IHP脑脊液IgA、IgG与脑脊液蛋白相关,Pearson相关性为0.690、0.702。IHP脑脊液IgM及静脉窦血栓形成脑脊液IgA、IgM、IgG与脑脊液蛋白不相关。IHP及静脉窦血栓形成血液IgA、IgM、IgG与脑脊液蛋白不相关。
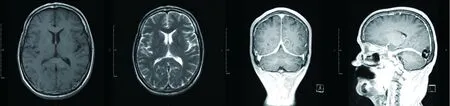
图1 IHP磁共振表现
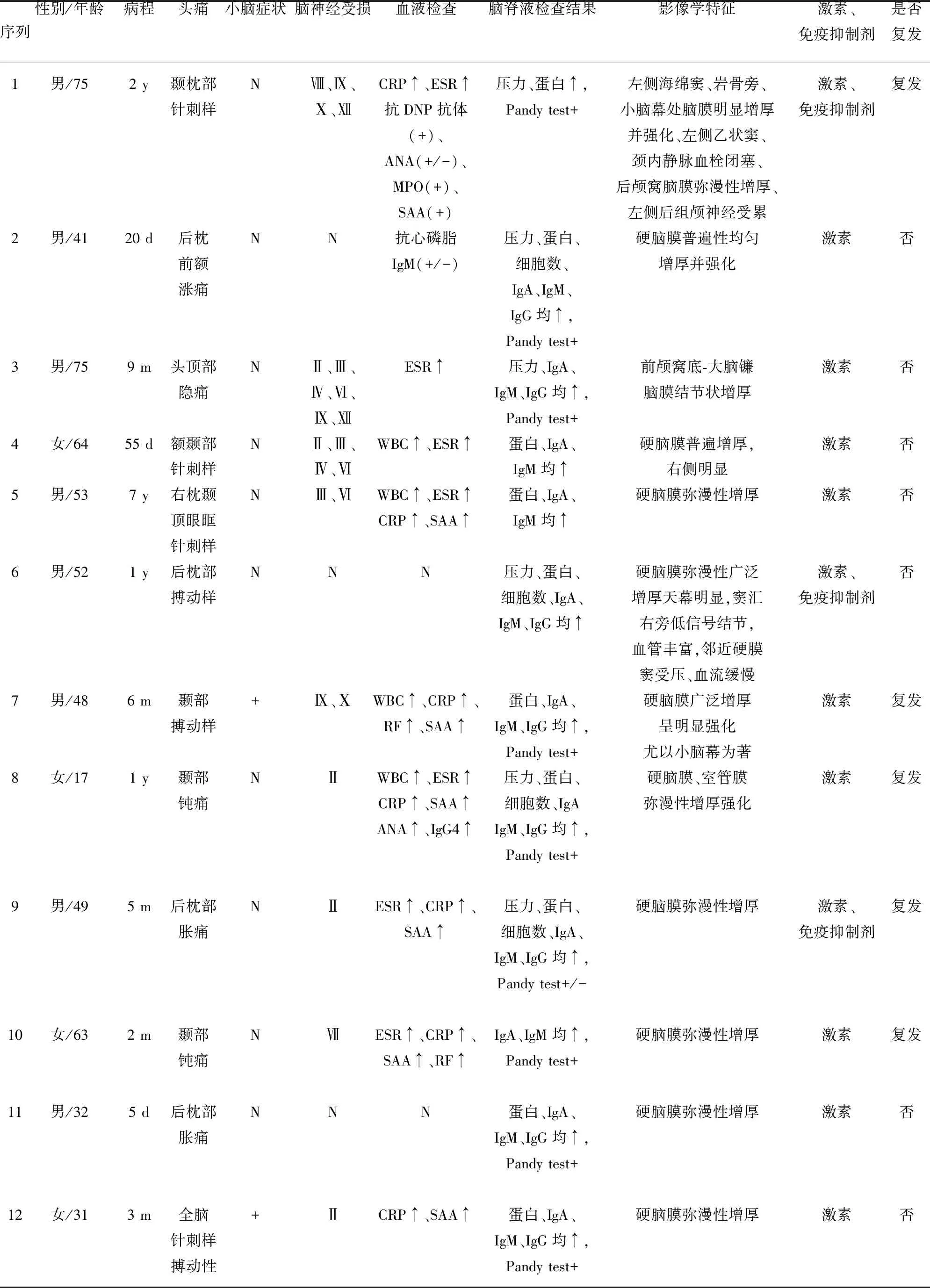
序列性别/年龄病程头痛小脑症状脑神经受损血液检查脑脊液检查结果影像学特征激素、免疫抑制剂是否复发123456789101112男/75男/41男/75女/64男/53男/52男/48女/17男/49女/63男/32女/312 y20 d9 m55 d7 y1 y6 m1 y5 m2 m5 d3 m颞枕部针刺样后枕前额涨痛头顶部隐痛额颞部针刺样右枕颞顶眼眶针刺样后枕部搏动样颞部搏动样颞部钝痛后枕部胀痛颞部钝痛后枕部胀痛全脑针刺样搏动性NNNNNN+NNNN+Ⅷ、Ⅸ、Ⅹ、ⅫNⅡ、Ⅲ、Ⅳ、Ⅵ、Ⅸ、ⅫⅡ、Ⅲ、Ⅳ、ⅥⅢ、ⅥNⅨ、ⅩⅡⅡⅦNⅡCRP↑、ESR↑抗DNP抗体(+)、ANA(+/-)、MPO(+)、SAA(+)抗心磷脂IgM(+/-)ESR↑WBC↑、ESR↑WBC↑、ESR↑CRP↑、SAA↑NWBC↑、CRP↑、RF↑、SAA↑WBC↑、ESR↑CRP↑、SAA↑ANA↑、IgG4↑ESR↑、CRP↑、SAA↑ESR↑、CRP↑、SAA↑、RF↑NCRP↑、SAA↑压力、蛋白↑,Pandy test+压力、蛋白、细胞数、IgA、IgM、IgG均↑,Pandy test+压力、IgA、IgM、IgG均↑,Pandy test+蛋白、IgA、IgM均↑蛋白、IgA、IgM均↑压力、蛋白、细胞数、IgA、IgM、IgG均↑蛋白、IgA、IgM、IgG均↑,Pandy test+压力、蛋白、细胞数、IgAIgM、IgG均↑,Pandy test+压力、蛋白、细胞数、IgA、IgM、IgG均↑,Pandy test+/-IgA、IgM均↑,Pandy test+蛋白、IgA、IgM、IgG均↑,Pandy test+蛋白、IgA、IgM、IgG均↑,Pandy test+左侧海绵窦、岩骨旁、小脑幕处脑膜明显增厚并强化、左侧乙状窦、颈内静脉血栓闭塞、后颅窝脑膜弥漫性增厚、左侧后组颅神经受累硬脑膜普遍性均匀增厚并强化前颅窝底-大脑镰脑膜结节状增厚硬脑膜普遍增厚,右侧明显硬脑膜弥漫性增厚硬脑膜弥漫性广泛增厚天幕明显,窦汇右旁低信号结节,血管丰富,邻近硬膜窦受压、血流缓慢硬脑膜广泛增厚呈明显强化尤以小脑幕为著硬脑膜、室管膜弥漫性增厚强化硬脑膜弥漫性增厚硬脑膜弥漫性增厚硬脑膜弥漫性增厚硬脑膜弥漫性增厚激素、免疫抑制剂激素激素激素激素激素、免疫抑制剂激素激素激素、免疫抑制剂激素激素激素复发否否否否否复发复发复发复发否否
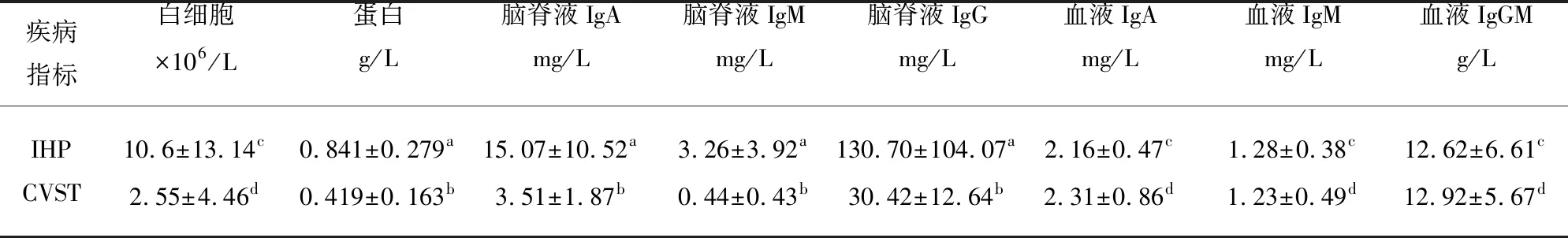
表2 IHP与静脉窦血栓形成脑脊液比较
a与b相比,P<0.05,c与d相比,P>0.05
3 讨 论
特发性肥厚性硬脑膜炎为临床少见疾病,本组病例表明发病年龄主要为中年,以男性多见。头痛是IHP主要临床症状,本组病例发现所有IHP患者均有头痛表现,头痛部位及性质不定。有些患者早期只表现为单纯头痛而无其他临床症状,且头部CT或MRI检查无硬脑膜强化表现,为早期诊断带来困难,故本病病程均较长,以慢性病程为主[2,3]。除头痛症状外,大部分患者合并脑神经受累症状,小部分合并有小脑症状。本组病例发现,脑神经受累患者占75%。视神经受累最常见,其次为动眼神经受累,其余各类脑神经均有受累,考虑硬脑膜肥厚直接压迫经过海绵窦或鞍旁相关神经或增厚的硬脑膜压迫脑神经滋养动脉或引流静脉及颅高压压迫脑神经[4]。本组病例有2例出现小脑症状,均为小脑幕受损,病因考虑肥厚硬脑膜压迫小脑相关纤维引起。头部磁共振表现是IHP临床主要诊断标准,本组病例所有患者均有硬脑膜强化表现,故对反复头痛患者应进行头部磁共振增强扫描检查。
特发性肥厚性硬脑膜炎病因暂不明确,主要倾向于由自身免疫引起[5,6],而部分学者认为是IgG4相关性疾病。既往研究表明,IHP患者CRP、ESR大部分会升高,且CRP、ESR在IHP诊断中占很重要作用。Zhao等[7]研究表明,CRP、ESR在肥厚性硬脑膜炎中升高占70%~80%,且经激素或免疫抑制剂治疗后CRP、ESR均降低,由此推断肥厚性硬脑膜炎病因考虑与自身免疫疾病有关。本组病例结果显示58.3%患者CRP、ESR升高;本组病例还发现58.3%患者SAA升高,而SAA也可作为自身免疫性疾病指标,也证实IHP可能与自身免疫相关。5例患者有有免疫指标异常,熊斌等[2]报道称特发性肥厚性硬脑膜炎部分病因与ANCA相关性有关。韩国Hwang等[8]研究表明,IgG4与IHP有明显相关,至今已有40几例IgG4肥厚性硬脑膜炎报告,大部分患者脑脊液IgG4阳性,而血清阴性,若血清阳性,说明脑膜外存在病灶[9,10]。本组病例中第8例患者血清IgG4阳性,脑脊液IgG4未检测及未进行脑膜活检,故是否与IgG4相关性肥厚性硬脑膜炎有关不明确,临床上对IHP患者均应进行脑脊液及血液IgG4检测。
脑脊液检查为神经系统疾病诊断主要依据之一。既往对IHP脑脊液结果研究较少,而本组病例对12例IHP患者脑脊液进行系统分析。本组病例发现颅内压增高患者共6例(50%),但颅压升高不明显,最高250 mmH2O,刘新平[11]研究表明,IHP颅高压最高达350 mmH2O。颅高压原因考虑为局灶性炎症刺激导致脑脊液鞘内合成增多或肥厚硬脑膜压迫脑脊液通路及静脉回流通路导致。本组病例未发现脑脊液压力低者,因此,对于颅内压过高或低颅压的影像学检查示硬脑膜弥漫强化患者应考虑继发因素或低颅压引起。脑脊液细胞数升高4例(33.3%),其中细胞数最高值为32×106/L,全部以单核细胞为主。国内Zhao等[12]研究表明IHP脑脊液细胞数<20×106/L,故IHP患者脑脊液细胞数轻至中度升高,若脑脊液细胞数超过40×106/L应考虑继发性肥厚性硬脑膜炎可能。本组病例患者的脑脊液细胞数在经激素等免疫治疗后下降明显,说明脑脊液细胞数能对病情好转有一定指导作用,但本研究发现IHP脑脊液细胞数与静脉窦血栓脑脊液细胞数相比较无差异,故脑脊液细胞数正常不能作为IHP疾病完全好转的指标。本组病例发现,脑脊液蛋白异常者10例,占83.3%,最高蛋白达1.173 g/L,均<1.2 g/L,且IHP脑脊液蛋白与静脉窦血栓脑脊液相比有显著差异,脑脊液蛋白增高考虑为肥厚硬脑膜引起血脑屏障破坏导致蛋白增多及炎症刺激导致鞘内脑脊液蛋白合成增多。本组病例患者的脑脊液蛋白在经治疗后好转,但下降不明显,故脑脊液蛋白下降但头部MRI异常者,应考虑继续服用药物治疗。Pandy阳性者8例(66.7%),1例Pandy(+/-),大部分Pandy实验在经激素或免疫抑制剂治疗后转至阴性。所有患者脑脊液生化检查中糖和氯均正常,脑脊液均未找到细菌、结核菌、隐球菌,脑脊液培养菌正常,故IHP不会使脑脊液糖和氯化物变化。
推测IHP引起的脑膜弥漫性增厚导致头痛、颅神经损害等表现可能与自身免疫相关,故免疫球蛋白在疾病发生发展中发挥重要作用。本研究发现IHP患者中脑脊液IgA升高11例(91.7%),IgM升高11例(91.7%),IgG升高8例(66.7%),且IHP患者IgA、IgM、IgG较静脉窦血栓患者明显升高,差异有明显统计学意义,经Pearson相关分析表明,脑脊液IgA、IgG与脑脊液蛋白相关,且IgG与脑脊液蛋白明显相关,这与Zhao等[12]研究基本一致。2例多次复发患者脑脊液免疫球蛋白在经激素、免疫抑制剂或丙种球蛋白治疗后明显下降,且症状好转。结合上述结果表明,脑脊液免疫球蛋白IgA、IgG在IHP病变中发挥重要作用,进一步证实IHP为免疫免疫性疾病。免疫球蛋白升高考虑原因如下:(1)硬脑膜肥厚导致血脑屏障破坏,血液中免疫球蛋白进入脑脊液中,导致脑脊液免疫球蛋白升高;(2)自身免疫性炎症刺激导致鞘内合成增多或炎症刺激激活脑中的免疫记忆细胞导致免疫球蛋白增多。但本组病例结果也表明,虽然脑脊液中免疫球蛋白升高,而同步血液免疫球蛋白升高不明显,且IHP患者血液IgA、IgM、IgG与静脉窦血栓患者比较无差异,说明脑脊液中免疫球蛋白增多考虑为炎症刺激引起鞘内合成增多或炎症刺激激活脑中的免疫记忆细胞导致免疫球蛋白增多,而血脑屏障破坏对脑脊液免疫球蛋白的影响较小。
激素、丙种球蛋白或免疫抑制剂在自身免疫性疾病的治疗中发挥重要作用。国内外对IHP治疗均使用激素或免疫抑制剂,但在激素减量过程中可能会加重病情[13,14]。本组病例患者均使用激素治疗,早期使用甲强龙(240~500 mg/d)静脉滴注治疗,大部分患者在治疗1 w后临床症状均有好转,静脉减量至口服量激素使用激素治疗,有3例患者合并使用免疫抑制剂。第8例患者第1次住院使用抗生素及抗病毒治疗,未使用激素治疗;第2次住院脑脊液免疫蛋白较前增多,说明抗生素及抗病毒治疗对IHP患者无效;第3次住院以后经激素治疗病情好转,且脑脊液指标均有下降;第5次住院后予丙种球蛋白治疗症状好转明显且脑脊液免疫球蛋白下降更加明显。第9例患者在经激素治疗后病情轻微好转,但脑脊液相关指标无好转,在加用硫唑嘌呤后病情好转明显且脑脊液指标较前明显好转。因此,激素是治疗IHP患者有效药物,对激素治疗疗效不佳患者使用免疫抑制剂治疗可能是有效的,进一步说明IHP与自身免疫相关。
综上所述,结合IHP患者CRP、ESR、SAA超半数升高,脑脊液细胞及蛋白轻至中度升高,免疫球蛋白升高明显,脑脊液蛋白及免疫球蛋白较静脉窦血栓显著升高,且激素或免疫抑制剂治疗对IHP患者有效,故IHP病因可能为自身免疫引起,但本组病例数较少,对IHP病因有待更多病例研究后明确。
