白藜芦醇通过Akt/mTOR通路上调自噬改善辐射诱导小肠损伤
2019-04-10李博张恒周曼倩朱思伟王华庆张诗武王辉
李博 张恒 周曼倩 朱思伟 王华庆 张诗武 王辉
放射治疗是恶性肿瘤重要的治疗手段,腹盆腔恶性肿瘤病人在接受放射治疗中,可因辐射诱导小肠损伤而出现放射性肠炎,对恶性肿瘤病人的生活质量造成严重影响,但目前临床上缺乏有效的防护药物[1]。一些研究[2-3]表明电离辐射可以导致细胞处于持续氧化应激状态从而下调小肠细胞自噬水平,影响细胞的自我调节及保护功能。白藜芦醇是一种天然非黄酮多酚类化合物[4],前期研究发现白藜芦醇具有抗氧化、抗衰老等作用,对小鼠具有放射防护作用[5-6]。白藜芦醇可以活化沉默信息调节因子2相关酶1(SIRT1),同时可以通过激活腺苷酸活化蛋白激酶(AMPK)和肝激酶 B1(LKB1)从而抑制哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的活性[7]。但白藜芦醇能否通过抑制Akt/mTOR通路调控小肠隐窝细胞自噬发挥放射防护作用尚未见报道。本项研究拟在前期工作的基础之上深入研究白藜芦醇对小肠辐射损伤防护作用的机制,为开发相关防护药物提供基础数据。
1 材料与方法
1.1 实验动物 C57BL/6雄性小鼠(SPF级)24只,体质量24~26 g,8周龄 [购自中国食品药品检定研究院,许可证号:SCXK(京)2014-0013]。 随机分为对照组、照射组及照射给药组,每组各8只。白藜芦醇用无水乙醇助溶配置成母液,避光4℃保存,给药前用生理盐水稀释。照射给药组小鼠于照射前3 d至照射后3 d每日腹腔注射(50 mg/kg);对照组和照射组给予同等体积生理盐水腹腔注射。参考相关研究[8-9],照射组及照射给药组小鼠均接受6MV-X射线全身照射,单次剂量9.0 Gy。小鼠于照射后3.5 d脱颈处死,取部分小肠组织用中性甲醛固定24 h后脱水制作石蜡块,再取部分新鲜小肠组织予以研磨。
1.2 主要试剂 白藜芦醇(R5010)购自美国Sigma公司,Ki67(ab15580)兔源多克隆抗体购自Abcam公司 (美国),p-Akt (4060) 兔源单克隆抗体、Akt(4691)兔源单克隆抗体、p-S6R P(5364)兔源单克隆抗体、S6RP(2217)兔源单克隆抗体、LC3A/B(12741)兔源单克隆抗体、GAPDH(5174)兔源单克隆抗体和羊抗兔二抗 (7040)均购于Cell Signaling Technology公 司 (美 国 ),Beclin1兔 来 源 多 抗(11306-1-Ap)购于 Proteintech 公司(中国),蛋白提取试剂购自于Thermo公司(美国),免疫组织化学通用SP试剂盒(SP-9000)购自北京中杉金桥生物技术有限公司。
1.3 组织学分析 由小鼠空肠组织制作的石蜡块经切片为5μm后行HE染色,于镜下分析。每只小鼠至少测量30根小肠绒毛长度,至少计数50个完整小肠隐窝中的隐窝细胞总数,计数每只小鼠10个小肠横断面中隐窝数目,所有数据计算平均值。采用SP两步法行免疫组织化学染色,检测小肠组织内Ki67表达情况,镜下每只小鼠至少计数60个完整小肠隐窝的阳性细胞数及隐细胞总数并计算平均值,统计小肠隐窝细胞Ki67表达阳性率。
1.4 蛋白印迹检测相关蛋白 取新鲜空肠组织100 mg匀浆后提取小肠组织总蛋白。采用BCA法测定蛋白浓度,等量上样,分别用10%和15%的SDS-PAGE凝胶电泳分离,蛋白转膜至聚偏氟乙烯(PVDF)膜上,5%脱脂牛奶封闭后选取最佳浓度一抗 (p-Akt,1∶2 000;Akt,1∶1 000;p-S6RP,1∶1 000;S6RP,1 ∶1 000;LC3A/B,1 ∶1 000;GAPDH,1 ∶1 000;Beclin 1,1∶1 000)4℃孵育过夜, 洗膜后用辣根标记的二抗(1∶3 000)孵育 2 h,洗膜后 ECL化学发光法显影,Bio-rad全自动凝胶成像系统显影拍照,采用Image J 1.4软件 (National Institutes of Health公司,美国)对条带分析。
1.5 统计学处理 采用SPSS16.0软件包进行统计学分析。采用Kolmogorov-Smirnov法对数据行正态分布检验,计量资料用均数±标准差(x±s)表示。多组间比较采用ANOVA方差分析,方差齐时用LSD-t法,方差不齐用 Dunnett’s T3检验。P<0.05为差异有统计学意义。
2 实验结果
2.1 组织病理学检测结果比较 与对照组相比,照射组和照射给药组的小鼠小肠绒毛长度、单个横断面隐窝数、小肠隐窝细胞总数及Ki67阳性率均显著下降(均P<0.05);照射给药组小鼠上述数据均高于照射组(均P<0.05),详见表1。各实验组小肠组织病理切片HE染色见图1A,Ki67免疫组织化学染色结果见图1B。
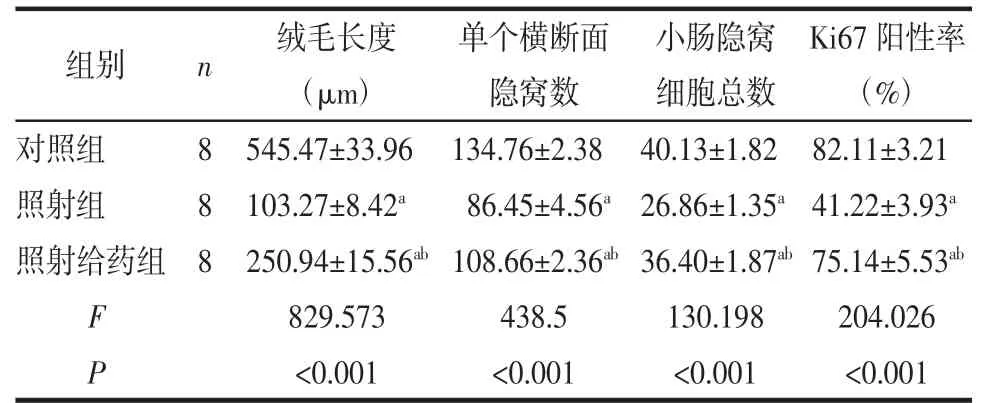
表1 3组小鼠组织病理学结果比较
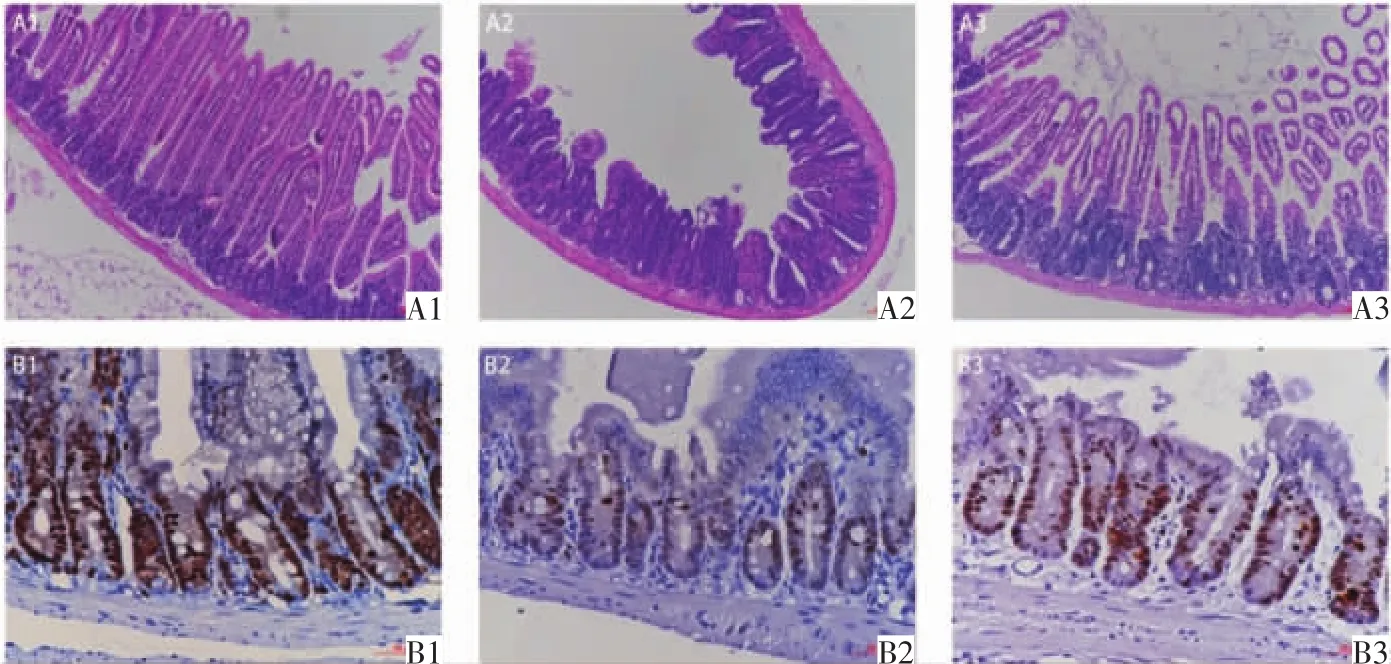
图1 3组小鼠小肠组织HE染色及Ki67免疫组织化学染色 (A1-A3:HE染色,×100。B1-B3:SP两步法Ki67免疫组织化学染色,×200;染色呈棕色细胞为Ki67表达阳性)。A1、B1图为对照组,小肠各级结构正常,绒毛完整,隐窝排列整齐,大部分隐窝细胞为Ki67阳性。A2、B2图为照射组,小肠黏膜水肿,隐窝结构紊乱,绒毛脱落,Ki67阳性隐窝细胞较少。A3、B3图为照射给药组,小肠绒毛及隐窝结构较照射组完整,Ki67阳性隐窝细胞较照射组增加。
2.2 小肠Akt/mTOR通路活性比较 照射组和照射给药组p-Akt、p-S6RP相对表达量均高于对照组(t=21.535,t=10.593,均 P<0.001),照射给药组p-Akt、p-S6RP 相对表达量低于照射组(t=-11.521,t=-6.468,P<0.001),见表 2。 Akt/mTOR 通路相关蛋白的相对表达情况见图2。
2.3 自噬相关蛋白水平比较 照射组LC3-II、Beclin1相对表达量低于对照组(t=-15.131,t=-27.588,均P<0.001)和照射给药组(t=21.315,t=-14.774,均 P<0.001),见表 2。3组小鼠小肠自噬相关蛋白 LC3-II、Beclin 1的表达情况见图3。
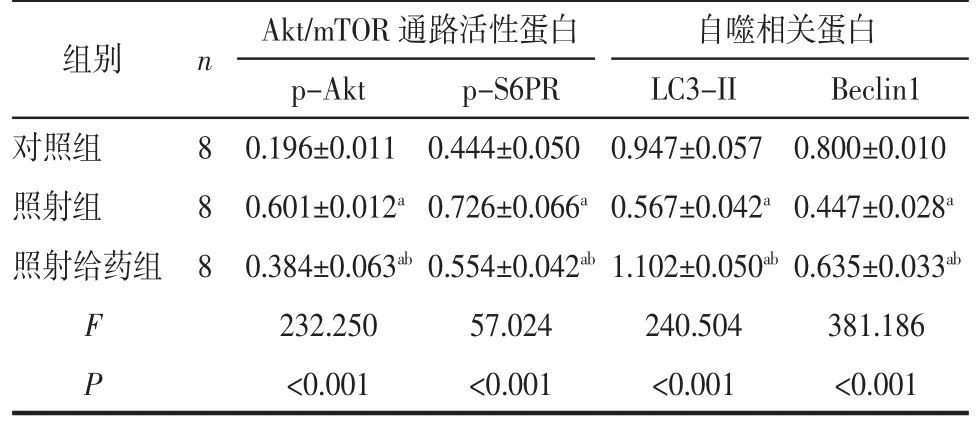
表2 3组小鼠小肠组织中相关蛋白相对表达量比较
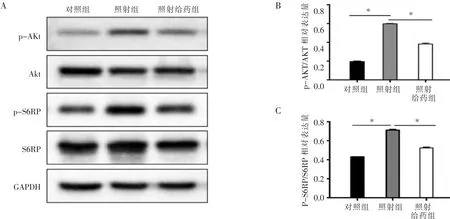
图2 3组小鼠小肠组织Akt/mTOR通路相关蛋白表达情况(A图,蛋白电泳图;B图,p-Akt/Akt相对表达量柱状图;C 图,p-S6RP/S6RP 相对表达量柱状图;*P<0.05)。
3 讨论
放射性肠炎是腹盆腔恶性肿瘤放射治疗的常见并发症,主要因长期大剂量射线导致小肠的组织结构被破坏而诱发。研究[2]发现程序性细胞死亡——自噬,对小肠辐射损伤具有重要的调控作用。当处于正常水平时,细胞内的自噬有利于清除细胞内受损或者多余细胞成分,从而维持细胞应激情况下的营养及能量供应[11],然而过度激活的自噬则会导致组织损伤,因此根据激活的程度和种类不同,自噬对机体可发挥促进保护或诱导损伤的双向作用[12],但其机制尚未完全探明。由于电离辐射可导致小鼠小肠细胞的持续氧化应激,进而下调自噬相关通路的活性,从而造成小肠损伤。mTOR是PI3K/Akt信号传导通路中的重要环节,可整合营养、能量及生长因子等多种细胞外信号,调控细胞存活、生长、蛋白质合成、增殖和自噬等过程[13]。在Akt信号的调节下,mTOR可抑制Atg13和Atg1结合形成自噬体,从而抑制自噬体膜的形成,抑制自噬[14]。
有研究[4,10]表明,白藜芦醇具有抗氧化、抗衰老作用,可以有效改善辐射诱导的小鼠骨髓功能抑制、免疫系统损伤;白藜芦醇可活化SIRT1,同时可以通过激活AMPK和LKB1来抑制mTOR的活性[7]。在此基础上,本研究探讨了白藜芦醇能否通过抑制Akt/mTOR通路调控小肠隐窝细胞的自噬,而对小肠辐射损伤发挥防护作用。
本研究结果显示,小鼠接受9 Gy剂量的X射线全身照射后,可观察到小肠隐窝细胞数量减少和增殖能力降低、小肠绒毛损伤;在接受相同剂量X线照射的情况下,与照射组相比,白藜芦醇持续干预使小鼠的小肠绒毛长度、隐窝细胞数目、单个横断面隐窝数及隐窝细胞Ki67阳性率均显著增加,说明白藜芦醇可有效改善电离辐射导致的小肠损伤。
与照射组小鼠相比,白藜芦醇干预后的受照射小鼠小肠组织的p-Akt、p-S6RP表达下降,说明白藜芦醇抑制了受照小鼠小肠组织Akt/mTOR通路活性。白藜芦醇干预后受照射小鼠小肠组织自噬相关的标志性蛋白LC3-Ⅱ、Beclin1表达较照射组小鼠增加,提示白藜芦醇可上调受照小鼠小肠细胞的自噬水平,而自噬水平的适当上调有助于细胞的防护作用[15]。本研究结果提示,白藜芦醇可对小肠辐射损伤发挥防护作用,其改善小肠辐射损伤的机制可能是通过mTOR依赖途径调节小肠细胞的自噬水平,而上调后的自噬作用为受照小肠隐窝细胞提供营养及能量供应,改善了其增殖能力。
本研究表明,白藜芦醇通过Akt/mTOR途径对自噬水平的适度调控可能是其改善小肠辐射损伤的关键机制,今后的辐射损伤防护相关研究中,如何适度调控自噬可作为进一步研究的方向。由于自噬复杂的调控机制尚未探明,白藜芦醇上调小肠细胞自噬水平的过程,是否还有mTOR以外的途径参与有待进一步研究。此外,电离辐射可导致小肠的急性损伤与慢性损伤,两者具有不同的分子机制[1]。本的仅局限于辐射诱导小肠急性损伤进行研究,在慢性损伤中白藜芦醇是否具有相同的防护机制仍有待研究。
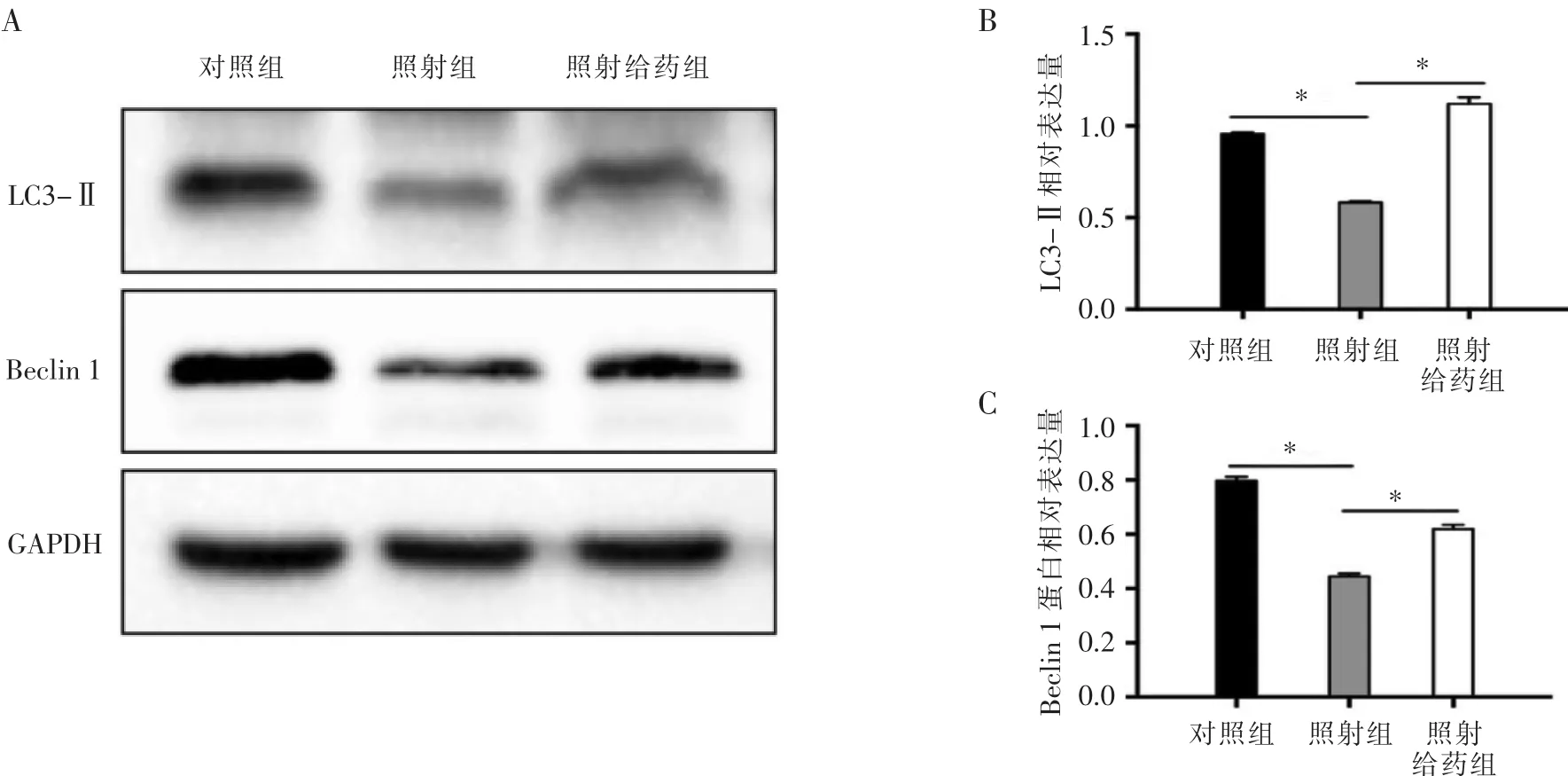
图3 3组小鼠小肠组织自噬相关蛋白表达情况 (A图,蛋白电泳图;B图,LC-3II蛋白相对表达量柱状图;C图,Beclin1蛋白相对表达量柱状图,*P<0.05)。
