不同剂量异丙肾上腺素致小鼠慢性心肌缺血模型的 制备及评价标准的建立*
2019-04-10朱竟赫武晓琳乔菊久范英兰包玉龙胡丽萍
朱竟赫 刘 驰 刘 禾 武晓琳 乔菊久 李 淼 范英兰 包玉龙 齐 越 胡丽萍
(1. 辽宁省中医药研究院,沈阳 110034)(2. 辽宁中医药大学,沈阳 110847)
大、小鼠皮下大剂量注射异丙肾上腺素(ISO)能导致心肌缺血,与人的心肌缺血症状较为接近,是常用的、经典的抗心肌缺血作用评价模型,例如谭文明等[1]和焦淑萍等[2]分别利用ISO对大鼠和小鼠进行了心肌缺血模型的制备。但采用此法建立慢性心肌缺血模型的造模方法、造模剂量及评价指标尚缺少系统的试验研究,文献报道的方法繁多但无统一的、客观的标准和依据。
ISO为β受体激动剂,可使心肌剧烈收缩而缺血缺氧,产生大量的ONOO-和氧自由基,对心肌细胞造成损伤[3]。Prabhu等[4]发现大剂量ISO可导致心肌线粒体组织蛋白酶-D和β葡萄糖醛酸酶活性显著降低,心肌线粒体膜稳定性下降。当心脏负担过重时也可导致心肌微循环障碍,引发缺血性病变[5]。大剂量注射ISO使肾素-血管紧张素-醛固酮系统被高度激活,可导致心功能进行性恶化并形成恶性循环[6]。因此,ISO成为使用频率较高的经典的心肌缺血模型造模药物之一。
本文采用不同剂量ISO对小鼠进行颈部皮下注射,建立小鼠慢性心肌缺血模型,观测各模型组两周内的心电图、生化指标及病理指标的改变。通过比较确定最佳造模剂量,建立较为客观、可靠的慢性心肌缺血模型的评价标准,为相关模型制备及药效评价研究提供依据和参考。
1 材料与方法
1.1 材料
1.1.1试剂;ISO:上海禾丰制药有限公司,产品批号:101101,规格:2 mL:1mg;水合氯醛:国药集团化学试剂有限公司,产品批号:20081120。
1.1.2仪器:ML785多导生理记录仪:澳大利亚AD;AU5800型全自动生化分析仪:美国BECKMAN COULTER。
1.1.3动物:SPF级雄性KM小鼠,体质量18~22 g,购于辽宁长生生物技术有限公司,实验动物生产许可证号:SCXK(辽)2015-0001
1.1.4饲养环境:小鼠饲养于辽宁省中医药研究院(辽宁中医药大学附属第二医院)实验动物中心[实验动物使用许可证号:SYXK(辽)2012-0003],屏障环境,温度:21~25 ℃,湿度45%~60%;动物自由采食和饮水,垫料每3日更换一次。颗粒饲料及玉米芯垫料,均由北京科澳协力饲料有限公司提供[实验动物饲料生产许可证号:SCXK(京)2014-0010]。
1.2 方法
SPF级雄性KM小鼠160只,随机分为4组,每组40只,分别为空白组(生理盐水)、高剂量组(ISO,32 mg/kg体质量)、模型中剂量组(ISO,16 mg/kg体质量)、模型低剂量组(ISO,8 mg/kg体质量)。适应性饲养5 d后,腹腔注射4%水合氯醛,按每千克体质量0.4 g麻醉,Ⅱ导联描记各组小鼠造模前心电图。恢复性饲养3 d。各组按每千克体质量10 mL给药,颈部皮下注射相应浓度的ISO(0.32%、0.16%和0.08%),每日8:30定时注射,每日一次,连续造模3 d。末次注射ISO当晚禁食不禁水16 h,第二天麻醉前统计小鼠死亡率,末次注射ISO后24 h,每只小鼠腹腔注射4%水合氯醛麻醉,Ⅱ导联描记造模24 h后心电图。恢复性饲养待到末次注射ISO后第8天,每只小鼠腹腔注射4%水合氯醛麻醉,Ⅱ导联描记造模后8 d心电图,每组取10只小鼠眼眶采血1 mL,3 000 r/min离心10 min,吸取血清,AU5800型全自动生化分析仪检测肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)、乳酸脱氢酶(LDH)、天门冬氨酸氨基转移酶(AST)、肌钙蛋白T(CTN-T)。引颈法处死后,摘取心脏甲醛固定, HE染色,光学显微镜观察各组心肌形态学改变并拍照。其余小鼠恢复性饲养待到末次注射ISO后第15天,每只小鼠腹腔注射4%水合氯醛麻醉,Ⅱ导联描记造模后15 d心电图,每只小鼠眼眶采血检测生化指标;引颈法处死后,心脏HE染色并观察病变情况。
记录每只小鼠各个时间点的心电图,采用LabChart8读取T波高度,每只小鼠每个时间点连续4个波为1段取一个平均T波高度值,取3段的平均值作为该鼠该时间点的T波高度数值。
采用造模后24 h、8d及15 d心电图的T波高度分别与该鼠造模前心电图的T波高度做差并取其绝对值,得出造模后各时间点的T波变化量;然后以T波变化量除以该鼠造模前心电图的T波高度,得出造模后各时间点的T波变化率[7]。
1.3 统计方法

2 结果
2.1 心电图
四组小鼠造模前、造模后24 h、造模后8 d及造模后15 d心电图见图1~4。各时间点T波高度、T波变化量及T波变化率见表1。
由表1可知,造模后各时间点T波高度均以自身造模前T波高度作为参照得出变化量及变化率,结果如下:各组造模后24 h、8d及15 d的T波高度较造模前均有所降低;中剂量组造模后24 h的T波高度显著低于空白组(P<0.05)。高剂量组造模后15 d的T波变化量显著高于空白组(P<0.01);中剂量组造模后24 h、8d及15 d的T波变化量显著高于空白组(P<0.01)。高剂量组造模后15 d的T波变化率显著高于空白组(P<0.05);中剂量组造模后24 h、8d的T波变化率显著高于空白组(P<0.01);中剂量组造模后15 d的T波变化率显著高于空白组(P<0.05)。
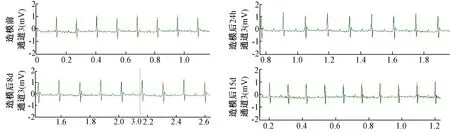
图1 空白组心电图 Fig.1 Electrocardiogram of control group

图2 高剂量组心电图Fig.2 Electrocardiogram of high dose group

图3 中剂量组心电图Fig.3 Electrocardiogram of middle dose group
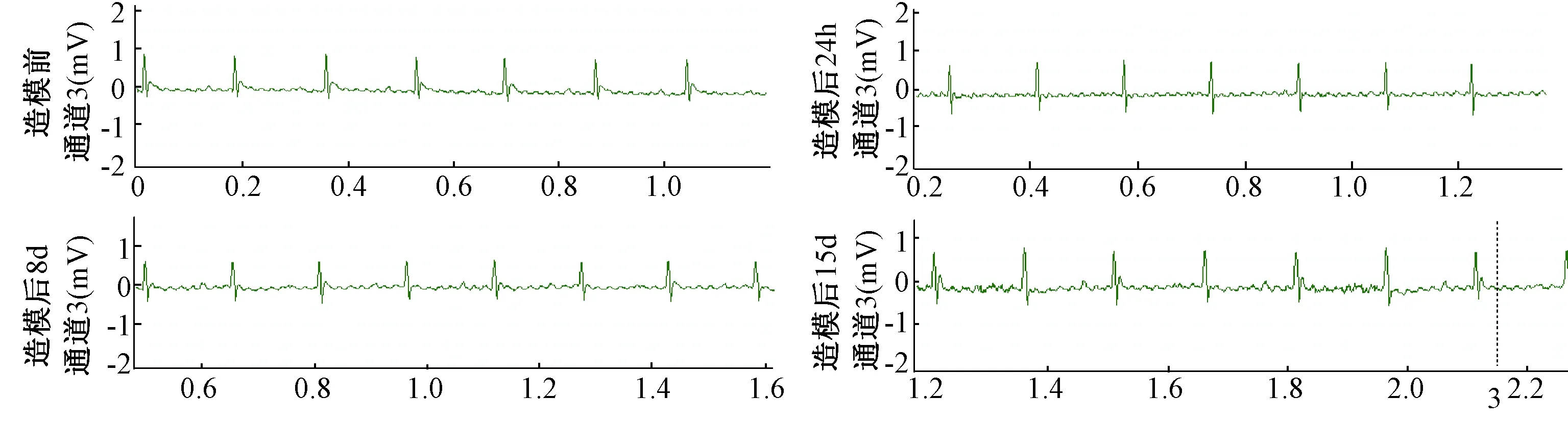
图4 低剂量组心电图Fig.4 Electrocardiogram of low dose group

项目空白组高剂量组中剂量组低剂量组造模前造模后24 h造模后8 d造模后15 d动物数/n40404040T波高度/mV0.19±0.080.20±0.030.21±0.060.21±0.06动物数/n40233035T波高度/mV0.14±0.060.11±0.100.05±0.13∗0.10±0.11T波变化量/mV0.07±0.060.10±0.060.17±0.11∗∗0.13±0.09T波变化率/%36.89±23.0053.67±35.9984.31±54.73∗∗64.94±39.19动物数/n40233035T波高度/mV0.13±0.050.09±0.130.09±0.100.11±0.07T波变化量/mV0.06±0.060.12±0.070.15±0.10∗∗0.11±0.06T波变化率/%34.19±22.6462.53±42.1677.02±51.92∗∗48.69±26.50动物数/n30132025T波高度/mV0.09±0.050.04±0.070.07±0.110.12±0.07T波变化量/mV0.06±0.040.15±0.09∗∗0.15±0.08∗∗0.09±0.07T波变化率/%38.57±28.2282.10±55.46∗71.55±37.00∗40.20±23.89
注:与空白组相比*P<0.05,**P<0.01
Note: Compared with the control group,*P<0.05,**P<0.01
2.2 心肌损伤标志物
造模小鼠分别于造模后8 d、15 d进行眼眶采血,血清中心肌损伤标志物的检测结果见表2、表3。

表2 造模后8 d的AST、CK、CK-MB、LDH及CTN-T数据Table 2 The data of AST、CK、CK-MB、LDH and CTN-T after 8 d of animal models
注:与空白组相比*P<0.05,**P<0.01
Note: Compared with the blank control group,*P<0.05,**P<0.01
高剂量组、低剂量组AST显著高于空白组(P<0.05);中剂量组AST极显著高于空白组(P<0.01)。中剂量组CK极显著高于空白组(P<0.01)。高剂量组、中剂量组CK-MB极显著高于空白组(P<0.01);低剂量组CK-MB显著高于空白组(P<0.05)。高剂量组、中剂量组LDH极显著高于空白组(P<0.01)。
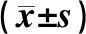
表3 造模后15 d的AST、CK、CK-MB、LDH及CTN-T数据Table 3 The data of AST、CK、CK-MB、LDH and CTN-T after 15 d of animal models
注:*P<0.05,**P<0.01 vs空白组
Note: Compared with the blank control group,*P<0.05,**P<0.01
由表3可知,中剂量组、低剂量组AST极显著高于空白组(P<0.01)。中剂量组CK极显著高于空白组(P<0.01)。高剂量组、中剂量组、低剂量组CK-MB极显著高于空白组(P<0.01)。高剂量组、中剂量组LDH极显著高于空白组(P<0.01);低剂量组LDH显著高于空白组(P<0.05)。
2.3 病理
小鼠心肌HE染色切片结果见图5~8。空白组小鼠心肌纤维粗细均匀,排列整齐,横纹清楚,未见变性坏死,心肌间质亦无炎症反应(图5);模型高剂量组各只小鼠心肌纤维大范围变性,表现为心肌细胞界限不清,胞浆溶解成粉染颗粒状,细胞核分布不均,核增大,可见核仁(图6);其中8 d 小鼠心肌纤维出现点灶状坏死,较多淋巴细胞为主的炎性细胞浸润(图7);其中15 d 小鼠心肌间散在多灶性坏死区,间质水肿,血管充血,较多淋巴细胞为主的炎性细胞浸润(图8)。

图5 空白组小鼠心肌组织(HE,×400)Fig.5 The cardiac tissue in mice of black comparison group(HE,×400)

图6 模型高剂量组小鼠心肌组织(HE,×400)Fig.6 The cardiac tissue in mice of high dose group(HE,×400)

图7 模型高剂量组造模后8 d小鼠心肌组织(HE,×400)Fig.7 The cardiac tissue in mice of high dose group after 8 days(HE,×400)
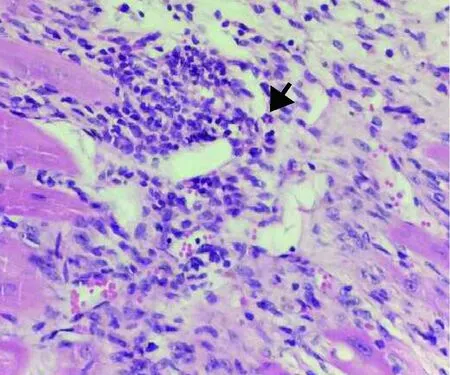
图8 模型高剂量组造模后15 d小鼠心肌组织(HE,×400)Fig.8 The cardiac tissue in mice of high dose group after 15 days(HE,×400)
2.4 死亡率
各组小鼠按相应剂量皮下连续3 d注射ISO后剩余动物数及死亡率见表4。

表4 造模前后动物的剩余数量及死亡率Table 4 The Remaining number and death rate of animals before/after animal models
由表4可知造模后高剂量组剩余动物23只,死亡率为42.5%;中剂量组剩余动物30只,死亡率为25%;低剂量组剩余动物35只,死亡率为12.5%。
3 讨论
目前,大、小鼠慢性心肌缺血模型的造模方法、造模剂量及评价指标尚缺少系统的试验研究,文献报道的方法繁多但无统一的、客观的标准和依据。本文认为,慢性心肌缺血模型的是否成模标准,应根据其所应用的试验时间而定,此模型若能在受试药物较长的给药期间内维持稳定即可判断此模型成功。通过查阅文献[8-10]很大一部分治疗心肌缺血的药效学试验给药时间均不超过15 d,本试验针对此情况设计观察8 d和15 d,这个时间长度基本可以满足大部分治疗给药试验周期的需求。指标选择上采用ECG、心肌酶谱、肌钙蛋白及病理观察,涵盖了很大一部分试验的常规需求[11-14]。
本实验以小鼠作为试验对象,一般小鼠ECG特点为无明显ST段,S波与T波直接平滑相连,人工测量ST段及J点主观性较强。故以T高度作为考察指标,影响因素较少,准确度较高,更加客观。结果显示连续3 d皮下注射ISO 16 mg/kg 的剂量组在造模后24 h、8 d、15 d ECG的T波高度均发生较为显著的变化;连续3 d皮下注射ISO 32 mg/kg 的剂量组在造模15 d时T波高度变化较为显著;而连续3 d皮下注射ISO 8 mg/kg 的剂量组各个时间T波高度均无显著变化。这说明连续3 d皮下注射ISO 32 mg/kg 和16 mg/kg的剂量都能造成小鼠较持久的心肌缺血症状。而8 mg/kg 的剂量效果不显著。ISO 16 mg/kg 剂量组的ECG在24 h、8 d时T波高度变化较为显著,而ISO 32 mg/kg 剂量组在24 h、8 d时T波高度变化反而不显著,可能是由于ISO 32 mg/kg 剂量组死亡率较高,一些症状严重的个体死亡了,而ISO 16 mg/kg 剂量组反而保留下一些症状严重的个体,导致ECG变化显著。三个剂量组在造模后8 d、15 d时,心肌酶谱相对空白组均有显著性差异,如果单纯考察心肌酶谱,这三个剂量均可使用;只有ISO 32 mg/kg 的剂量组在造模后8 d、15 d出现可见的心肌病理变化。本试验采用16 mg/kg剂量的死亡率为25%,8 mg/kg剂量的死亡率仅为12.5%,而相比其他文献报道[15]使用8 mg/kg 剂量的死亡率就已达到33.3%。原因可能和操作有关。
目前常见一些实验采用大鼠尾静脉注射ISO或垂体后叶素(PIT)造成急性心肌缺血模型[16-17],本实验旨在制备慢性心肌缺血模型,不追求使药物第一时间达到最大血药浓度,短时间血药浓度过高亦可以造成动物死亡率过高,因而未采用静脉注射,而是采用皮下注射的方式。大鼠皮下多点注射ISO是制备慢性心肌缺血的常用方法,但根据预实验发现,大鼠对ISO的耐受程度远低于小鼠,死亡率较高,有关大鼠的研究情况将在后续文章中进行报道。
心肌缺血的表现不仅在于 ECG 的异常,还涉及到一些酶学指标的变化。传统的心肌酶谱包括AST(生物半衰期20 h,18~36 h达峰,3~4 d恢复正常)、CK(生物半衰期17 h,12~24 h达峰,3~4 d恢复正常)、CK-MB(生物半衰期13 h,12~24 h达峰,2~3 d恢复正常)、LDH(生物半衰期110 h,48~72 h达峰,7~14 d恢复正常)用以评估心肌细胞性损伤, 其中AST和LDH广泛存在于全身各组织中,单独的AST或LDH升高并不能确认为心肌损伤,必须结合心电图以及CK、CK-MB等指标联合判断;CK是心肌细胞中重要的能力调节酶,由M和B 两个亚基组成,形成CK-MM、CK-MB和CK-BB三种同工酶;其中CK-BB主要存在于脑组织中,CK-MM主要存在于骨骼肌中,而CK-MB主要存在于心肌中,故CK-MB特异性最高[18]。CTN-T(生物半衰期2 h,12~96 h达峰,7-14 d恢复正常)是收缩蛋白中调节蛋白的重要部分,是CTN与原肌球蛋白结合的部分,其在心肌中的含量较高,而正常人的血液中几乎检测不到CTN-T,对急性心肌梗死有较高的分辨能力[19]。本试验设计的考察时间为8 d和15 d,其中8 d超过了AST、CK、CK-MB的恢复时间,15 d超过了上述所有标志物的恢复时间。皮下注射ISO 32 mg/kg、16 mg/kg 及8 mg/kg,8 d及15 d后动物血液中的CK-MB较空白组均有显著性差异,无论是8 d还是15 d均远超过了CK-MB的恢复时间,这说明这三个造模剂量均能造成心肌的持续损伤。而皮下注射ISO 16 mg/kg剂量组在15 d仍能够保持AST、CK、CK-MB、LDH显著升高,说明该剂量持续造成心肌损伤效果较好。
从心电图及心肌损伤标志物的结果来看,中剂量组的心电图改变和心肌损伤均比高剂量组严重,但其死亡率仅为25%,较高剂量组的死亡率42.5%大幅降低。我们推测是由于高剂量组一些小鼠无法耐受而死亡,中剂量组则因为剂量相对较低死亡率大幅降低,因而保留的一部分症状较重的小鼠。中剂量组死亡率与心电图及心肌损伤标志物改变达到了相对较好的平衡。
从病理结果来看,高剂量组造模后8 d及15 d的小鼠心肌均出现明显病理变化,可见以ISO 32 mg/kg造模可在8 d、15 d内造成病理性损伤,形成心肌的坏死性炎症反应。中剂量组、低剂量组镜下均未发现明显病理改变。
综上所述,小鼠连续3 d皮下注射ISO 32 mg/kg或ISO 16 mg/kg均能造成慢性心肌缺血模型,可在心电图、心肌损伤标志物及病理形态三方面均产生显著改变。此模型造模方法简便,维持时间长,适合抗慢性心肌缺血药物较长期治疗给药的药效评价。而ISO 16 mg/kg的造模剂量死亡率较低并且在心电图与心肌损伤标志物的指标上优于ISO 32 mg/kg,但并未造成心脏明显病理性损伤。提示可根据不同试验预期选择性地采用2个不同造模剂量建立小鼠慢性心肌缺血模型。
