脱落乳牙牙髓干细胞与脐带间充质干细胞治疗大鼠脊髓损伤疗效比较
2019-04-10刘露张青翟启明刘安琪刘文佳金钫
刘露 张青 翟启明 刘安琪 刘文佳 金钫
目前对脊髓损伤(SCI,spinal cord injury)尚无有效的治疗方法,细胞移植如胚胎干细胞、神经干细胞、雪旺细胞、嗅鞘细胞、间充质干细胞等为其带来曙光[1]。由于存在移植物来源限制、 免疫排斥反应等问题,限制了前者的临床应用;而间充质干细胞在此方面有明显优势,成为新的研究热点。脱落乳牙牙髓干细胞(SHEDs)和脐带间充质干细胞(UCMSCs)易于收集利用,越来越多关于其应用于脊髓损伤治疗的研究[2-3],然而尚没有研究比较二者的疗效。
对于严重的脊髓全横断损伤,研究中常用的修复方法是干细胞复合外源性支架材料移植[4],但支架材料的安全性及转归有待验证。近年来一种基于细胞膜片工程的细胞聚合体技术作为组织工程的新秀引起大家的注意[5]。细胞聚合体含大量细胞外基质(ECM)内源性支架,更有利于细胞存活、增殖、分化,且制备简捷, 已有部分关于细胞聚合体技术应用于心肌梗死、肾损伤、角膜损伤及牙周损伤等的治疗[6-7],本实验拟探究间充质干细胞聚合体对大鼠脊髓全横断损伤修复的有效性,并对UCMSCs和SHEDs 2 种聚合体体外性能,体内疗效进行对比,选出更为优势的方法,为临床脊髓损伤的治疗提供新思路。
1 材料与方法
1.1 主要试剂
α-MEM培养基、 DMEM培养基、 胎牛血清FBS、 胶原酶、 Hanks' 溶液(Gibco,美国); 胰蛋白酶(Invitrogen, 美国); 维生素C、 荧光标记的鼠抗人单克隆抗体 CD29、 CD90、 CD31(eBioscience,美国); CD105、 CD34、 CD45(Biolegend, 美国); CCK-8细胞活力检测试剂盒(南京恩晶生物科技有限公司); PCR试剂盒、 BDNF、 NGF ELISA检测试剂盒(Raybiotech, 美国)。
1.2 SHEDs,UCMSCs的分离,培养及鉴定
SHEDs:从临床获取患者脱落的乳牙,PBS反复冲洗,无菌条件下取出牙髓,机械剪切加酶消化法制备成细胞悬液,离心后用含10%FBS及双抗的α-MEM培养基重悬,接种于T25的塑料培养瓶中,待细胞长至80%~85%后正常传代[8]。
UCMSCs:从公司获得新鲜的人脐带,在Hanks'平衡盐溶液中清除脐带血管,将间充质组织切成约0.5 cm3的小块, 250 g离心5 min。除去上清,用无血清DMEM洗涤沉淀物,离心后吸除上清;分别在37 ℃先后用胶原酶和2.5%胰蛋白酶处理18 h, 30 min;然后加入FBS停止消化。将解离的间充质细胞进一步分散在10% FBS-DMEM中,直接用于培养或储存在液氮中以备后用。
鉴定:镜下观察细胞形态。待传至P4代时,选对数生长期的细胞进行流式鉴定。常规消化离心,PBS重悬,以200 μl分装至1.5 ml EP管中,每管不少于1×106个细胞。除空白管外,每管分别加入2 μl荧光标记的抗人单克隆抗体CD29-FITC,CD90-PE, CD105-PE,CD31-PE,CD34-PE,CD45-PE,室温避光孵育30 min,PBS洗3 次, 800 r/min×5 min, 最终以300 μl PBS重悬细胞,用流式细胞仪检测。
1.3 细胞增殖能力检测
用CCK-8细胞活力检测试剂盒检测细胞增殖能力:在96 孔板中加入100 μl(2 000 个细胞)细胞悬液,孵箱内培养1~7 d后分别检测。加CCK-8溶液后继续孵育2 h,用酶标仪测定在450 nm处吸光度。
1.4 细胞聚合体的制备
将P5代细胞按3×105/孔接种于12孔板中,待细胞长至85%~90%时弃去原有培养液,加入含VC(50 μg/ml)的α-MEM培养基, 每2 天换液1 次, 3 d后肉眼可见白色膜状结构,并随时间继续增厚。培养7 d后用镊子轻轻撕下细胞聚合体[9],部分用于动物实验,部分切片做HE染色。
1.5 相关神经营养因子表达情况
1.5.1 RT-PCR SHEDs,UCMSCs培养至P5代,提取细胞总RNA,用PCR RT Master Mix反转录合成cDNA。用 CFX96 Real Time System在实时定量 PCR仪中完成扩增和检测。
1.5.2 ELISA 收集培养细胞聚合体第3 天和第7 天时的细胞上清,分别用 BDNF、NGF的ELISA试剂盒(按说明书操作)进行检测。
1.6 SHEDs和UCMSCs聚合体治疗大鼠脊髓全横断损伤的动物实验
动物实验程序符合第四军医大学动物使用及管理委员会规定。
1.6.1 建模及实验分组 建立大鼠脊髓全横断模型:180~200 g SD雌性大鼠,1%戊巴比妥钠麻醉后手术:去除T8-9椎板,暴露脊髓,显微剪均匀剪除T9处一段脊髓组织,形成2 mm间隙[10]。 ①SHAM组(仅去除T8-9椎板,n=8);②SCI only组(形成2 mm间隙,不治疗,n=8);③实验组A:SHEDs组(在2 mm间隙内植入SHEDs聚合体,n=12);④实验组B: UCMSCs组(在2 mm间隙内植入UCMSCs聚合体,n=12); 之后分层缝合。大鼠苏醒后双后肢瘫痪,拖行。术后1 周腹腔注射庆大霉素防感染(1 次/d);按压膀胱辅助排尿(2 次/d)直至自主排尿功能恢复。
1.6.2 观察指标 ①行为学评分: 实验大鼠分别在术后1~8 周每周进行行为学评分,采用BBB评分法评价大鼠脊髓神经运动功能恢复情况。将大鼠逐只放至开放场地中,每只5 min, 2 名实验员进行盲评。 0-7: 关节是否动(髋,膝,髁;幅度,频率); 8-14:脚掌能否着地,着地后能否运动,运动协调否; 15-18:脚尖能否抓地,脚尖与前进方向是否一致,前后肢运动是否协调; 19-21:运动时躯干稳定否,尾巴翘不翘。②组织切片观察: 实验动物于术后第8 周麻醉,经心脏灌注固定后取出损伤区脊髓组织(2 cm),酒精梯度脱水,石蜡包埋,切片,行HE染色观察脊髓损伤修复情况。
1.7 统计学分析
实验数据采用SPSS 13.0软件进行统计分析,两独立样本均数比较采用t检验,多样本均数比较采用ANOVA方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 细胞分离培养与鉴定
分离培养的SHEDs,UCMSCs细胞有良好的贴附塑料培养皿生长特性,在镜下呈长梭形,放射状或旋涡状排布(图1A)。生长曲线:前5 d SHEDs增殖活力明显高于UCMSCs(P<0.05), 6~7 d进入平台期(图1B)。 通过流式细胞术鉴定表型,间充质干细胞表面标志物CD29, CD90, CD105为阳性表达,造血或内皮细胞标志物CD31, CD34, CD45为阴性表达(图1C)。
2.2 细胞聚合体特征
用含VC的培养基诱导一周后,SHEDs,UCMSCs形成完整的细胞聚合体,表现为膜样形态,可在培养皿的边缘分离,并能用镊子机械撕除大体观见图2。HE染色显示聚合体由多层细胞构成,含大量细胞外基质;且SHEDs聚合体比UCMSCs聚合体厚见图2。与CCK-8检测细胞增殖结果一致。
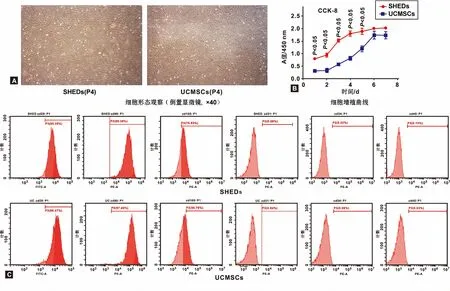
图1 SHEDs和UCMSCs培养与鉴定
2.2.1 RT-PCR BDNF, NGF, NTF3, GDNF等基因,在SHEDs细胞中表达明显高于UCMSCs,有统计学差异(P<0.01); bFGF, CNTF在UCMSCs高表达(P<0.05)(图3A)。
2.2.2 ELISA 第3 天和第7 天时BDNF和NGF的分泌SHEDs均高于UCMSCs,有显著统计学差异,尤其是第7 天时差异更明显(P<0.01)。且随时间延长,BDNF,NGF分泌量增多,第7 天SHEDs的NGF分泌量显著高于第3 天(P<0.05)(图3B)。
2.3 行为学评分
SCI组大鼠脊髓全横断损伤后,双后肢完全瘫痪,BBB评分前2 周基本为0;随时间延长,有一定程度恢复,但评分不超过3。SHAM组术后运动功能轻度受损, 3 周后基本恢复正常。SHEDs组和UCMSCs组与SCI组相比,均有明显恢复,有显著统计学差异(P<0.001; 2 组均从第3 周开始出现明显恢复,至第7 周进入平台期,最高评分分别达8 分、6 分; 且在第3、 4、 5、 7、 8 周时2 组BBB评分有显著统计学差异(P<0.01)(图4)。由此可见,SHEDs组比UCMSCs组疗效好。
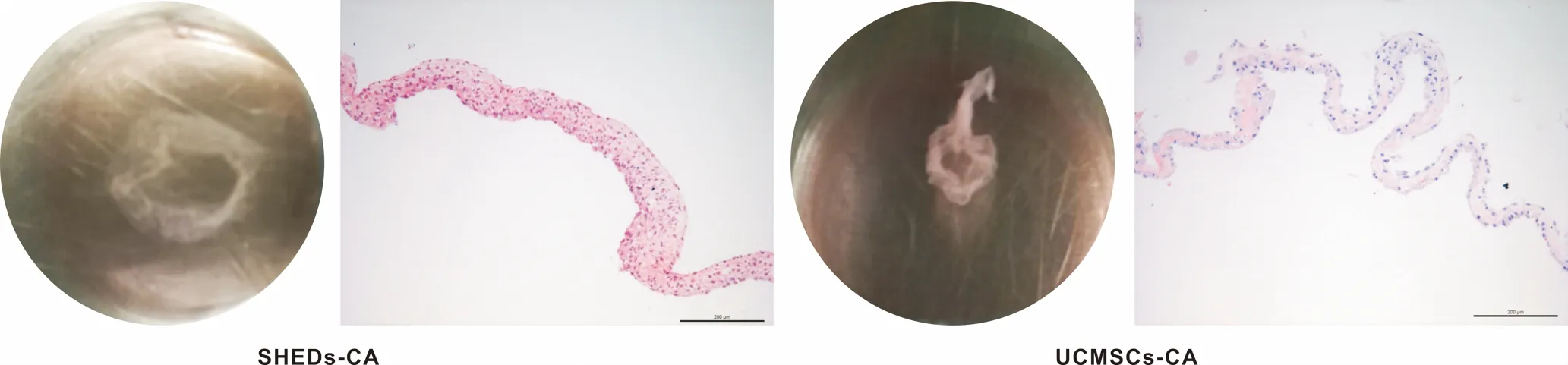
图2 体外成聚合体诱导培养7 d后机械撕除大体观及聚合体纵断面 (HE, ×5)
Fig 2 Cell aggregates induced for 7 daysinvitroand mechanically teared into longitudinal sections of cell aggregates (HE, ×5)
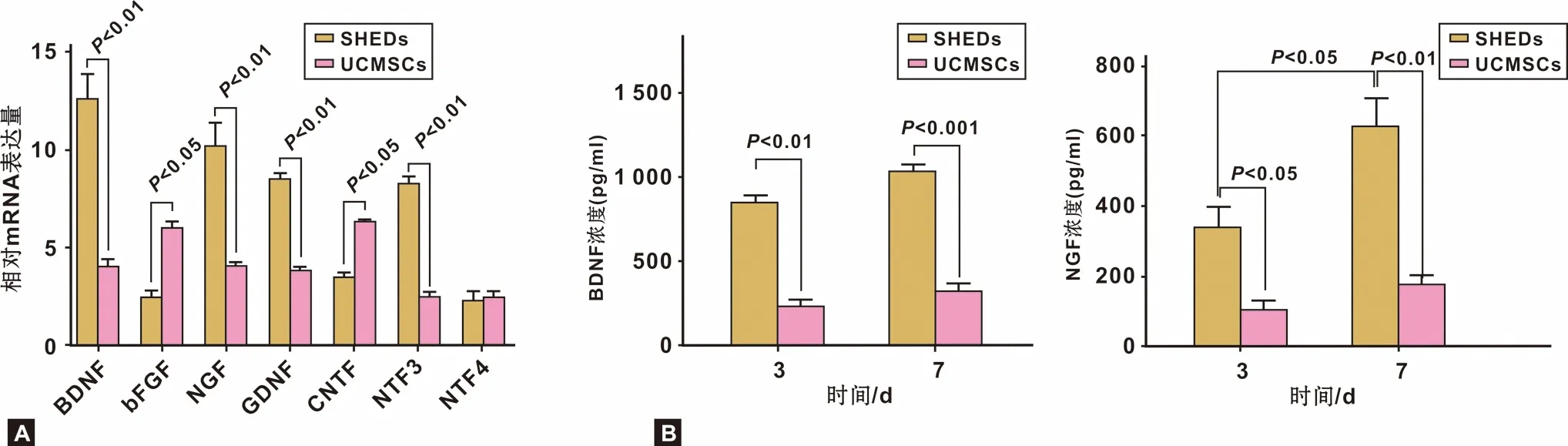
图3 SHEDs和UCMSCs神经营养因子表达
2.4 HE结果
与SCI组比,SHEDs, UCMSCs聚合体移植后有效减小损伤区域面积;且脊髓损伤区两断端逆行性损伤病灶大小:SHEDs组明显小于UCMSCs组。高倍镜下脊髓损伤后,在白质中可见大量空洞形成且有许多细胞碎片,SCI组空洞多且面积大,组织杂乱,SHEDs,UCMSCs组空洞小而密集(图5a1~a4); 灰质中,神经元胞体退化凋亡,尼氏体崩解,但SHEDs组比UCMSCs组胞体损伤少,存留蓝染的尼氏体数目多(图5b1~b4);损伤中心,分散的群落状的星形胶质细胞(拥有巨大的细胞核及纤维状细胞质和细小突触)及成纤维细胞形成大量瘢痕组织,UCMSCs组的瘢痕组织更为致密(图5c2~c4); 损伤区域大量炎症细胞浸润,SHEDs组炎症浸润面积较UCMSCs组小(图5d2~d4); SHEDs组损伤区靠近脊髓断端处可见类似脊髓组织样结构生成,UCMSCs组可见成簇的细胞聚合体及周围大量炎症细胞浸润带,未见明显的再生脊髓样组织(图5e4)[11]。
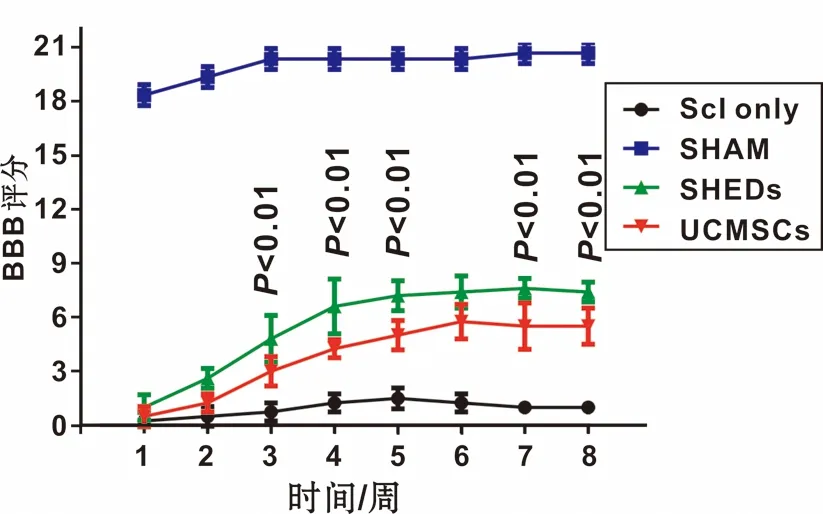
图4 大鼠运动功能BBB评分
3 讨 论
脊髓损伤是一类高发病率, 高致残率的中枢神经系统疾病,严重影响患者生活质量,给家庭和社会带来沉重负担。脊髓损伤后机体经历原发性损伤和继发性损伤,造成不同程度的神经元和胶质细胞的坏死、凋亡,脱髓鞘,以及微环境对再生修复的抑制,胶质瘢痕对轴突再生的阻碍等,加上中枢神经系统的自我修复能力极差[1],所以对脊髓损伤的修复任重道远。目前临床上对脊髓损伤常用的治疗方法有:早期手术减压,大剂量糖皮质激素及神经营养类药物治疗,理疗等,但效果都不尽如人意,且不能实现真正的脊髓再生;而细胞移植有望实现神经再生,是一种很有前景的治疗方式[4]。
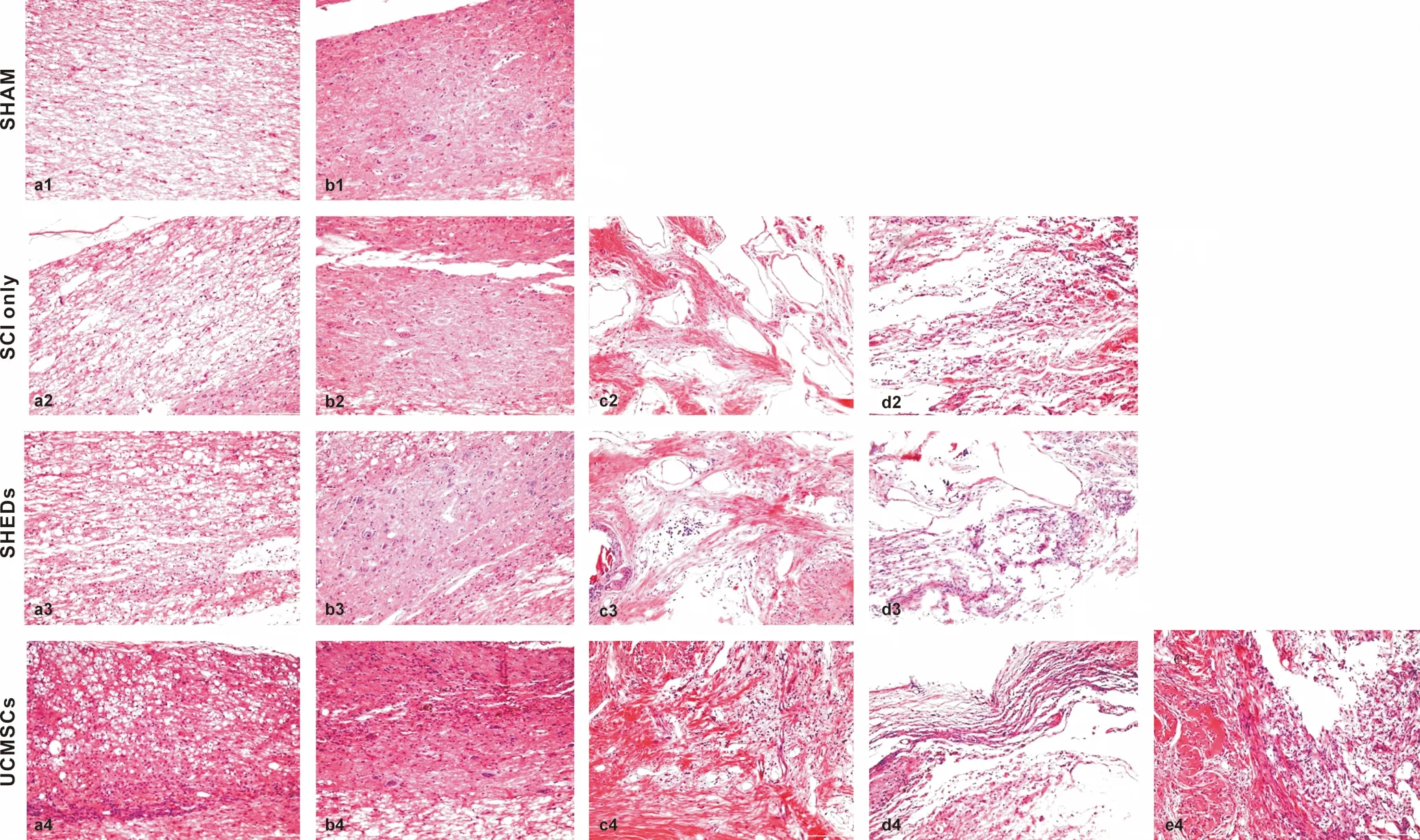
a: 白质,神经纤维; b: 灰质,神经元胞体聚集区,尼氏体; c: 瘢痕组织; d: 损伤区域炎症细胞浸润; e: 再生脊髓样组织
图5 脊髓损伤修复的组织学观察 (HE, ×200)
a: White matter, nerve fibers; b: Bray matter, neuron cell bodies, Nissl; c: Scar Tissue; d: Inflammatory infiltration in injured areas; e: Regenerative spinal cord tissue
Fig 5 Histological observasion of spinal cord injury after treatment in the groups (HE, ×200)
UCMSCs和SHEDs因具有良好的间充质干细胞特性,能分泌多种神经营养因子,可诱导分化为神经细胞,且有来源优势,在脊髓损伤治疗中有越来越多的应用[3-4,12],但对于两者的疗效比较及相关机制研究较少。本实验通过比较二者体外生物学特征及体内移植后的功能恢复情况,对此进行初步探讨。
本研究实验结果表明:SHEDs比UCMSCs有更好的增殖能力,RT-PCR显示:与轴突再生密切相关的神经营养因子基因BDNF,NGF,NTF3,GDNF等,在SHEDs细胞中明显高表达;而另外一些基因:bFGF,CNTF在UCMSCs细胞高表达。蛋白水平的检测结果也相一致,SHEDs细胞分泌BDNF,NGF的能力明显强于UCMSCs。
同时本研究创新性地利用细胞聚合体技术来修复脊髓损伤,减少了外源性支架的不利影响,便捷高效,体内移植疗效与之前研究相当[3,12],治疗8 周后BBB评分高达8 分。HE结果也显示损伤区域面积减小,瘢痕组织减少,并且SHEDs组出现疑似再生脊髓样组织。细胞聚合体有干细胞龛的作用,细胞连接充分,大量细胞外基质为其提供营养物质,更利于细胞的增殖和分化[7]。SHEDs组疗效优于UCMSCs组,可能因为SHEDs是神经嵴起源的细胞,已有大量研究表明其表达神经元及神经胶质细胞标志物,是治疗神经损伤及退行性疾病的理想资源[13]。
本实验通过对UCMSCs和SHEDs聚合体在增殖,神经营养因子表达及体内移植后运动功能评定和组织学观察等方面的比较研究,发现二者以聚合体形式治疗大鼠脊髓全横断损伤是可行的,并且很有效,SHEDs疗效要优于UCMSCs,为临床治疗提供新思路。二者可能是通过旁分泌功能发挥作用,不过具体机制还有待进一步探究。
