不同严重程度变应性鼻炎小鼠模型的制备*
2019-04-09熊亚军金日群彭韶平
熊亚军,金日群,彭韶平
(赣南医学院1.2016级硕士研究生;2.第一附属医院耳鼻咽喉头颈外科,江西 赣州 341000)
变应性鼻炎(allergic rhinitis,AR)作为一种危害人类健康和生活质量的全球性问题,已影响世界人口总数的10%~40%,且有逐年增加的趋势[1]。到目前为止,AR仍不能被完全治愈,根本原因在于其发病机制复杂多样,包括遗传因素、免疫因素、环境因素等。为了进一步深入了解AR的发病机制,寻找更好的治疗方案,国内外科研工作者们对于AR的研究从未停歇。但是,由于受到研究对象的限制,很多研究不能直接在人体内进行,所以动物模型的制备就成了研究AR的一种必不可少的手段。
AR的临床分类方法有很多种,包括按变应原的类别、症状出现的时间、疾病的严重程度[2]等,而目前尚缺乏不同严重程度的AR动物模型的制备,因此,我们在基础致敏后,通过延长鼻部激发的时间来探索不同严重程度AR动物模型的制备。现介绍如下。
1 材料与方法
1.1实验动物及分组BALB/c小鼠32只,6~8周龄,雄性,清洁级,体重16~20 g,由赣南医学院实验动物中心提供[实验动物使用许可证SYXK(赣)2018-0004]。将32只小鼠随机分为4组,每组8只,分别记为A组(对照组)、B组(模型组Ⅰ)、C组(模型组Ⅱ)和D组(模型组Ⅲ)。
1.2主要试剂与药品卵清蛋白(美国Sigma,A5503),氢氧化铝粉末(国药,AR20001060),乙二胺四乙酸二钠(北京索莱宝,E8030),小鼠卵清蛋白sIgE ELISA检测试剂盒(上海江莱科技,JL20466),苏木素-伊红(HE)染色试剂盒(北京索莱宝,G1120)。
1.3主要仪器多功能酶标仪(美国ThermoFisher Varioskan LUX),倒置荧光显微镜(德国LEICA DMi8),组织包埋机(浙江金华益迪医疗设备厂,YD-6D),冷冻台(浙江金华益迪医疗设备厂,YD-6L),三孔电热恒温水槽(上海一恒,DK-8D)。
1.4实验方法将含有50 μg卵清蛋白和2 mg氢氧化铝佐剂的生理盐水悬浊液200 μL,于第1、8、15天行腹腔注射致敏共3次,间隔7天后,于第22天开始用5%的卵清蛋白生理盐水溶液连续鼻部激发7天(B组),14天(C组)和21天(D组),每天1次,每次每侧鼻腔各10 μL。对照组(A组)腹腔致敏与鼻部激发均使用生理盐水进行。
1.5标本和数据采集每组小鼠在最后一次鼻部激发后,由实验外不知情人员对各组的行为表现(挠鼻、流涕、喷嚏)进行观察5 min,并做好记录(积分>5表示造模成功,行为学评分标准见表1)。末次激发24 h后处死小鼠取材:摘眼球取血用于血清卵清蛋白sIgE的ELISA检测;剪下整个鼻部于4%多聚甲醛溶液固定24 h后,10%EDTA脱钙液内脱钙2周,每两天更换脱钙液1次,用于后续的组织形态学观察。

2 结 果
2.1行为学评分模型组和对照组比较,模型组的行为学评分均较对照组明显升高(P<0.05);模型组间比较,随着鼻部激发时间的延长,行为学评分逐渐增高(P<0.05)(见表2)。

表1 小鼠行为学评分标准

表2 4组小鼠变应性鼻炎行为学评分的比较
注:与A组比较,*P<0.001;与B组比较,#P<0.001;与C组比较,△P<0.05。
2.2鼻粘膜组织形态学苏木素伊红(HE)染色病理切片显示,模型组鼻粘膜增生,上皮细胞结构紊乱,基底细胞排列紊乱甚至破坏,毛细血管扩张,腺体增生,固有层水肿,并可见大量以嗜酸性粒细胞为主的炎性细胞浸润。对照组鼻粘膜上皮完整,基底细胞正常,未见肿胀,无毛细血管扩张,无腺体增生,无或少许炎症细胞浸润(见图1)。
2.3血清卵清蛋白sIgE 模型组和对照组比较,模型组的血清卵清蛋白sIgE含量明显高于对照组(P<0.05);模型组间比较,鼻部激发时间越长,血清卵清蛋白sIgE含量越高(P<0.05)(见表3)。

表3 4组小鼠血清卵清蛋白sIgE含量的比较
注:与A组比较,*P<0.001;与B组比较,#P<0.01;与C组比较,△P<0.001。
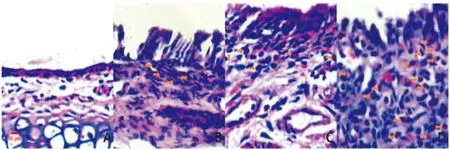
A.(对照组)上皮完整,粘膜下少量炎症细胞浸润,无嗜酸性粒细胞浸润;B.(模型组Ⅰ)上皮不完整,鼻粘膜增生,粘膜下嗜酸性粒细胞浸润;C.(模型组Ⅱ)鼻粘膜增生,基底细胞排列紊乱,粘膜下毛细血管扩张,腺体增生,嗜酸性粒细胞浸润;D.(模型组Ⅲ)上皮细胞结构紊乱,基底膜破坏,固有层水肿,并见大量嗜酸性粒细胞浸润。黄色箭头表示嗜酸性粒细胞。
图1小鼠鼻粘膜切片(HE染色)
3 讨 论
由于受到多种因素限制, AR的许多研究并不能直接在人体内进行,因此寻找最接近人类发病过程和机理的动物模型是我们深入了解AR的必经之路。目前文献所报道的AR动物模型,根据致敏原、实验动物、致敏方法等的不同而存在有多种制备方式。致敏原包括甲苯二异氰酸酯、卵清蛋白、豚草花粉等,目前最常用到的是卵清蛋白;实验动物包括豚鼠、大鼠、小鼠、新西兰兔等,其中豚鼠是最早用于建立AR模型的动物,而现在最常见的实验动物选择是小鼠,因为相比别的造模动物而言,小鼠对外来刺激敏感、繁殖能力强、基因组绘制已完成且与人类基因有着较高的同源性,同时由于基因敲除技术的出现与发展,基因敲除小鼠已成为研究人类疾病发病机制的重要对象[3-5]。虽然,目前对于AR动物模型的建立总的来说已比较成熟,但是仍未达成统一的标准,且还存在有许多需要继续完善的方面,而对于不同严重程度AR动物模型的建立就是其中之一。
AR作为一种特异性个体接触变应原后由IgE介导的介质释放,并有多种免疫细胞和细胞因子等参与的变态反应性疾病[6-7],其往往根据接触变应原的频次、时间等的不同而表现出不同的症状。当变应原再次进入机体时,与sIgE结合引起肥大细胞脱颗粒并释放多种炎症因子,这些炎症因子与鼻粘膜作用后,可引起鼻痒、流清涕、打喷嚏和鼻塞等症状,另外,肥大细胞还可持续释放活性递质,促使Th2细胞、嗜酸性粒细胞等向鼻粘膜组织迁移,造成鼻粘膜组织形态学上的改变[8-9]。临床上常按照AR症状的严重程度不同,将其分为轻度和中-重度[2,10-11]。并且由于严重程度的不同,AR患者的治疗方案选择也往往存在差异。我们通过延长变应原鼻部激发时间,模拟人类AR患者长期反复接触变应原的过程,建立不同严重程度的AR模型,然后通过造模后的症状表现、鼻粘膜的组织形态学改变和血清sIgE水平来评价是否成功。其中sIgE作为AR发病机制中的一种关键分子,其水平的高低不仅能够诊断AR,而且还能反映AR的严重程度[5,12-14]。
本研究结果显示,用卵清蛋白致敏并激发后,模型组小鼠的行为学评分、血清卵清蛋白sIgE的含量均较对照组明显增加(P<0.05),同时,不同鼻部激发时间的模型组之间的行为学评分、血清卵清蛋白sIgE的含量也存在差异,激发时间越长的组值越高(P<0.05),另外,随着激发时间的延长,小鼠鼻粘膜组织形态学改变也越明显。以上结果表明,通过延长鼻部激发的时间,可以增加AR模型小鼠的严重程度。
综上,通过延长鼻部激发时间,可以建立不同严重程度的AR模型,但是本研究也存在一些不足之处:①本次实验以生理盐水鼻部激发7天作为对照组,未设定鼻部激发14天和21天的对照组;②仅延长激发期,而未做延长致敏期的对比实验等,所以我们仍需继续努力完善AR动物模型的建立和机制的研究,为临床上预防和治疗AR打下坚实基础。
