杜仲多糖对神经病理性疼痛模型大鼠的镇痛作用*
2019-04-09江增宏周民举
江增宏,周民举
(1.合肥职业技术学院,安徽 合肥 230000;2.巢湖市中医院,安徽 巢湖 238000)
神经病理性疼痛是由感觉神经系统疾病或损伤引起的疼痛,严重影响病人的生活质量并造成个人和社会的经济负担[1]。与急性疼痛不同,神经病理性疼痛是一种慢性疼痛,这对于治疗是个巨大的挑战[2]。近年来,人们越来越认识到非神经元细胞如免疫细胞(巨噬细胞和淋巴细胞)和神经胶质细胞(星形胶质细胞和小胶质细胞)在慢性疼痛中起着关键作用[3]。神经损伤后引起脊髓小胶质细胞和星形胶质细胞的活化,释放神经介质诱发神经病理性疼痛[3]。大量的研究表明激活MAPKs(p38、ERK、JNK)在神经病理性疼痛的发生、发展过程中发挥重要作用[4]。神经损伤或脊髓受损时都能诱导脊髓MAPKs磷酸化水平增加。MAPKs通过激活不同类型的胶质细胞调节慢性疼痛进程的不同阶段[5]。在动物模型中,抑制p38、ERK或者JNK均能抑制慢性疼痛[5]。
杜仲多糖(Eucommia ulmoides Oliv Polysaccharide,EOP)是从中药杜仲干燥树皮中提取的活性成分,有研究发现其具有提高免疫、抗炎、抗肿瘤、降血糖的药理作用[6-7],此外,还有研究发现其具有镇痛作用[8]。本实验利用神经病理性疼痛经典CCI模型,探索杜仲多糖是否抑制CCI大鼠的机械学痛觉超敏,并浅析其可能的镇痛机制。
1 材料与方法
1.1主要药品与试剂EOP由我院天然药化实验室采用水提醇沉法提取,含量54.23%。GAPDH抗体(Bio-Rad公司),p-p38抗体(Millipore公司),p-JNK抗体(Cell Signaling Technology公司),p-ERK抗体(Cell Signaling Technology公司),兔抗、鼠抗(R&D公司),IBA-1兔源抗体(Abcam公司),GFAP鼠源抗体(Millipore公司),驴抗兔荧光二抗、驴抗鼠荧光二抗(Jackson Lab公司)。
1.2实验动物与分组健康成年雄性Sprague-Dawley(SD)大鼠,体重在160~240 g之间,购于浙江省实验动物中心,对动物处置符合动物伦理学的标准。随机将SD大鼠分成对照组、模型组和EOP给药组,EPO给药有3个剂量:低剂量(60 mg·kg-1)、中剂量组(120 mg·kg-1)、高剂量组(240 mg·kg-1)。
1.3神经病理性疼痛模型制备参照文献[9]制备坐骨神经慢性压迫(CCI)模型:成年大鼠腹腔注射水合氯醛麻醉后,钝性纵向分离肌肉直至暴露坐骨神经,羊肠线(4.0)轻度结扎坐骨神经中段,共4道。对照组分离暴露坐骨神经不行结扎。术后7天用Von Frey 测痛包(美国DanMic Global公司)测定机械阈值下降40%以上视为造模成功,投入实验。
1.4机械缩足反应阈测定方法测定:现将实验大鼠放入有机玻璃箱,待稳定后,用Von Frey纤维丝垂直刺激双足底中部,刺激力度从低到高,出现抬足或添足即为阳性。造模7天后,模型组腹腔注射生理盐水2 mL,EOP低剂量给药组、EOP中剂量给药组、EOP高剂量给药组,分别测定3组给药后0.5 h,2 h,4 h,8 h,24 h的机械缩足反应阈。
1.5蛋白定量检测造模后14 d每组取4只大鼠,对照组和模型组腹腔注射生理盐水2 mL,EOP给药组(120 mg·kg-1),2 h后水合氯醛麻醉后,取L4~6脊髓,-80 ℃冰箱保存,采用western blot方法检测脊髓中p-p38、p-JNK和p-ERK的蛋白表达。
1.6免疫荧光标记造模后14 d开始,对照组、模型组和EOP给药组分别腹腔给予生理盐水、生理盐水和EOP(120 mg·kg-1)连续腹腔给药5 d,每天一次,于第5 d给药后2 h取材。大鼠水合氯醛麻醉后,用0.01MPBS和4%多聚甲醛缓冲液灌注后,取L4~6脊髓固定、脱水、包埋、切片(荧光片厚30 μm),每个标本取3张分别进行IBA-1和GFAP的免疫荧光标记,用Image J软件进行平均荧光强度的计算。
1.7统计学方法采用SPSS 19.0软件统计分析,两两组间采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1不同剂量杜仲多糖单次给药对CCI大鼠机械学痛觉超敏的影响由图1所示,和模型组相比,3个剂量的EOP单次腹腔给药都有明显的镇痛作用(P<0.05),且表现出剂量相关性,高剂量给药组给药后2 h镇痛作用几乎可以逆转CCI诱导的机械学痛觉超敏。此外,中、高剂量组镇痛作用长达4 h。
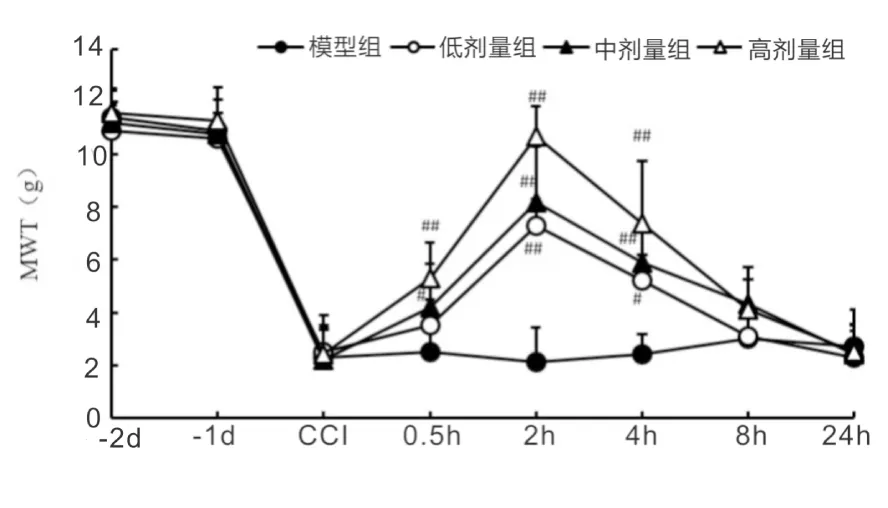
注:组间采用t检验,与模型组相比,# P<0.05,## P<0.01。
2.2杜仲多糖多次给药对CCI活化的胶质细胞的影响免疫荧光标记结果(图2)显示:与对照组相比,造模后脊髓小胶质细胞和星形胶质细胞均明显活化(P<0.05);但是EOP(120 mg·kg-1)连续给药5 d后,CCI大鼠脊髓背角星形胶质细胞活化明显减轻(P<0.05),但是对于CCI活化的小胶质细胞EOP连续给药没有显著影响(P>0.05)。
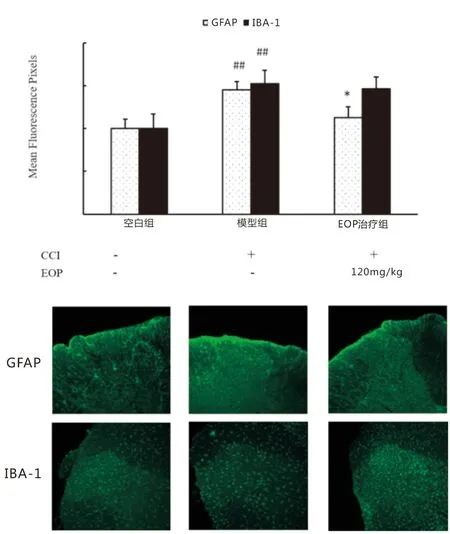
注:与对照组相比,# P<0.05,## P<0.01;与模型组相比,*P<0.05,**P<0.01。
2.3杜仲多糖对CCI大鼠脊髓p-p38、p-JNK、p-ERK蛋白水平表达的影响免疫蛋白印记结果(图3)所示:与对照组相比,模型组大鼠脊髓的p-p38、p-JNK、p-ERK三种蛋白表达水平均显著升高(P<0.05)。EOP低剂量给药组对CCI诱导的脊髓MAPKs蛋白高表达水平没有明显影响。中、高剂量EOP给药组能够显著降低模型组升高的p-JNK和p-ERK蛋白水平(P<0.05),但是对CCI模型脊髓p-p38的高表达水平没有显著作用(P>0.05)。
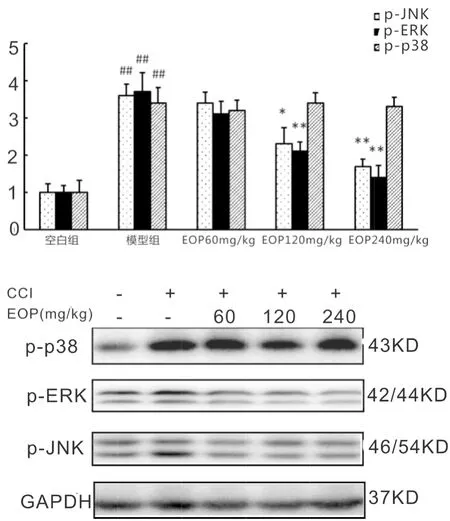
注:与对照组相比,# P<0.05,## P<0.01;与模型组相比,*P<0.05,**P<0.01。
3 讨 论
杜仲具有补肝肾,治腰脊酸疼,安胎等功效,药用部位为干燥皮,杜仲多糖为杜仲干燥皮的水溶性多糖成分。现代药理学研究表明其具有良好的免疫调节,抗肿瘤以及降血糖的作用[6-7]。周程艳等[8]研究发现杜仲水提取物对热板致痛、醋酸致痛模型有抗炎镇痛效果。
本研究发现杜仲多糖能够对神经病理性疼痛的机械学超敏有抑制作用,并且具有剂量依赖性,高剂量给药几乎可以逆转CCI诱导的神经病理性疼痛机械学超敏,如图1所示,因此,本研究证实杜仲多糖对于CCI诱导的神经病理性疼痛具有镇痛作用。
神经病理性疼痛发生发展研究经历漫长的过程,起初研究者们普遍认为慢性疼痛的病理生理机制只和神经元异常兴奋诱导的损伤、凋亡有关[1]。但是,后来越来越多的研究证实,除了神经元,脊髓胶质细胞主要是星形胶质细胞和小胶质细胞在神经病理性疼痛的病理过程中也发挥着至关重要作用[5]。其中,神经损伤时,引起脊髓背角星形胶质细胞(占胶质细胞总数的40%~50%)大量活化,它表现为神经胶质纤维酸蛋白(Glial fibrillary acidicprotein,GFAP)表达上调[10]。本文探索了杜仲多糖对CCI诱导活化的小胶质细胞和星形胶质细胞的影响,GFAP为星形胶质细胞标记物,而IBA-1为小胶质细胞标记物。在免疫荧光技术下,我们发现杜仲多糖主要抑制了CCI诱导的星形胶质细胞活化发挥镇痛作用。
丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路是被证实在神经病理性疼痛诱导的胶质细胞活化过程中重要的通路之一[4]。MAPK信号通路包括p38丝裂原活化蛋白激酶(p38)、c-Jun 氨基末端激酶(c-Jun amino-terminal kinase,JNK)、细胞外信号调节激酶1/2(Extracellular signal-regulated kinase1、2 ,ERK)三个主要成员。研究表明MAPK三个主要成员在胶质细胞上的分布具有自身特点,神经损伤,术后疼痛,吗啡耐受模型等脊髓背角小胶质细胞上p-p38表达显著上调[11]。小胶质细胞表达的主要是p38β亚型,而p38α亚型主要表达在神经元和坐骨神经。目前研究JNK有三种亚型,其中JNK1主要表达在星形胶质细胞上[12],实验表明,神经损伤后星形胶质细胞和DRG神经元上JNK持续激活[12]。而ERK的表达较为有趣,早期的ERK激活在小胶质细胞,而神经损伤后期ERK又转变到星形胶质细胞[13]。本实验探索了EOP对MAPK信号通路三个成员的影响,发现EOP对神经损伤后高表达的p-JNK和p-ERK有抑制作用,而对p-p38没有明显抑制作用,其结果表明,EOP的镇痛作用与JNK/ ERK MAPK信号通路有关,这可与免疫荧光结果有关,EOP仅能显著抑制星形胶质细胞的活化相同。
