高分辨率磁共振和动态对比增强磁共振在直肠癌T分期中的价值研究
2019-04-09崔翔翟建朱超王诗卉
崔翔,翟建,朱超,王诗卉
(1.皖南医学院研究生院,安徽 芜湖 241001;2.皖南医学院弋矶山医院放射科)
直肠癌是较为常见的消化系统恶性肿瘤之一,它的发病率和死亡率在所有消化道恶性肿瘤中占有很大的比例[1]。我国直肠癌的发病率近几年的上升趋势非常明显,多见于50岁以上的老年人[2]。高分辨率磁共振(HR-MRI)在直肠癌的术前诊断、分期和预后中起着重要作用,已成为用于综合评估直肠癌的重要成像工具[3]。动态对比增强磁共振(DCE-MRI)作为常规MRI的补充,可以反映肿瘤的血流灌注情况,并且可以对直肠癌的分期进行定量评估,近几年来逐渐成为研究热点[4]。本文针对HR-MRI对直肠癌的术前T分期以及DCE-MRI对直肠癌T分期的预测价值进行研究与探讨。
1 资料与方法
1.1 研究对象 选择2017年3月至2018年2月皖南医学院弋矶山医院经结直肠镜活检确诊为直肠腺癌的患者70例为研究对象,其中男50例,女 20例,年龄 36~84岁,平均年龄(60.8±10.6)岁,患者主要因为不同程度的腹痛、便血以及大便性状的改变等临床症状来我院就诊。患者均接受了HR-MRI扫描;其中30例患者接受了DCE-MRI扫描,男22例,女8例,年龄44~84岁,平均年龄(61.2±10.9)岁。所有患者均于检查后1周内进行外科手术,并且术后病理均证实为直肠癌。
1.2 纳入标准 (1)经我院结直肠镜活检确诊为直肠癌,并排除其它肿瘤病史;(2)行MRI检查前未采取任何治疗措施;(3)没有对比剂过敏病史。
1.3 排除标准 (1)因患者身体状况不佳,配合欠佳,而致使MRI图像存在伪影者;(2)经MRI检查后,未在本院进行手术治疗的患者;(3)术后标本没有完整病理资料的患者。
1.4 方法
1.4.1 扫描方法 为了减轻患者痛苦,无特殊要求,不主张检查前清洁肠道,为了充分显示膀胱壁与直肠的关系,应使膀胱处于充盈状态。所有患者均接受了GE公司3.0T磁共振的HR-MRI扫描,扫描范围从直肠-乙状结肠交界处至肛门,所有患者采用仰卧位,先进行高分辨T2WI矢状位扫描,然后用高分辨T2WI矢状位定位,进行高分辨T2WI横轴位及冠状位的扫描。进行DCEMRI扫描的患者,先在横轴位上采用LAVA序列进行 3°、6°、9°、12°及 15°多个翻转角的扫描,然后在12°翻转角上进行动态增强的扫描,连续扫描30个扫描时相,每期10 s。
1.4.2 扫描参数 高分辨T2WI矢状位(见图1、4):TR=3 000 ms,TE=80 ms,FOV=24 cm,矩阵=384×224,层厚∕层间距=3.0 mm∕0.5 mm,NEX=4;高分辨 T2WI横轴位(见图 2、5):TR=3 000 ms,TE=80 ms,FOV=20 cm,矩阵=384×224,层厚∕层 间 距 =3.0 mm ∕0.5 mm,NEX=4;高 分 辨T2WI冠状位(见图 3、6):TR=3 000 ms,TE=80 ms,FOV=20 cm,矩阵=384×224,层厚∕层间距=3.0 mm∕0.5 mm,NEX=4;DCE-MRI:TR=3.0 ms,TE=1.5 ms,FOV=36 cm,层厚∕层间距=3.0 mm∕1.0 mm;在扫描开始的同时注射造影剂,注射流速为 3.0 ml∕s,注射造影剂后用 20 ml生理盐水冲洗。
1.5 HR-MRI直肠癌T分期标准 参考直肠癌病理T分期的标准[5],HR-MRI直肠癌各期的影像表现如下。(1)T1期:黏膜层和黏膜下层增厚,高分辨T2WI图像上显示肿瘤信号低于高信号的黏膜下层;(2)T2期:肿瘤组织侵入固有肌层但未穿透,高分辨T2WI图像上显示周围脂肪界面完整;(3)T3期:肿瘤组织穿透肌层,高分辨T2WI图像上显示固有肌层与周围脂肪之间的界面模糊,呈点条状、结节状改变;(4)T4期:高分辨T2WI图像上显示肿瘤组织侵入邻近组织和器官。然而,在实际的工作中,HR-MRI区别T1期与T2期的准确率不高,因此将两者合并成≤T2期,判断的标准是肿瘤组织局限于直肠壁,而与周围的脂肪交界面完好。
1.6 图像评价及后处理
1.6.1 HR-MRI图像评价 70例直肠癌患者的HR-MRI图像采用双盲法由2名高年资磁共振诊断医师进行评价,根据肿瘤的HR-MRI表现,进行影像T分期,当两者的评价结果不一致时,需经讨论达成一致意见后得出最终的结果。
1.6.2 DCE-MRI图像后处理 将 DCE-MRI扫描所得图像使用软件(Omni-Kinetics GEHealthcare)进行后处理。根据操作步骤,按顺序将5个翻转角的平扫和动态增强的图像导入软件,选择双室模型(Extended Toffs Linear),在最接近肿瘤的肠系膜下动脉小分支动脉处选取感兴趣区域(region ofinterest,ROI),ROI面积为 3~5 mm2,单击曲线功能键可自动计算动脉输入函数(AIF)。然后,在原始图像上选择对比最明显的病变层面并点击计算,以获得反映定量参数值大小的相应层面伪彩图(见图7~9),接着,通过在原始图像的相应拟测量区中勾画ROI,可以获得容量转移常数(Ktrans)、速率常数(Kep)和细胞外血管外间隙容积比(Ve)的定量参数数值。记录每个ROI的定量参数值,将测量重复3次并取平均值。在勾画ROI时,应尽量避开囊变、坏死及出血区,ROI面积为30~50 mm2。肿瘤T分期的标准为2016年国际抗癌联盟(International Union Against Cancer,UICC)发布的第8版恶性肿瘤的TNM分期系统[6]。
1.7 统计学方法 应用SPSS 23.0软件进行统计学分析。计量资料用均数±标准差表示,采用t检验;若数据均符合正态分布,采用单因素方差分析;计数资料用率(%)表示,采用χ2检验,P<0.05为差异有统计学意义。计算准确性、敏感度、特异度、差异阳性预测值(PPV)、阴性预测值(NPV);运用Kappa检验比较HR-MRI与病理检查的一致性,P<0.05为差异有统计学意义。
2 结果
2.1 HR-MRI对直肠癌术前T分期与术后病理T分期的比较 70例行HR-MRI扫描的直肠癌患者中正确分期60例,包括≤T2期19例,T3期36例和T4期5例;错误分期10例,包括≤T2期中5例,均为分期过度;T3期中4例,其中2例分期不足,2例分期过度;T4期1例,为分期不足。见表1。HR-MRI对直肠癌术前T分期与病理T分期的一致性评价使用Kappa检验。显示HR-MRI对直肠癌术前T分期与病理分期结果的一致性均较好,其中≤T2 期:Kappa为0.771,P<0.05,准确性90.00%,敏感度79.17%,特异度95.65%,阳性预测值(PPV)90.48%,阴性预测值(NPV)89.80%;T3期:Kappa为 0.736,P<0.05,准确性 87.14%,敏感度 90.00%,特异度 83.33%,PPV87.80%,NPV 86.21%;T4 期:Kappa为 0.683,P<0.05,准确性94.29%,敏感度 83.33%,特异度 95.31%,PPV 62.50%,NPV 98.39%。见表 2。
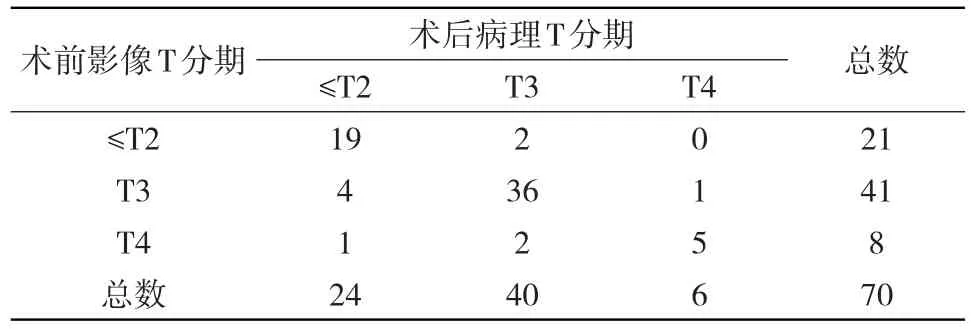
表1HR-MRI对直肠癌术前T分期与病理T分期的结果对照
2.2 DCE-MRI定量参数与术后病理T分期的比较

表2 HR-MRI对直肠癌术前T分期的诊断效能
30例进行DCE-MRI扫描的患者术后病理结果:≤pT2期11例,pT3期15例,pT4期4例。伴随着直肠癌病理T分期的升高,Ktrans、Kep值不断升高,差异有统计学意义;不同T分期的Ve值差异无统计学意义,见表3。

表3 不同术后病理T分期各定量参数值的差异
3 讨论
3.1 HR-MRI在直肠癌术前T分期的应用价值HR-MRI没有明确的定义,通常所谓的高分辨只是相对于常规磁共振而言。一般而言,小视野(FOV)、层厚的适度减小以及提高矩阵,便可以改善MRI图像的分辨率。本研究采用小FOV(20~24 cm)、大矩阵(384×224)、薄层厚(3 mm)、小层间距(0.5 mm)和多激励次数(NEX=4)的扫描参数,与传统的MRI扫描相比,图像分辨率得到明显改善,并且可以保持良好的图像信噪比[7]。正常直肠在磁共振轴位图像上表现为类圆形或椭圆形、边缘光整、厚度≤5 mm的环状结构,在磁共振矢状位和冠状位图像上表现为长条状结构。直肠癌在MR上的主要表现是直肠壁弥漫性或偏心性的增厚,肠管狭窄,或肠腔内管结节状、团块状的稍长T1、稍长T2异常信号影,信号一般欠均匀;如果癌肿穿透肠壁,其主要表现为低信号的固有肌层与周围高信号的脂肪组织之间的界面模糊,呈点条状、结节状改变;若癌肿侵及直肠周围的组织、器官时,则邻近组织、器官表现为受压性改变,或癌肿的异常信号直接侵及邻近组织、器官,与邻近组织、器官间的脂肪间隙消失[8]。

图①、④为HR-MRI T2WI矢状位,图②、⑤为HR-MRI T2WI横轴位,图③、⑥为HR-MRI T2WI冠状位,图⑦~⑨为Ktrans、Kep、Ve的伪彩图图①~③:男性,53岁,图示直肠中上段管壁不规则增厚,与固有肌层分界欠清,但与周围脂肪交界面完好,根据术前分期为≤T2期,术后病理为溃疡型中分化腺癌,癌组织累及浅肌层,T2期;图④~⑥:女性,63岁,图示直肠中下段管壁不规则增厚,与固有肌层分界不清,周围脂肪交界面见小结节状突起,但未累及直肠周围筋膜,术前分期为T3期,术后病理为溃疡型中-低分化腺癌,癌组织累及肠管全周并侵及直肠周围脂肪组织,T3期;图⑦~⑨:男性,53岁,中上段直肠癌,局部肠壁可见一1.5 cm×1.5 cm×0.7 cm的占位灶,Ktrans值为0.452,Kep值为0.884,Ve值为0.341
在本研究中,70例接受HR-MRI扫描的直肠癌患者中有10例错误分期,病理分期为≤T2期中有4例患者过度分期为T3期,可能是因为T2期肿瘤组织侵犯固有肌层但未累及浆膜层时,局部肠管周围会出现纤维化或炎性反应,肿瘤外缘在MRI图像上表现为毛刷样索条影伸入直肠系膜,因此,很难确定癌肿是否穿透固有肌层侵犯周围的脂肪[9]。另有1例病理分期为≤T2期患者过度分期为T4期,可能由于肠腔内含气过多,肠管扩张明显,病变处肠管与邻近精囊腺关系密切,误以为精囊腺受侵而导致分期过度。病理分期为T3期患者中有4例出现分期错误,其中2例由于病变肠管周围脂肪面显示清晰而被诊断为T2期,可能由于MRI图像对于早期T3期肿瘤的显示能力有限,难以与T2期肿瘤进行区别;另有2例病理分期为T3期的患者过度分期为T4期,可能由于一些中下段直肠癌十分接近直肠周围系膜筋膜,当癌肿较大时,很难对肿瘤的边界进行判断,尤其是肿瘤周围合并有炎性反应时则更难判断到底是T3期还是T4期。1例T4期患者分期不足,判断为T3期,主要是因为一些上段直肠癌在判断腹膜是否被穿透时存在困难。本研究中直肠癌T分期中的主要问题是≤T2、T3期的过度分期及T3、T4期分期不足,这与相关文献报道的MRI T分期的诊断准确性的研究结果[10]基本一致。
当 0.60<Kappa≤0.80 时,表示一致性较好,本研究的结果显示HR-MRI在直肠癌术前T分期与病理分期结果的一致性均较好,表明HR-MRI对直肠癌术前T分期具有重要的诊断价值,它在不同T分期中均具有较高的诊断效能。
3.2 DCE-MRI定量参数与直肠癌不同病理T分期之间的相关性 DCE-MRI扫描可以反映造影剂进入和退出病变组织的血流动力学过程,间接地提供了肿瘤组织的血管特性,可以在一定程度上反映肿瘤的分化程度,从而预测预后。通过拟合不同的药物代谢动力学模型,测得的血流动力学定量参数包括:容量转移常数(Ktrans)、速率常数(Kep)、细胞外血管外间隙容积比(Ve)。Ktrans是指造影剂从血管内分布到血管外的速率,单位为min-1;Kep是指造影剂从组织间隙内重新回到血管内的速率,单位为min-1;Ve是指单位容积组织中血管外细胞外间隙所占的比例[11]。为了获得更为准确的定量参数值,就必须拟合相匹配的药物代谢动力学模型并测量主要供应血管的时间-信号强度曲线,动脉输入函数(AIF)模式越符合,获得的定量参数值就越为准确[12]。
本研究将DCE-MRI扫描所得图像使用软件(Omni-KineticsGEHealthcare)进行后处理,选择双室模型(Extended Toffs Linear),从而获得 Ktrans、Ve、Kep定量参数。本研究的结果表明,随着直肠癌病理T分期的增加,Ktrans值不断增加,可能是由于随着肿瘤T分期的增加,肿瘤内部的血管越来越不成熟,血管内皮细胞发育不完善,致使血管壁的完整性受到不同程度的破坏,血管的通透性增强导致对比剂外渗增加;本研究的结果显示Kep值随着直肠癌病理T分期的升高而不断升高,可能由于肿瘤内部新生血管丰富并且结构存在异常,增加了对比剂的流入;这与沈浮等[13]研究中Ktrans、Kep值与直肠癌T分期呈正相关的结果相一致。本研究结果显示直肠癌不同T分期的Ve值差异无统计学意义,这与谢宗源等[14]的研究结果不符,可能由于样本例数偏少有关,今后还需要进一步加大样本量进行深入研究以发掘其临床意义。
3.3 本研究的局限性 首先,本研究直肠癌各病理T分期的样本量不均一,其中T4期样本量较少,需要更多样本进行深入研究。其次,DCEMRI各定量参数的测量存在一定程度上主观因素的影响,而ROI的选择非常重要,测量误差非常大,难以真实反映肿瘤实质部分的血流动力学情况及正确的MRI分期。
