一株锡林郭勒盟木霉的鉴定及其产纤维素酶研究
2019-04-09李春冬徐伟良
李春冬,徐伟良,鲁 铁,郭 梁,3*
(1.锡林郭勒职业学院 生物工程研究院,内蒙古 锡林浩特 026000;2.河南城建学院 生命科学与工程学院,河南 平顶山 467000;3.锡林郭勒职业学院 食品检验检测和风险评估中心,内蒙古 锡林浩特 026000)
纤维素酶是一类将木质纤维素水解的糖基水解酶,普遍存在于天然的生物体内,是我国第四大工业酶[1],其主要应用于环境保护、食品加工和可持续利用能源等与人类生活相关的行业中[2-5]。目前,用于生产纤维素酶的真菌大多数属于木霉属(Trichderma)、青霉属(Penicillum)、曲霉属(Aspergillus)、根霉属(Rhizopus)等[6]。木霉所产的纤维素酶多数是胞外酶,产率高,且容易分离和提取,同时还产漆酶、木聚糖酶、植酸酶等多种酶类[7],因此,木霉被公认是产纤维素酶较高的菌种之一。目前,国内外学者对纤维素酶的研究报道很多[8-9],SOUZA M F D等[10]从巴西亚马逊森林中筛选获得一株纤维素酶活性为1.63 FPU/mL的木霉菌;JAIN A等[11]研究发现,一株深绿木霉(Trichoderma atroviride)的最大滤纸酶活(filter paper activity,FPA)、羧甲基纤维素酶(carboxymethyl cellulase,CMCase)和木聚糖酶活分别为0.25 FPU/mL、0.18 IU/mL、5.8 IU/mL。
白桦(Betula platyphyllaSuk.)是我国东北、华北、西北、西南地区森林植被的主要组成树种,常形成单独纯木林或与其他针阔叶树种组成混交林,是森林生态系统演替中著名的先锋树种[12]。锡林郭勒盟地区白桦树种资源丰富,是该地区的主要树种之一,具有丰富的纤维素资源,因此,锡林郭勒盟地区白烨可作为产纤维素酶木霉筛选的重要材料。为提高本地区木材废弃物的利用率,前期已采用桦木木屑为固态发酵基质,以纤维素酶活力为评价指标,对锡林郭勒野生木霉菌株进行分离培养,筛选出一株具有产纤维素酶潜力的木霉菌株XLGL201709100。
本研究以前期筛选的一株木霉XLGL201709100为研究对象,采用分子生物学技术对其进行鉴定,并对其最适生长固体培养基进行筛选,为后续木霉菌种保藏研究提供实验基础。同时,利用滤纸酶活(filter paper activity,FPA)法评价该木霉产纤维素酶的能力,以期为更好的利用本地区木材废弃物资源提供新的途径。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
木霉XLGL201709100:分离自锡林郭勒盟野生白桦林。
1.1.2 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基[13-14]:马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 L。
马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基:马铃薯200 g,葡萄糖20 g,蒸馏水1 L。
改良麦粒汁琼脂培养基[15]:麦粒汁100 g,葡萄糖15 g,蛋白胨5 g,琼脂20 g,蒸馏水1 L。
木生菌葡萄糖蛋白胨酵母膏(glucose peptone yeast extract,GPY)培养基[16]:葡萄糖20 g,蛋白胨10 g,酵母浸膏20g,磷酸二氢钾1g,无水硫酸镁0.5g,琼脂20g,蒸馏水1L。
改良木生菌GPY培养基:葡萄糖20 g,蛋白胨5 g,酵母浸膏10 g,磷酸二氢钾2 g,无水硫酸镁1 g,琼脂20 g,蒸馏水1 L。
固体产酶培养基[17]:将干燥无腐败的白桦木粉碎,过40目筛,准确称取10 g木屑,加入两倍质量的营养液(硫酸铵20 g、磷酸二氢钾0.8 g、无水硫酸镁0.4 g、蒸馏水1 L)。
上述培养基pH均自然,灭菌条件为121℃、30 min。
1.1.3 试剂
醋酸、醋酸钠(分析纯)、3,5二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(分析纯)、葡萄糖(生化试剂):国药集团化学试剂有限公司;真菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)快速抽提试剂盒、MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0、EasyTaq聚合酶链式反应(polymerasechainreaction,PCR)SuperMix:日本Takara公司。
1.2 仪器与设备
Nanodrop 2000c核酸蛋白测定仪:美国Thermo Fisher公司;2720 Thermal Cycler PCR扩增仪:美国BIO-RAD公司;MLS-3751L-PC高温蒸汽灭菌器:松下健康医疗器械株式会社;5418R台式高速离心机:德国Eppendorf公司;UV9100A紫外分光光度计:北京莱伯泰科仪器股份有限公司;HWS-250BX恒温恒湿培养箱、YC-R50恒温培养摇床:天津泰斯特仪器有限公司;SW-J-2FD超净工作台:苏州博莱尔净化设备有限公司。
1.3 方法
1.3.1 木霉的分子生物学鉴定
采用真菌基因组DNA快速抽提试剂盒提取木霉XLGL 201709100的基因组。利用核酸蛋白测定仪测定其浓度,采用双蒸水(ddH2O)将样品母液稀释至300ng/μL左右,以其为模板,选用正向引物ITS1(5 "-TCCGTAGGTGAACCTGCGG-3) "和反向引物ITS4(5 "-TCCTCCGCTTATTGATATGC-3) "进行PCR扩增。PCR扩增体系(20 μL):模板1.0 μL、正向引物和反向引物各1.0 μL、EasyTaqPCR Super Mix 10.0 μL、ddH2O 7.0 μL。PCR扩增程序:95℃预变性3 min;95℃变性30 s、52℃退火30 s、72℃延伸1 min,共30循环,最后72 ℃延伸10 min。PCR扩增产物经1.2%琼脂糖凝胶电泳检测。
采用MiniBESTAgaroseGelDNAExtractionKitVer.4.0回收PCR扩增产物,将回收的PCR扩增产物送至北京睿博兴科生物科技有限公司进行测序。测序结果经拼接后在美国国立生物技术信息中心(national center for biotechnology information,NCBI)的Genebank数据库中进行BLAST同源比对,选取同源性较高的菌株,采用MEGA 5.0软件中的邻接(neighbor joining,NJ)法构建系统发育树。
1.3.2 木霉固体培养基的筛选
选取纯化的木霉菌丝,用接种针挑取表面积为1 cm2的菌丝块接种于PDA培养基、改良麦粒汁培养基、木生菌GPY培养基、改良木生菌GPY培养基4种固体培养基上,利用直径为1 cm的打孔器从纯化的木霉菌丝培养皿中取长势相似、大小相同的菌丝块分别接种于新的4种固体培养基上,在25℃恒温培养箱中培养。每天观察菌丝生长状态并测量记录菌丝生长速度,至菌丝全部长满培养皿为止。
将培养完毕的4种固体培养基煮沸使得琼脂溶解,40目滤网过滤得到菌丝。菌丝于80℃烘干至恒质量,称质量,得到菌丝的生物量。通过比较木霉菌株在4种固体培养基上的生长速度及菌丝生物量筛选获得最优固体培养基。
1.3.3 木霉产纤维素酶发酵培养
液体发酵培养:用接种针挑取表面积为1 cm2的菌丝块接种于100 mL PDB液体培养基中,于25℃、150 r/min恒温摇床中培养。待菌丝长满后均匀吸取1 mL菌液于100 mL PDB液体培养基中,于25℃、150 r/min恒温摇床中培养3 d,测定酶活。
固体发酵培养:将培养好的液体菌丝放入40目的灭菌滤筛中过滤得到纯菌丝,用无菌水清洗菌丝表面,去除残留培养基,用灭菌的药勺将菌丝刮取到灭菌的三角瓶中,加入50 mL无菌营养液,混匀,吸取5 mL至固体产酶培养基中,于25℃条件下恒温培养7 d后测定酶活。
1.3.4 纤维素酶活力的测定[18-19]
粗酶液的制备:将液体发酵培养液用80目的滤筛过滤,除去菌体后,8 000 r/min条件下离心10 min,得到的上清液即为粗酶液。固体发酵结束后,称取5.0 g酶曲(均匀取样),加入50 mL乙酸-乙酸钠缓冲液(0.1 mol/L、pH 4.8),40℃、80 r/min条件下振荡浸提1.5 h,8 000 r/min条件下离心10 min,取上清液测定纤维素酶活力。
葡萄糖标准曲线的绘制:分别吸取0、0.1 mL、0.2 mL、0.3mL、0.4mL、0.5mL、0.6 mL葡萄糖标准溶液(1.0 mg/mL)于7支具塞试管中,采用乙酸-乙酸钠缓冲液(0.1 mol/L、pH 4.8)定容至1.0 mL。分别加入1.0 mL DNS显色液,沸水中水浴5 min,取出后迅速冷却,加8 mL蒸馏水,摇匀,于波长520 nm处测定吸光度值。以葡萄糖的毫克数(x)为横坐标,OD520nm值(y)为纵坐标,绘制葡萄糖标准曲线。得到葡萄糖标准曲线为y=2.321x+0.069 8,R2=0.999 3,线性关系良好,可用于葡萄糖含量的测定。
FPA的测定:取0.5 mL酶稀释液和0.5 mL乙酸-乙酸钠缓冲液(0.1 mol/L、pH 4.8)于具塞试管中,放入一张定性滤纸(1 cm×6 cm),50℃水浴保温1 h,加入1.0 mL DNS显色液,煮沸5min后迅速冷却,加蒸馏水定容至10 mL,摇匀,于波长520 nm处测定吸光度值。以沸水浴处理15 min的0.5 mL粗酶液作为空白对照,计算FPA,其计算公式如下:
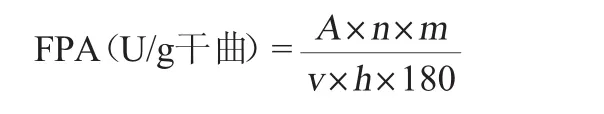
式中:A为葡萄糖质量,μg;n为稀释倍数;m为浸提1 g干酶曲所用缓冲液体积,mL;液体发酵m默认为1;v为酶液体积,mL;h为反应时间,min;180为葡萄糖的摩尔质量,μg/μmol。
FPA单位定义[20]:在50℃、pH为4.8的条件下每分钟所产生1 μmoL的葡萄糖所需的酶量为一个酶活力单位(U)。
2 结果与分析
2.1 菌株XLGL201709100的分子生物学鉴定结果
以真菌ITS1/ITS4为引物进行PCR扩增,菌株XLGL 201709100 ITS基因序列PCR扩增产物的琼脂糖凝胶电泳结果见图1。
由图1可知,菌株XLGL201709100 ITS序列PCR扩增产物的碱基长度均在600~700 bp,与预测结果相符,说明PCR扩增产物为目的基因。PCR扩增产物经测序后,在NCBI数据库中进行BLAST同源比对,选取同源性较高的模式菌株,利用MEGA 5.0中的NJ法构建系统发育树,结果见图2。

图1 菌株XLGL201709100 ITS基因序列PCR扩增产物的琼脂糖凝胶电泳结果Fig.1 Agarose gel electrophoresis result of PCR amplification products of ITS gene sequences of strain XLGL201709100

图2 菌株XLGL201709100 ITS序列的系统发育树Fig.2 Phylogenetic tree of strain XLGL201709100 based on ITS gene sequences
由图2可知,菌株XLGL201709100与哈茨木霉(Trichoderma harzianum)聚于一支,同源性最高。因此,鉴定菌株XLGL201709100为一株哈茨木霉(Trichoderma harzianum)。
2.2 固体培养基的筛选结果
哈茨木霉XLGL201709100分别在4种固体培养基上培养0.5 d、1 d、1.5 d、2 d、2.5 和3 d时的生长情况见图3和表1。
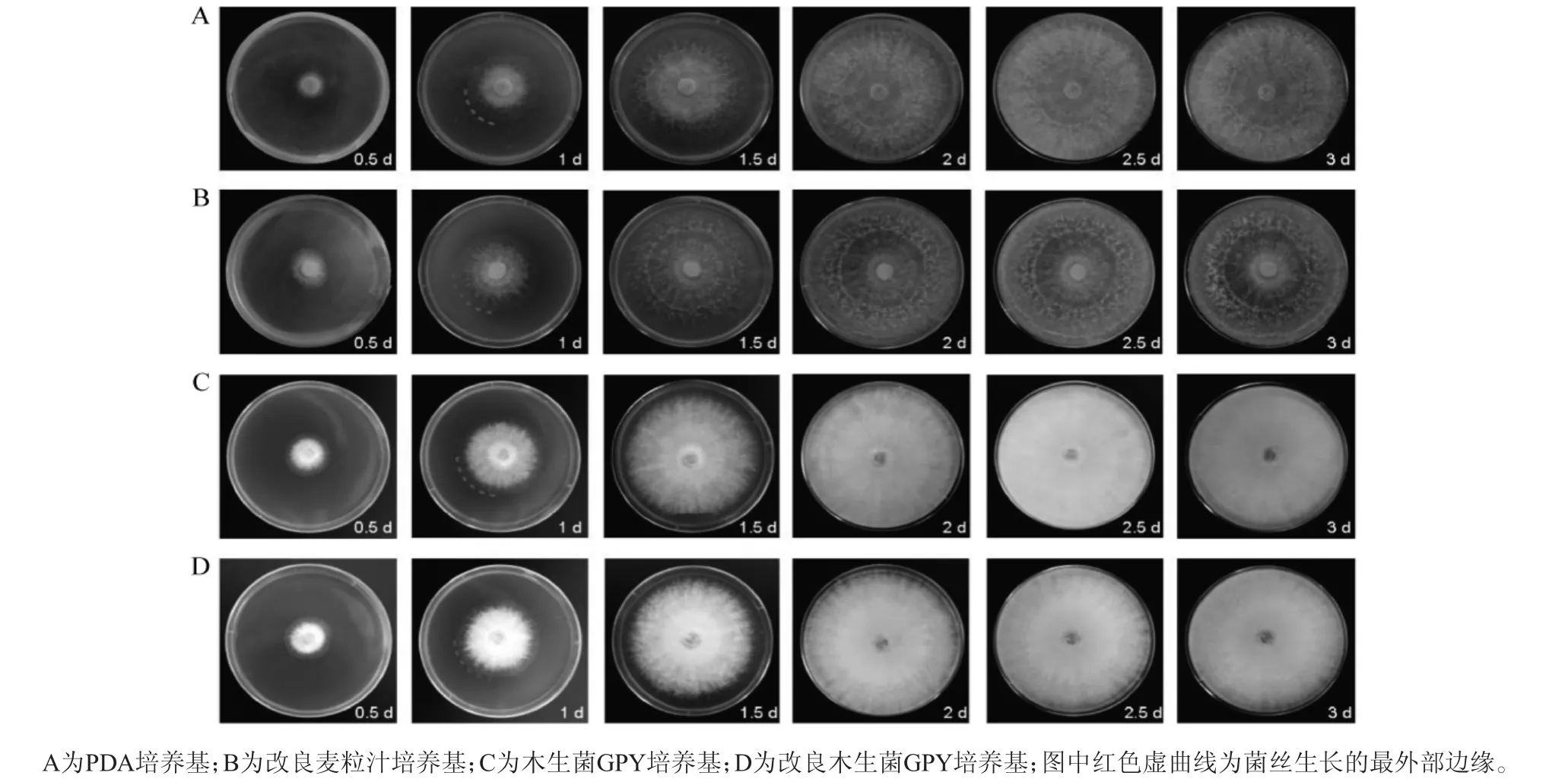
图3 哈茨木霉XLGL201709100在4种固体培养基上的生长状态Fig.3 Growth state ofTrichoderma harzianumXLGL201709100 on the 4 kinds of solid media

表1 哈茨木霉XLGL201709100菌丝的生长状况Table1 Mycelia growth situation ofTrichoderma harzianum XLGL201709100
由图3可知,哈茨木霉XLGL201709100在4种固体培养基上生长迅速,培养48 h后均长满整个培养皿(培养皿直径为9.0 cm)。哈茨木霉XLGL201709100在PDA培养基和改良麦粒汁培养基上菌丝生长呈放射性,菌丝层薄,且在改良麦粒汁培养基上,菌落中间有一明显的环状产孢区,其背面无色或者略黄,正面由黄绿色最终转化为绿色,这与文献报道的哈茨木霉形态特征相似[21-22]。哈茨木霉在木生菌GPY培养基和改良木生菌GPY培养基上菌落呈白色,菌丝层厚,呈密集的蛛网状,产孢区均形成同心轮纹。造成菌丝形态不同的原因可能是由于不同培养基之间,营养成分和比例不同,使菌丝形态之间存在差异。
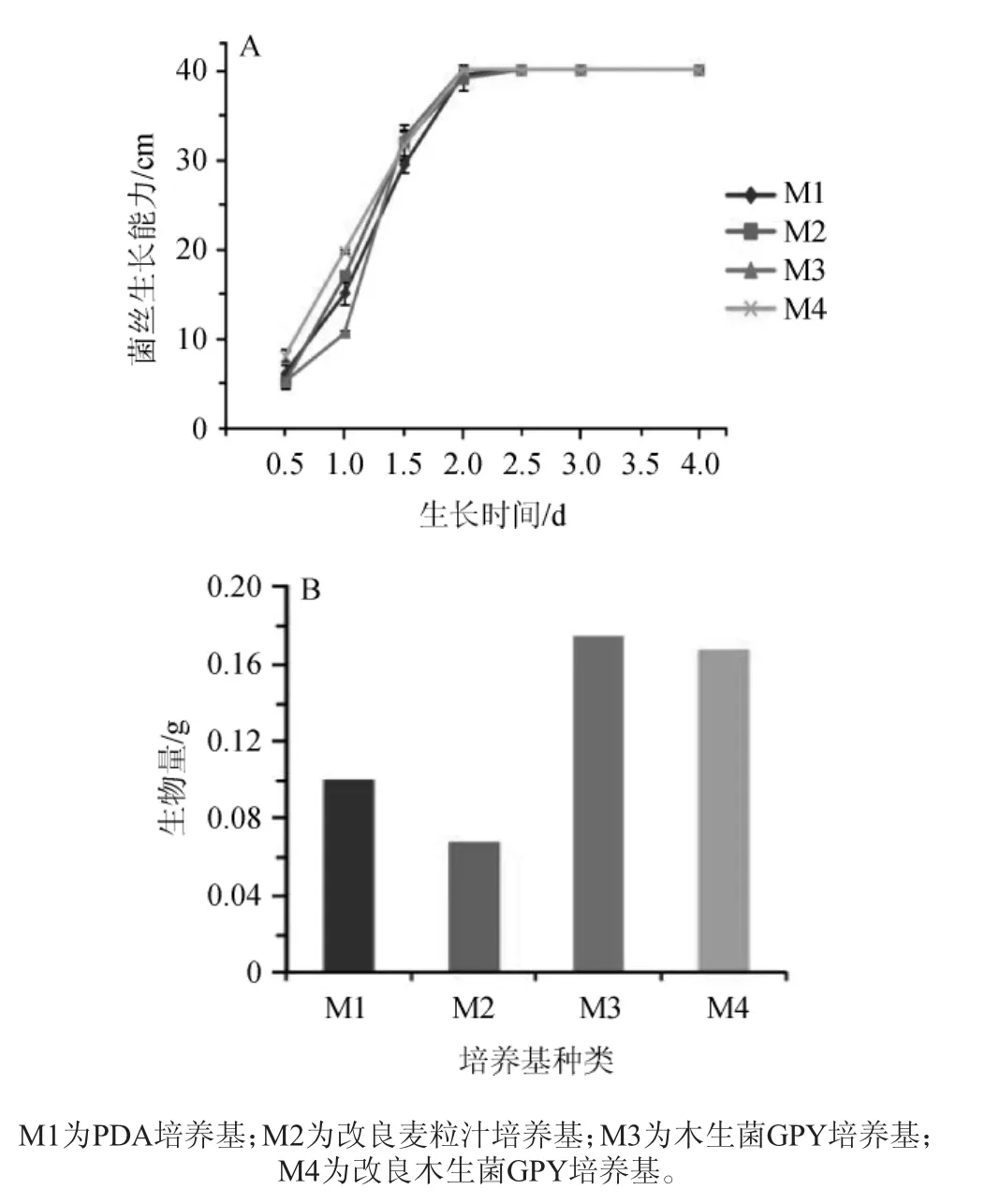
图4 哈茨木霉XLGL201709100在4种固体培养基上的生长能力(A)与生物量(B)Fig.4 Growth capacity(A)and biomass(B)ofTrichoderma harzianum XLGL201709100 on the 4 kinds of solid media
以4种固体培养基对其进行培养,观察并记录菌丝在固体培养基上的生长状态,并通过菌丝生长能力(图4A)和培养4 d的菌丝生物量(图4B)筛选出最适合该木霉菌株生长的固体培养基。
由图4A可知,木霉培养至2 d时,木生菌GPY培养基与改良木生菌GPY培养基上的皿内菌丝已接近全部长满,但以0.5 d的生长能力来看,该木霉菌株在改良木生菌GPY培养基生长能力最强,而PDA培养基和改良麦粒汁培养基上的菌丝生长略慢,在2.5d时全部长满培养皿表面。由图4B可知,木霉菌株培养4 d后,在GPY培养基上的菌丝生物量最大,为0.18 g,而改良麦粒汁培养基菌丝生物量最小,为0.07 g。因此,确定木生菌GPY培养基为适合该木霉菌株生长的最优固体培养基。
2.3 纤维素酶活力测定结果
该木霉菌株在PDB培养基中培养3 d,FPA较低,为(0.025±0.016)U/mL,分析原因可能是由于培养基中含有葡萄糖成分时,葡萄糖对纤维素酶的产生具有抑制作用,木霉菌株优先利用葡萄糖,当葡萄糖耗尽时,才会分泌产生纤维素酶,这与林元山[23]关于康氏木霉(Trichoderma koningii)诱导、阻遏作用机制的研究相符;此外,ILMÉN M等[24]研究发现,在瑞氏木霉(Trichoderma reesei)培养物中,当葡萄糖耗尽时,可检测到纤维素酶基因的转录,并推测这种机制有利于微生物节省能量,是基因长期进化的结果。
木霉菌株在以白桦木木屑为固体产酶基质的固体产酶培养基中培养7 d,FPA达到(1.043±0.093)U/g。目前,对哈茨木霉发酵产酶的方式有液体发酵和固态发酵两种,LOPEZ-RAMIREZN等[25]研究并评价了巴西亚马逊森林9株野生木霉菌的纤维素酶活力,其中哈茨木霉的总纤维素酶活性为1.63 U/mL;姚强等[26]利用液体发酵方法从碱性土壤中分离得到1株哈茨木霉,其FPA为0.96 U/mL;赵肖玲[27]研究发现,以秸秆为固态产酶发酵原料时,在pH值3.5和25℃条件下培养3 d,哈茨木霉菌株的FPA为1.57 U/g。本文所得哈茨木霉菌种纤维素酶活力接近于平均酶活力水平。
3 结论
分离自锡林郭勒盟野生白桦林中产纤维素酶的木霉菌株XLGL201709100经分子生物学鉴定为一株哈茨木霉(Trichoderma harzianum)。木霉菌落在4种固体培养基上的生长形态特征不同:木霉在木生菌GPY培养基和改良木生菌GPY培养基上,菌落呈白色,菌丝层厚,呈密集的蛛网状,产孢区均形成同心轮纹;在PDA培养基和改良麦粒汁培养基上,菌丝生长呈放射性,菌丝层薄,且在改良麦粒汁培养基上,菌落中间有一明显的环状产孢区,其背面无色或者略黄,正面由黄绿色最终转化为绿色。其中木生菌GPY培养基为该木霉菌种的最优固体培养基。木霉菌株在PDB培养基中发酵3 d时,FPA为(0.025±0.016)U/mL,而以桦木木屑为固体产酶发酵培养7 d时,FPA为(1.043±0.093)U/g。
