不同营养元素对紫色红曲霉液态发酵产酯化酶的影响初探
2019-04-09孟卓妮吴鑫颖邱树毅
孟卓妮,王 艳,吴鑫颖,王 啸,邱树毅*
(1.贵州大学 贵州省发酵工程与生物制药重点试验室,贵州 贵阳 550025;2.贵州大学 酿酒与食品工程学院,贵州 贵阳 550025)
酯化酶来源遍及动物、植物和微生物,其中研究最早的是动物酯化酶。但目前研究较多且常用的酯化酶大多数来源于微生物[1-2]。自然界能产酯化酶的微生物种类繁多,如地衣芽孢杆菌(Bacillus licheniformis)、酿酒酵母(Saccharomyces cerevisiae)、黑曲霉(Aspergillus niger)、镰孢霉(Fusarium venenatum)、根霉(Rhizopus)、红曲霉(Monascus sp.)、须霉(Phycomyces)、梨头霉(Absidia)、青霉(Penicillium)、黄曲霉(Aspergillus flavus)等[3-10]。
红曲霉是一种小型腐生丝状真菌,在真菌分类学上属于子囊菌亚门(Ascomycotina)、子囊菌纲(Ascomycetes)、真子囊菌亚纲(Euascomycetes)、曲霉科(Evrotiacene)、红曲霉属(Monascus)[11]。采用Ainsworth分类系统,红曲霉属于真菌界(Fungi)、真菌门(Eumycophyta)、子囊菌亚门(Ascomycotina)、不整囊菌纲(Pletomycetes)、散囊菌目(Eurotiales)、红曲科(Monascaceae)[11]。按照Martin分类系统,红曲霉属于真菌门(Eumycophyta)、子囊菌纲(Ascomycetes)、真子囊菌亚纲(Euascomycetes)、曲霉目(Eurotiales)、曲霉科(Eurotiacene)[12]。
红曲利用历史悠久,可药食两用,是白酒中常用的产酯微生物。现代研究发现,红曲霉在发酵培养过程中能产生多种生理活性物质[13-14],主要有酯化酶、α-淀粉酶、葡萄糖淀粉酶、羧肽酶、蛋白酶、果胶酶、糖化酶、麦角固醇、红曲色素、多糖、γ-氨基丁酸等。酯化酶又称酯酶,属于酯键水解酶类,能将酯水解成相应的醇和酸,同时也可催化转酯反应和酯化反应[15]。根据酶学委员会规定酯化酶包含20种水解酶(编号EC3.1.1.1~EC3.1.1.20),其中研究较多的是脂肪酶[16]、羧酸酯酶[17-18]、胆固醇酯酶[19]、果胶酯酶[20]和胆碱酯酶[21]。
本课题组通过前期研究工作已对分离自贵州某浓香型酒厂中温大曲的紫色红曲霉(Monascuspurpureus)FBKL3.0018的培养周期、温度、pH和液态培养基组分中碳源、氮源进行了工艺优化,该菌产酯化酶的酶活可达到348.57 U/mL。本试验以紫色红曲霉FBKL3.0018为研究对象,研究添加不同营养元素对提高该菌株产酯化酶的影响,为其更好地产酯化酶提供数据基础。
1 材料与方法
1.1 材料与试剂
紫色红曲霉(Monascus purpureus)FBKL3.0018:筛选自贵州某浓香型酒厂的中温大曲;硫酸镁、无水氯化钙、麦芽糖(均为分析纯):国药集团化学试剂有限公司;牛肉膏(生化试剂):北京奥博星责任有限公司;乳糖(分析纯):北京双旋微生物培养基制品厂;D-半乳糖(纯度≥98%):上海朋索生化科技有限公司;伊利全脂、脱脂奶粉(食品级):内蒙古伊利实业集团股份有限公司;氨基酸(纯度≥99%):上海源叶生物科技有限公司;α-乙酸萘酯、固蓝B盐(纯度≥99%)、维生素(纯度≥99%):合肥博美生物科技有限责任公司。
菌种活化培养基:麦芽汁琼脂培养基(maltextractagar,MEA):环凯微生物科技有限公司。
种子培养基:葡萄糖40g/L,蛋白胨15g/L,MgSO·47H2O 1.5 g/L,pH自然,用蒸馏水配制,115℃湿热灭菌30 min。
发酵培养基:牛肉膏20 g/L,NaNO33 g/L,蔗糖60 g/L,无水CaCl22 g/L和MgSO·47H2O1.5 g/L,pH 4.5。
分别以葡萄糖50 g/L、蔗糖60 g/L、乳糖80 g/L、D-半乳糖7 g/L替代发酵培养基中的碳源(蔗糖60 g/L),其他条件不变,配制葡萄糖培养基、蔗糖培养基、乳糖培养基、半乳糖培养基。
1.2 仪器与设备
ThermoFisher台式高速冷冻离心机:赛默飞世尔科技(中国)有限公司;BXM-30R立式压力蒸汽灭菌器、MJX-250B-Z霉菌培养箱、SPX-250B-Z生化培养箱:上海博讯实业有限公司医疗设备厂;DK-98-11电子万用电炉、101-1AB型电热鼓风干燥箱:天津市泰斯特仪器有限公司;723型可见分光光度计:上海精密科学仪器有限公司;PHS-3C pH酸度计:上海鸿盖仪器有限公司;HH-1数显恒温水浴锅:江苏金坛市中大仪器厂;FA2004N电子天平:上海箐海仪器有限公司;ZQPL-200振荡培养箱:天津市莱玻特瑞仪器设备有限公司;JJ-CJ-1FD洁净工作台:苏州市金净净化设备科技有限公司。
1.3 方法
1.3.1 培养方法
将菌株FBKL3.0018接种到麦芽汁琼脂斜面培养基上培养3~5 d后,用接种环刮至无菌生理盐水中,在30℃、160 r/min条件下充分振荡1 h,使游离菌株均匀分布在生理盐水中。经无菌脱脂棉过滤后,制成1×107~1×108个/mL的孢子悬液。按7%的接种量将孢子悬液接种至装有50 mL种子培养基的250mL锥形瓶中,在30℃、160r/min条件下摇瓶培养18h。再按9%的接种量将种子液再接种至装有45 mL发酵培养基的250 mL锥形瓶中,在30℃、160 r/min条件下振荡培养96 h。
1.3.2 酯化酶活力测定方法
根据刘春红等[22]的方法改进如下:在0.25 mL用体积分数95%的乙醇配制的0.006 mol/Lα-乙酸萘酯溶液中,依次加入4.25 mL 0.2 mol/L的磷酸缓冲液(pH6.5)、0.25 mL酶液,在40℃恒温水浴10 min,分别加入0.25 mL 3%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)水溶液终止反应,再分别加入0.25 mL 0.04%固蓝B盐溶液显色剂,充分混匀计时30 s,最后分别加入0.25 mL 50%HCl后摇匀使显色稳定。以失活酶液代替原酶液作对照组,蒸馏水替代失活酶液其他不变作空白组,于波长542 nm处测吸光度值。
酯化酶酶活力定义:40℃条件下反应10 min,每分钟产生1.0 μmolα-萘酚所需的酶量为1个酶活力单位,U。酶活计算公式如下:

式中:X为酶活力,U/mL;ΔY542=Ytest-Ycontro(lYtest为样品在波长542 nm处的吸光度值,Ycontrol为对照组在波长542 nm处的吸光度值);n为发酵液稀释倍数。
1.3.3 试验设计
(1)培养基中营养添加剂的选择
以发酵培养基作为对照,分别考察在发酵培养基中不同维生素(维生素B1、维生素B2、维生素B6、维生素A、维生素C)及维生素添加量(0.05%、0.10%、0.15%、0.20%、0.25%、0.30%、0.35%);氨基酸(L-谷氨酸、L-赖氨酸、L-酪氨酸、L-丝氨酸)及氨基酸添加量(0.05%、0.10%、0.15%、0.20%、0.25%、0.30%、0.35%、0.40%)、其他营养元素(全脂奶粉、脱脂奶粉、乳糖和D-半乳糖)及其添加量(0.1%、0.3%、0.5%、0.7%、0.9%、1.1%)对菌株FBKL3.0018产酯化酶的影响。
(2)碳源对产酶与生物量积累的影响
将菌株FBKL3.0018分别置于蔗糖培养基、乳糖培养基和半乳糖培养基中进行发酵培养,通过测定各培养条件下该菌酯化酶活力和相应的生物量积累情况,研究该菌高产酯化酶与生物量积累量之间的关系。
2 结果与分析
2.1 培养基中添加维生素的选择
以初始发酵培养基为对照,分别添加0.1%的不同维生素,检测酯化酶的酶活,结果如图1所示。
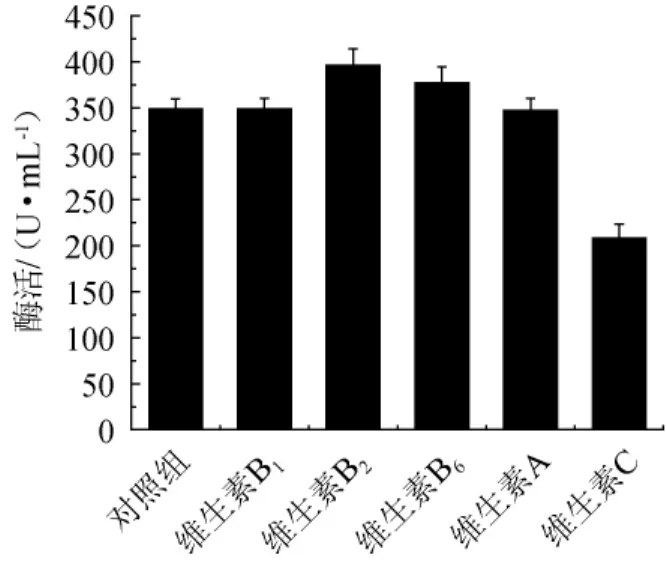
图1 不同维生素对菌株FBKL3.0018产酯化酶的影响Fig.1 Effect of different vitamin on esterifying enzyme production by strain FBKL3.0018
由图1可知,仅维生素C对产酯化酶起抑制作用,酯化酶酶活为208.32 U/mL,培养基中添加其他维生素均能促进酯化酶生产。添加维生素B1和维生素A对产酯化酶的影响相似,且效果并不明显,酯化酶酶活分别为348.59 U/mL和349.26 U/mL。添加维生素B2对酯化酶活性促进效果最明显,酯化酶酶活为395.81 U/mL,因此,选择维生素B2继续探究其促进产酯化酶的最佳添加量。
不同维生素B2添加量对酯化酶酶活影响结果如图2所示。
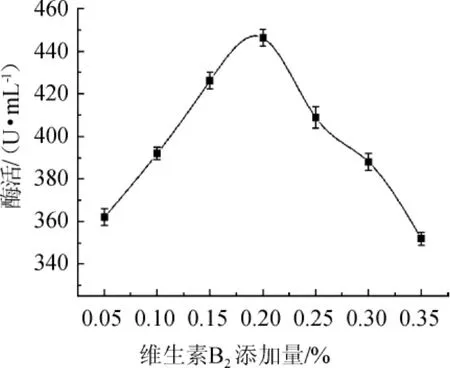
图2 维生素B2添加量对菌株FBKL3.0018产酯化酶的影响Fig.2 Effect of VB2addition on esterifying enzyme production by strain FBKL3.0018
由图2可知,酯化酶酶活随维生素B2添加量增加呈先增大后减小的趋势。维生素B2添加量为0.05%~0.20%时,酯化酶酶活伴随着维生素B2添加量的增加而增长;维生素B2添加量为0.20%时,酯化酶酶活达到最大值为447.59 U/mL;当维生素B2的添加量>0.20%后,酯化酶酶活显著下降。因此,选择在发酵培养基中添加0.20%维生素B2。
2.2 培养基中添加氨基酸的选择
以初始发酵培养为对照,分别添加0.15%不同氨基酸,检测酯化酶的酶活,结果如图3所示。

图3 不同氨基酸对菌株FBKL3.0018产酯化酶的影响Fig.3 Effect of different amino acid on esterifying enzyme production by strain FBKL3.0018
由图3可知,除L-酪氨酸对产酯化酶起抑制作用外,培养基中添加其他氨基酸对酯化酶生成均具有一定促进作用。L-赖氨酸及L-丝氨酸对酯化酶影响基本一致,且影响较小;添加L-谷氨酸对酯化酶酶活促进效果最明显,酯化酶酶活为363.22 U/mL,因此,选择L-谷氨酸继续探究其促进产酯化酶的最佳添加量。
不同L-谷氨酸添加量对酯化酶酶活影响结果如图4所示。

图4 L-谷氨酸添加量对菌株FBKL3.0018产酯化酶的影响Fig.4 Effect of L-glutamate addition on esterifying enzyme production by strain FBKL3.0018
由图4可知,酯化酶酶活随L-谷氨酸添加量的增加呈先增大后减小的趋势。当L-谷氨酸添加量为0.05%~0.30%时,酯化酶酶活也逐步递增;当L-谷氨酸添加量为0.30%时,酯化酶酶活达到最大值为387.36 U/mL;当L-谷氨酸添加量>0.30%后,酯化酶酶活明显下降。因此,选择在发酵培养基中添加0.30%L-谷氨酸。
2.3 培养基中添加其他营养元素的选择
以初始发酵培养为对照,分别添加0.5%不同营养元素,检测酯化酶的酶活,结果如图5所示。
由图5可知,全脂奶粉、脱脂奶粉、乳糖和D-半乳糖均对产酯化酶起促进作用,添加D-半乳糖对产酯化酶酶活促进效果最明显,酯化酶酶活为813.02 U/mL。其次是添加乳糖、脱脂奶粉、全脂奶粉,酯化酶酶活分别为684.12 U/mL、454.23 U/mL、396.66 U/mL,因此,选择D-半乳糖继续探究其促进产酯化酶的最佳添加量。

图5 其他营养元素对菌株FBKL3.0018产酯化酶的影响Fig.5 Effect of other nutrient elements on esterifying enzyme production by strain FBKL3.0018
不同D-半乳糖添加量对酯化酶酶活影响结果如图6所示。

图6 D-半乳糖添加量对菌株FBKL3.0018产酯化酶的影响Fig.6 Effect of D-galactose addition on esterifying enzyme production by strain FBKL3.0018
由图6可知,酯化酶酶活随D-半乳糖添加量的增加呈先增大后减小的趋势。D-半乳糖添加量为0.1%~0.7%时,酯化酶酶活随D-半乳糖添加量的增加而增加;当D-半乳糖添加量达到0.7%时,酯化酶酶活达到最大值为922.36 U/mL;当D-半乳糖添加量>0.7%后,酯化酶酶活开始降低。因此,选择在发酵培养基中添加0.7%D-半乳糖。
2.4 培养基碳源对产酶与生物量积累的影响
不同碳源培养基对菌株FBKL3.0018液态发酵产酯化酶的影响及菌体的积累情况如图7所示。
由图7可知,D-半乳糖培养基对菌株FBKL3.0018产酯化酶促进效果最明显,发酵36~144 h时,酯化酶酶活均远高于以蔗糖和乳糖为碳源发酵液酯化酶酶活,并在发酵至84 h时,酶活达最大值为919.12 U/mL;其次是乳糖培养基和蔗糖培养基在发酵108 h时,酯化酶酶活达到最大值,酶活分别为684.7 U/mL、434.2 U/mL。

图7 不同碳源对菌株FBKL3.0018产酯化酶(A)、生物量(B)的影响Fig.7 Effect of different carbon sources on esterifying enzyme production(A)and biomass(B)by strain FBKL3.0018
菌株FBKL3.0018在蔗糖培养基发酵36~144 h过程中生物量积累量均高于其他任何培养基,并在96 h时生物量积累达最大值为68.94mg/mL;乳糖培养基和D-半乳糖培养基在整个发酵过程中生物量积累量都比较少,生物量积累量分别为39.64 mg/mL(108 h)、43.22 mg/mL(84 h)。
3 结论
在发酵培养基中分别添加0.20%维生素B2、0.3%L-谷氨酸、0.7%D-半乳糖时,菌株FBKL3.0018所产酯化酶的酶活分别为447.59 U/mL、387.36 U/mL、922.36 U/mL,和对照组(348.57 U/mL)相比均有显著提高。其中D-半乳糖非常明显地促进该菌生产代谢产物酯化酶。培养基碳源和酶活及生物量关系参数显示,在以蔗糖、乳糖和D-半乳糖作为培养基碳源的条件下,D-半乳糖是促进菌株产酯化酶的更合适的碳源,酯化酶酶活最大值为919.12 U/mL,远远高于其他碳源,而蔗糖对酯化酶酶产量影响最小,但对红曲霉生物量产量起积极作用,最大生物量为68.94 mg/mL。因此,酯化酶产量多少与其生物积累量并未有确切的关系,但有可能在今后根据菌特性在不同时间段加入不同碳源可获得更高产量的酯化酶,而这还需要后续试验证实。
