2012—2017年重庆医科大学附属第二医院超说明书用药备案情况调查分析
2019-04-09蒋晓君
蒋晓君
(重庆医科大学附属第二医院药学部,重庆 400010)
超说明书用药是指药品使用的适应证、应用人群、给药方法、给药途径或剂量不在药品监督管理部门批准的药品说明书之内[1]。药品说明书包含药品安全性、有效性的重要科学数据、结论和信息,是指导医师开具处方、安全用药的重要依据。然而,由于药品说明书存在局限性和滞后性,往往不能反映最新的医药学探索实践和科研成果,因此,在临床治疗中往往出现超说明书用药的现象[2]。如果医疗机构对超说明书用药监管不当,可能会增加患者的用药风险,深化医师与药师之间的矛盾,加剧患者对医师的不信任感,并导致患者与药师之间发生冲突,同时也不利于医院诊疗行为的规范化[3]。因此,医疗机构对超说明书用药的监管十分重要和必要。现对重庆医科大学附属第二医院(以下简称“我院”)超说明书用药备案情况进行调查,对其不完善的方面进行分析与思考,以期为其他医疗机构对超说明书用药的监管提供有益参考。
1 资料与方法
1.1 资料来源
汇集整理2012—2017年我院各临床科室向药学部提交的超说明书用药备案申请表及我院药事管理与药物治疗学委员会(以下简称“药事会”)批准通过的超说明书用药目录总表。
1.2 方法
对我院2012—2017年超说明书用药监管实践进行回顾与梳理,采用Excel软件,对药事会审核批准通过的超说明书用药目录总表进行汇总分析。了解我院超说明书用药的具体情况,包括超说明书用药的适应证、用法与用量、应用人群、给药方法、给药途径及科室分布等,结合文献和比较分析,评价我院超说明书用药的管理实践并对存在的问题进行探讨。
2 结果
2.1 超说明书用药备案申请与审批情况
根据《药品管理法》《医疗机构药事管理规定》《侵权责任法》和《药品说明书和标签管理规定》等国家相关法律法规,我院制定了超说明书用药管理规定;其中,最重要的内容之一是规定当临床医师因医疗创新确需超说明书用药时,应提供循证医学证据,经药学部受理并初评后,由医院药事会审核同意,报医务处备案,使用时与患者签署知情同意书。2012—2017年,我院药学部共受理14个临床科室提交的超说明书用药备案申请,共124份,最终由药事会审核批准通过的申请共106份,未批准18份,通过率为85.48%。其中,风湿免疫科提交超说明书备案申请数最多,为59份,并全部获批,其获批数占总获批数的55.66%;其余超说明书备案申请获批数较多的科室分别为重症医学科、眼科、生殖医学中心、妇产科、肿瘤科与内分泌科,见表1。
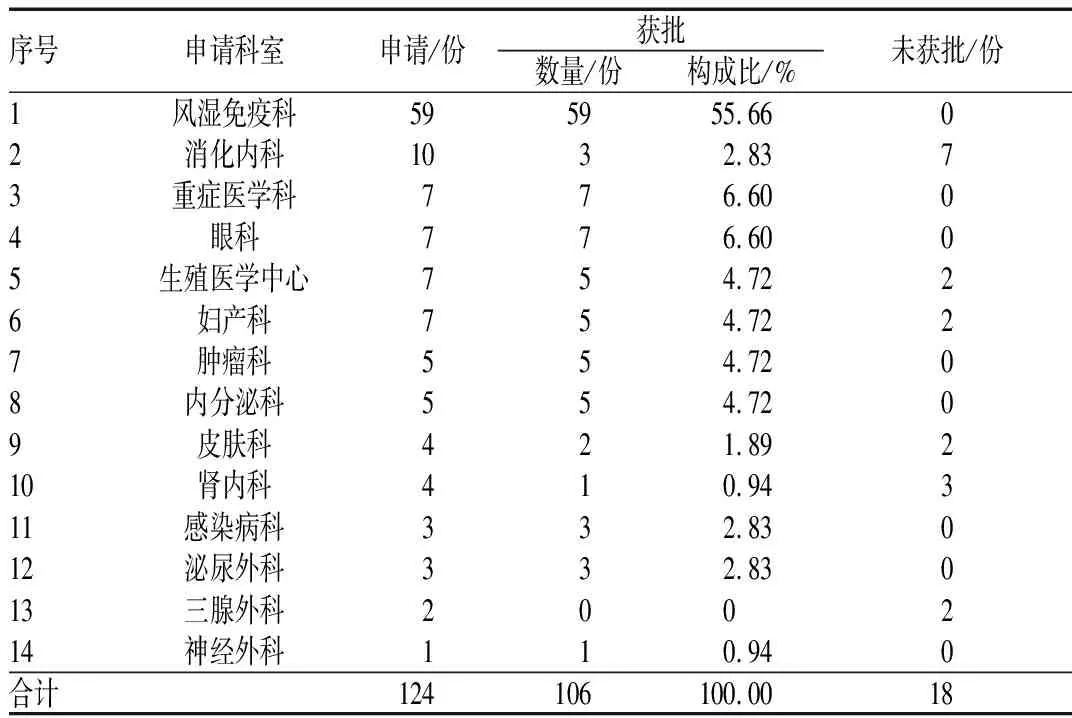
表1 2012—2017年我院超说明书用药备案申请与审批情况Tab 1 Application and approval for off-label drug use record our hospital druing 2012-2017
2.2 超说明书用药备案申请的MICROMEDEX循证医学证据库证据分级情况
按照我院制定的超说明书用药管理规定,临床科室提交的超说明书用药备案申请表内容包括药品通用名、生产厂家、规格、剂型、药品说明书适应证、给药剂量、途径及申请备案的超说明书适应证、给药剂量和给药途径。该申请表与附带的循证医学证据一并移交给药学部,由临床药师按照MICROMEDEX循证医学数据库证据分级标准(见表2)进行循证医学证据分级。按照表2的分级标准,药学部临床药师对申请的超说明书用药及其附带的循证医学证据进行独立评价,同时检索药品获国家食品药品监督管理总局批准的说明书和MICROMEDEX循证医学数据库的“off-label use”部分,在汇总检索结果与临床科室提供的循证证据文献的基础上,进行超说明书用药的有效性等级、推荐等级与证据等级的评估,并给出初审意见。药学部将初审结果提请药事会进行讨论并进行投票,最终决定是否允许超说明书用药在临床中使用。2012—2017年,药学部对14个临床科室提交的124份超说明书用药备案申请进行循证医学证据分级的情况见表2。

表2 2012—2017年我院超说明书用药备案申请的MICROMEDEX循证医学数据库证据分级情况Tab 2 Grading standards for evidence in MICROMEDEX evidence-based medicine database of application for off-label drug use record of our hospital druing 2012-2017
2.3 超说明书用药备案申请与批准类型
124份超说明书用药备案以超适应证用药为主;106份获批的超说明书用药申请中,也主要为超适应证用药(100份,占94.34%),见表3。
3 讨论
3.1 超说明书用药的普遍性及管理现状
在临床药物治疗中,超说明书用药的现象普遍存在。在美国,已批准上市的药物中有21%存在超说明书用药情况[4]。

表3 2012—2017年我院超说明书用药备案申请与批准类型Tab 3 Types of application and approval for record filing on off-label drug use record of our hospital during 2012-2017
研究结果表明,欧洲地区46%的处方存在超说明书适应证用药的情况[5]。除印度禁止超说明书用药外,德国、荷兰、新西兰、意大利、美国和日本已就超说明书用药专门立法,允许合理的超说明书用药[6]。目前,我国尚未针对超说明书用药制定相应的法律法规[3]。鉴于超说明书用药的普遍性与潜在的用药安全风险及可能引发的医疗纠纷,医疗机构对于超说明书用药的规范管理十分重要。
3.2 我院超说明书用药管理规定及其缺陷
我院参考《药品管理法》等行业法律法规及中国药理学会《超说明书用药专家共识》等资料,制定了《重庆医科大学附属第二医院超说明书用药管理规定》,其中关键性的内容是规定临床科室因医疗创新确需超药品说明书用药时,应提供循证医学证据,经药学部受理并初评后,由医院药事会审核同意,报医务处备案,使用时与患者签署知情同意书,方可超说明书用药。从管理实践的结果来看,我院超说明书用药管理规定存在3处缺陷:(1)2012—2017年积压了不少超说明书用药备案申请的资料,临床用药需求没有及时得到满足,药学部应安排初评小组定期进行资料的整理和评定,避免积压;(2)我院超说明书用药申请的审核批准没有经过医学伦理委员会的讨论,超说明书用药的本质也属于对人体的临床试验,应经过医学伦理委员会批准,这一点有待完善[7-8];(3)在临床科室提交超说明书用药备案申请时,应当要求其同时提交超说明书用药后可能出现的风险及应急预案,确保患者安全。在临床上,由于超说明书用药引起的药品不良反应比较常见[9-10]。应引起足够的重视,这也是我院超说明书用药管理的薄弱点。
3.3 我院超说明书用药的特点
2012—2017年,我院风湿免疫科提交的超说明书备案申请最多,获批59份,占总获批数的55.66%。国内文献报道,风湿免疫科超说明书用药情况占全院的41.67%,高居门诊各科室之首[11];国外文献报道,风湿免疫科门诊超说明书用药发生率为10%~20%[12]。说明风湿免疫科超说明书用药更为普遍。同时,该科室临床医师用药风险相对较高。其原因可能是风湿免疫科疾病多为免疫相关性疾病、罕见病或疑难杂症,很多疾病的病理机制尚未完全阐明,如斯蒂尔病、抗磷脂综合征及白塞病等,由于病情和症状表现复杂,缺乏特效药,故在主观意识上,风湿免疫科医师比较倾向于尝试最新的科研成果与临床探索[13-14]。
由表2可见,2012—2017年我院各临床科室提交的超说明书用药备案申请的证据级别较高,大部分申请附带的循证医学证据质量较高,备案申请整体通过率为85.48%。由表3可见,我院超说明书用药的主要类型是超适应证用药,其次为超剂量用药。这与中国药理学会2014年对国内24家医院998种药品1 652项超说明书用药的调查结果一致,其超适应证用药尤为常见(占94.34%)[8]。因此,超适应证用药应作为超说明书用药监管的重点。
尽管部分超说明书用药缺乏临床研究数据支持,安全性和治疗效果尚未明确,存在较大隐患[15]。但是,也有部分超说明书用药是建立在长期的临床实践及循证医学基础之上的,只是由于药品说明书的滞后性,没有跟上医学实践的发展步伐。超说明书用药就像一把双刃剑,既可以拓宽临床药物治疗范围、推动医学进步与创新,使患者从中获益,也使得医疗工作者承担了更多的医疗和法律风险,患者也承受了更高的用药风险。亟需国家层面出台相关法律法规或文件来指导超说明书用药,规避执业风险,保障患者用药安全。
