硅钼黄分光光度法测定酸浸液中高浓度胶体二氧化硅含量
2019-04-07沈罕琦朱睿张佳楠徐红胜施志展孙旻佳黄煜玫
沈罕琦 朱睿 张佳楠 徐红胜 施志展 孙旻佳 黄煜玫

摘 要:探究用NaHCO3作为解聚剂、钼酸铵为显色剂测定高浓度酸性胶体二氧化硅含量的分光光度法,该方法是经典钼黄法的一种改进。通过对比实验,确定了实验过程中最佳搅拌破碎时间、反应时间、显色酸度、显色温度、显色时间,且明确实验的pH值和搅拌破碎程度(时间)需要严格控制。pH值为1.25(±0.05),二氧化硅质量浓度在12.5~150 mg/L范围内,选择吸收波长为410 nm,测定结果符合朗伯比尔定律;所建立的经典钼黄法线性回归方程的R2=0.999 7,加标回收率在102.5%~111.4%之间,相对标准偏差为6.7%(n=5);以NaHCO3作为解聚剂的改进钼黄法线性回归方程的R2=0.999 4,加标回收率在95.7%~97.2%之间,相对标准偏差为3.9%(n=5)。
关键词:酸浸液;高浓度;胶体二氧化硅;硅钼黄;分光光度法
中图分类号:O657.3 文献标识码:A 文章编号:2095-7394(2019)06-0059-07
工业上采用常规酸浸工艺处理金属硅酸盐矿时,可溶硅以偏硅酸根、正硅酸根、双正硅酸根形态存在,并以硅酸形式随金属离子进入浸出液[1-4]。若硅酸浓度过大,那么在酸性溶液中易发生聚合反应且不稳定,会形成难以过滤的胶体二氧化硅,增加浸出液的过滤难度和金属的物理损失[2-4],这也一直是工业生产中存在的难题。研究发现,胶体二氧化硅的含量影响浸出液的过滤速率[5-6]。因此,在酸浸体系中对胶体二氧化硅含量快速、准确地测定至关重要,且对指导工业生产有重大意义。
目前,二氧化硅的分析测定方法[7]主要有重量法、氟硅酸钾滴定法、分光光度法等。应用最广泛的是分光光度法,其中硅钼蓝分光光度法[7-8]、硅钼黄分光光度法[9]均可以应用于二氧化硅含量的研究。在研究酸性胶体二氧化硅的过程中,需要对胶体进行解聚,将胶体二氧化硅转化为可溶性二氧化硅,并与钼酸铵反应形成硅钼酸盐络合物,进行显色测定。应用于此方法的传统解聚剂为氟化物,胶体通过氟离子的络合作用生成SiF62-,从而达到解聚的目的[9]。而在简单的中水体系中,有以NaHCO3为解聚剂,蒸汽浴消化1 h来实现解聚测总硅的目的,相较于氟化物解聚经济简单,但其具体的解聚原理未可知[10]。
所以,本研究探索以NaHCO3为解聚剂代替经典钼黄法中氟化物,从而改进分析方法,应用于酸性体系高浓度胶体二氧化硅含量分析,并与经典钼黄法进行比较。同时,对二氧化硅分析测定过程中搅拌破碎胶体时间、解聚反应时间、显色酸度、显色时间、显色温度等进行考察,测量其变化对测定结果准确度、精密度的影响。
1 试验部分
1.1 仪器与试剂
YP20002型电子天平(常州市衡正电子仪器有限公司);HH-6数显恒温水浴锅(常州国华电器有限公司);JJ-1A数显测速电动搅拌器(江苏省金坛市荣华仪器制造有限公司);PHS-3E雷磁pH计(上海仪电科学仪器股份有限公司);752 N紫外可见分光光度计(上海仪电分析仪器有限公司)。
所有化学试剂均为分析纯,整个试验过程使用去离子水。0.5 g/L二氧化硅标准溶液;NaHCO3溶液(97 g/L,避光保存);Na2CO3溶液(200 g/L,避光保存);钼酸铵溶液(100 g/L);NaF溶液(20 g/L);硼砂溶液(50 g/L);草酸溶液(75 g/L,避光保存);无水乙醇;硫酸(1+1)。
1.2 试验步骤
由于试验中所用胶体胶凝比较完全,所以在对样品进行分析时,无法对大块果冻状的胶体进行准确的量的划分,需要在4 mL的塑料小管中进行制样来定量分析。本实验样品中理论二氧化硅含量为21.14 g/L。
将制得的胶体二氧化硅全部转移至250 mL聚四氟乙烯烧杯中,用药勺进行预破碎,加去离子水20 mL,放入50 ℃的水浴锅中加热搅拌破碎胶体25 min后取出,补加去离子水100 mL,用NaHCO3溶液调节溶液pH值至7(±0.2),放入50℃恒温水浴锅中水浴加热,搅拌装置搅拌,反应40 min后取出,冷却至室温,定容至200 mL(实验中所有的搅拌,转速均为250~300 r/min)。
取 1 mL已解聚的待测溶液于250 mL聚乙烯烧杯中,加去离子水至10 mL,用H2SO4(1+1)调节pH至1.25(±0.05);加入2.5 mL乙醇和3 mL钼酸铵溶液,于25 ℃恒温水浴锅中避光显色12 min,加入1 mL草酸溶液,去离子水定容至100 mL,摇匀;用1 cm比色皿,以试剂空白作为参比液,于波长410 nm处测定其吸光度。
2 结果与讨论
2.1 吸收波长的选择
经典钼黄法的吸收波长为410 nm[9]。试验中,对标准样品进行比色测定时发现,改进钼黄法在吸收波长为410 nm处测得的结果仍很稳定,所以本試验依然沿用原波长410 nm。
2.2 解聚试验
2.2.1 搅拌破碎时间
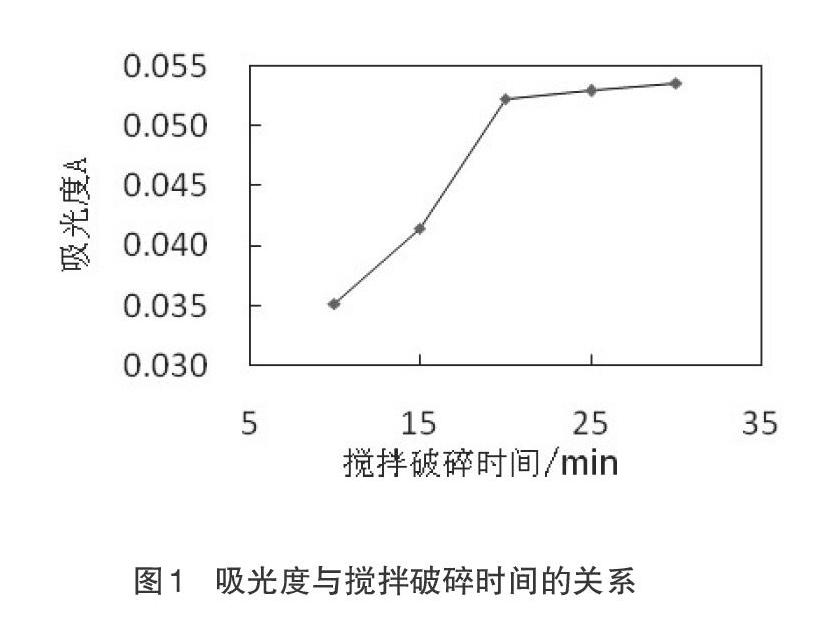
本文探究的NaHCO3解聚方法基于正硅酸聚合原理,即在硅酸浓度较大的酸性溶液中正硅酸会发生聚合作用生成聚合硅酸[11],探究酸性胶体二氧化硅是否存在一个非自发的逆反应使得其由凝胶(胶体)转变为溶胶(触变作用)[12],即通过稀释、搅拌加热而解聚。试验发现,存放在聚乙烯瓶中已经解聚过的解聚样,在放置一段时间后,瓶底会出现少量重新聚集的絮状物,取出加温搅拌一定时间后,絮状物消失。此现象符合胶体分类[13]中可逆胶体体系的说明。试验中,搅拌破碎时间决定了胶体的破碎程度,影响后续调节pH值所需NaHCO3的用量,是解聚能否完全的关键,对测定结果影响很大,所以对于胶体的破碎程度尤其要关注。
试验中,设定搅拌破碎时间为10 min、15 min、20 min、25 min、30 min,其他条件与试验方法一致,测定其吸光度。由图1可知,攪拌破碎时间在20~30 min时,吸光度值趋于稳定,所以实验选择搅拌破碎时间为25 min。
2.2.2解聚反应时间
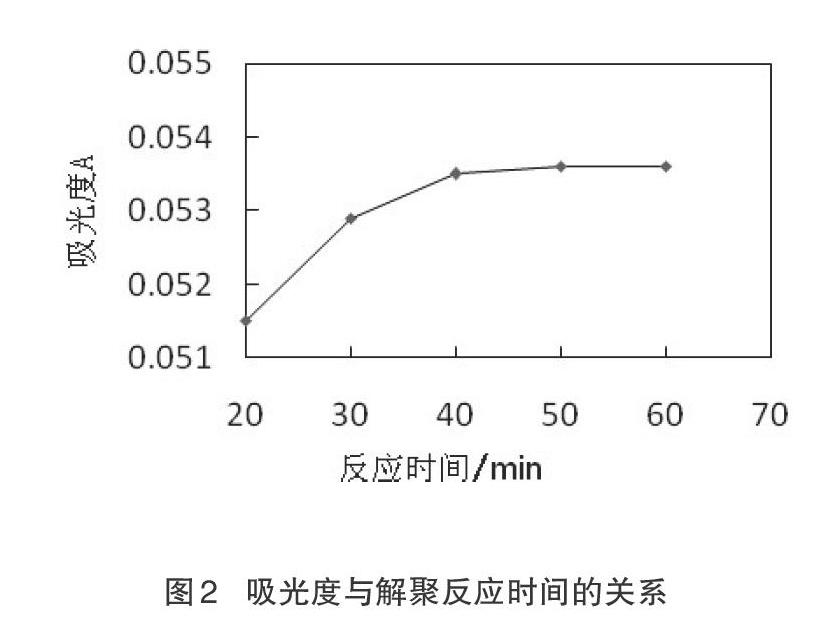
研究发现,溶液的PH值越接近中性,生成凝胶稳定性越差[14]。所以,在后面的解聚反应中,已解聚的胶体难以再次聚合,或者说聚合的结构不稳定会在加温搅拌反应中被破坏。解聚后,由于碳酸氢钠是强电解质,而溶胶对电解质十分敏感,当加入少量盐类就能使溶胶聚成[15],所以,在解聚反应时对用于调节pH值的NaHCO3的量要十分严格控制,不能过多,当然也不能过少,否则无法达到完全解聚的效果。预试验中,探索NaHCO3的量时发现,pH值调节在6.8以下或者在7.5以上都无法得到澄清透明的解聚液,所以本试验选择将pH值调节至中性7(±0.2)。
试验中,改变解聚反应时间为20 min、30 min、40 min、50 min、60 min,其他条件与试验方法一致,测定其吸光度。由图2可知,在解聚反应时间为20~40 min时,吸光度值呈现上升趋势;在40~60 min之间,吸光度值趋于稳定。所以,选择实验的最佳解聚反应时间为40 min。
忽略人工时间,经典钼黄法解聚处理的时间为30 min,改进钼黄法解聚处理的时间为65 min。
2.3 显色试验
2.3.1 显色酸度
试验中调节的显色酸度下,硅钼酸盐络合物的结构为β-异构体,β-异构体在pH值为0.8~2.5范围内形成[16]。试验改变调节酸度pH的值为0.8、1.0、1.2、1.4、1.6,其他条件与试验方法一致,考察不同pH值下硅钼黄的生成情况。由图3可知,在pH值为0.8时,测量值偏低,0.8~1.2时吸光度值呈上升趋势,1.2~1.4时吸光度值趋于稳定,1.4~1.6时吸光度值有下降趋势。由此可以看出,酸度的高低对硅钼黄的生成会造成很大影响,pH值越大,生成的硅钼黄越不稳定,使测定结果偏低;pH值越小,相同显色时间下硅钼黄越难生成,会使测定结果偏低。所以,试验选择的显色酸度为pH=1.25 (±0.05)。
2.3.2 显色时间及温度
温度对试验的影响较大,控制室温为25 ℃。若温度低于25 ℃,一定时间下显色不完全,测量值偏低[8],所以显色温度选择为25 ℃。试验中,改变显色时间为4 min、6 min、8 min、10 min、12 min,温度严格控制,其他条件与试验方法一致,测定其吸光度。由图4可知,显色时间过短,显色不完全。在此试验条件下,10~12 min显色基本完全,所以显色时间选择12 min。
2.4 工作曲线
分别移取0.5 g/L的二氧化硅标准溶液0 mL、0.25 mL、0.5 mL、1 mL、2 mL、3 mL于250 mL聚乙烯瓶中,按改进分析方法和原始硅钼黄法分别进行显色测定。在12.5~150 mg/L范围内,符合朗伯-比尔定律,浓度与吸光度呈线性关系,建立了改进方法的线性方程:A=0.002 72C+0.000 56,R2=0.999 4,如图5;原始硅钼黄法的线性方程:A= 0.002 47C-0.000 81,R2=0.999 7,如图6。该线性方程具有较好的线性相关性,满足吸光度测量的要求。
2.5 样品数据分析
按照经典硅钼黄法和改进方法对样品进行测定,平行测定5次,考察方法重复性,如表1所示。
对样品进行加标回收试验,考察方法的准确度,如表2、表3所示。
3 结论
在本试验操作条件下,NaHCO3确实能较好地对胶体二氧化硅进行解聚,但可能仍存在少量胶体二氧化硅未被解聚或者在操作过程中不可避免的损失。两种分析方法均受环境的影响极大,室温的改变也会影响其测定的结果,所以方法的重现性都不好。相比之下,改进方法重复性优于经典硅钼黄法,准确度较好,以NaHCO3代替氟化物解聚,虽然分析时间上较长,但是有效地减少了试验试剂的使用,降低了试验成本,而且避免了分析过程中氟化物对试验操作者的毒害作用。其劣势在于:试验对操作的要求比较高,调节pH值、温度以及胶体的搅碎程度都要严格控制,不然不能达到应有的解聚效果。经试验中准确度、精密度验证,改进硅钼黄法可用于胶体二氧化硅的测定,对解决工业生产上的问题有一定的帮助。
参考文献:
[1] 朱屯.现代铜湿法冶金[M]. 北京:冶金工业出版社,2002.
[2] 梅光贵,王德润,周敬元,等. 湿法炼锌学[M]. 长沙: 中南大学出版社,2001.
[3] 杨大锦,朱华山,陈加希. 湿法提锌工艺与技术[M]. 北京:冶金工业出版社,2006.
[4] 马荣骏. 湿法冶金原理[M]. 北京:冶金工业出版社,2007.
[5] LLER R K. The chemistry of silica[M].NewYork:Wiley-Interscience Publication,1979.
[6] BERGNA H E. The colloid chemistry of silica[M].Washington: American Chemical Society,1994.
[7] 符斌.有色冶金分析手册[M].北京:冶金工业出版社, 2004.
[8] YANG Hailong,LI Cunxiong , WEI Chang , et al. Molybdenum blue pHotometry method for the determination of colloidal silica and soluble silica in Leaching solution[J].Analytical Methods,2015,7(13):5462-5467.
[9] 何欢,张旭,沈庆峰,等.硅钼黄分光光度法测定铜渣酸浸液中二氧化硅[J].分析实验室, 2016,35(2):176-179.
[10] 赵菁,任建国,马玉录.中水胶体硅分析方法的改进[J].内蒙古石油化工,2012(16):78.
[11] 张建珍,王锦荣,刘家齐. 聚合硅酸解聚-硅钼蓝分光光度法测定矿石中二氧化硅[J]冶金分析, 2010,30(9):65.
[12] 沈钟,王果庭.胶体与表面化学[M].2版.北京:化学工业出版社, 1997.
[13] COHEN STUART M A.胶体科学[M].北京:科学出版社, 2012.
[14] 刘红,邵俊,梁晶,等.提高聚硅酸稳定性的研究[J].工业水处理, 2005,25(10):29-31.
[15] 陈宗淇,戴闽光.胶体化学[M]. 北京:高等教育出版社, 1984.
[16] GRASSHOF K,EHRHARDT M,KREMLING K.Methods of Seawater Analysis[M].Weinheim:VerlagChemie,1983.
责任编辑 祁秀春
