化合物化学式计算的几种常见考查方式
2019-04-04张新中
张新中
(江苏省邗江中学 225009)
化合物化学式的计算是高中学生必须掌握的一项基本技能,在高考和各地的模拟试卷中也屡屡出现.常见的考查方式有以下几种.
一、利用反应列方程进行计算
例1 某科研小组采集到两种铜矿标本,经地理老师辨认为孔雀石和石青,老师说其化学组成均可表示为xCuCO3·yCu(OH)2,属于天然碳酸盐类铜矿.
(1)为了准确测定两种矿石的化学组成,该小组同学将两种矿石分别与足量盐酸反应,孔雀石耗用的盐酸的物质的量与生成的CO2的物质的量之比为4∶1;石青则为3∶1.请确定它们的化学组成,孔雀石:____;石青:____.
(2)现取两份等质量的两种矿石的混合物样品,一份加入过量盐酸,生成CO26.6 g;对另一份样品加热使其完全分解,得到CuO 20g,则混合物中孔雀石和石青的物质的量之比为____.
解析(1)xCuCO3·yCu(OH)2与盐酸反应的化学方程式为xCuCO3·yCu(OH)2+2(x+y)HCl→(x+y)CuCl2+xCO2↑+(x+2y)H2O
根据孔雀石耗用的盐酸与生成的CO2的物质的量比为4∶1,可得:2(x+y)∶x=4∶1,解得x∶y=1∶1,故孔雀石的化学式可表示为CuCO3·Cu(OH)2.
根据石青耗用的盐酸与生成的CO2的物质的量比为3∶1,可得:2(x+y)∶x=3∶1,解得x=2y,故石青的化学式可表示为2CuCO3·Cu(OH)2.
根据C守恒得:a+2b=0.15 mol
根据Cu守恒得:2a+3b=0.25 mol
解得a=0.05 mol,b=0.05 mol.
故该混合物中孔雀石和石青的物质的量之比为:
0.05 mol∶0.05 mol=1∶1
答案:(1)CuCO3·Cu(OH)2;2CuCO3·Cu(OH)2(2)1∶1
点评本题根据铜矿与盐酸反应消耗盐酸的物质的量与生成的CO2的物质的量之比计算化学式,只要写出化学方程式,找出相应物质的物质的量,列方程即可解答.本题的关键在于化学方程式的书写,题目比较简单.
二、利用三大守恒进行计算
例2 某结晶水合物含有两种阳离子和一种阴离子.称取两份质量均为 10.00 g的该结晶水合物,分别制成溶液.

②另一份加入足量的BaCl2溶液,生成不溶于稀硝酸白色沉淀,经过滤、洗涤、干燥称其质量为11.65 g.
(1)该结晶水合物中含有的两种阳离子是____和____,阴离子是____.
(2)试通过计算确定该结晶水合物的化学式(写出计算过程,注意解题规范).
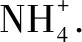
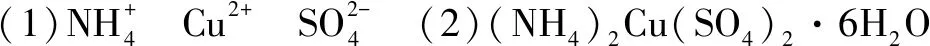
点评本题先根据反应现象推断出物质中的离子,然后根据题中给出的物质的物质的量,计算出已知离子的物质的量,再根据电荷守恒计算出剩余离子的物质的量,最后得出物质的化学式.本题的关键在于应用电荷守恒计算最后一种离子的物质的量.
三、利用分解产物的比例进行计算
例3 实验所制得的碱式碳酸铜的组成可表示为:xCuCO3·yCu(OH)2·zH2O,要测定其组成,甲同学设计的实验方案中需要如下五个步骤:①称取12.0 g的样品;②高温分解;③测出生成CO2的质量为2.2 g;④测出生成水蒸气的质量为1.8 g;⑤称量生成CuO的质量为8.0 g.而乙同学认为除步骤②外,实验只需测定4个量中的部分数据即可,则合理的组合为____(填序号,写一组即可).根据你的选择,计算出碱式碳酸铜的组成,写出计算过程.

答案:③④⑤,①③④,①③⑤,①④⑤(任写一种) CuCO3·Cu(OH)2·H2O
点评本题根据分解产物的物质的量之比写出盐的氧化物表示形式,然后改写为盐的形式.本题的关键在于理解用氧化物的形式表示盐的组成;要注意的是分解生成的水不是盐中的结晶水.
四、利用热重分析图进行计算
例4 钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域.
(1)CoxNi(1-x)Fe2O4(其中Co、Ni的化合价均为+2价)可用作H2O2分解的催化剂,具有较高的活性.
① 该催化剂中铁元素的化合价为____.
② 图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线.由图中信息可知:____法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是____.

图1

图2
(2) 草酸钴是制备钴氧化物的重要原料.图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物.
① 通过计算确定C点剩余固体的化学成分为____(填化学式).写出B点对应的物质与O2在225~300℃的条件下发生反应的化学方程式:____.
② 取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3价),用480 mL 5 mol·L-1盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体.试确定该钴氧化物的化学式.
解析(1)①该催化剂中Co、Ni均为+2价,O为-2价,所以Fe元素的化合价是[8-(2x+2-2x)]/2=+3.②反应速率越快,则催化剂的催化活性越高,根据图像可知,x相同时微波水热法初始反应速率大于常规水热法,所以微波水热法制取得到的催化剂活性更高;随x增大,初始速率增大,而x增大,Co2+的比例增大,所以Co2+的催化效果更好.

答案:(1)①+3 ②微波水热 Co2+

②Co5O6(过程见解析)
点评本题(2)①根据化合物在受热时的质量变化计算不同阶段的化学式.解答这类题的一般思路是:(1)失重一般是先失水,再失非金属氧化物;(2)晶体中金属质量不再减少,仍在m余中;(3)失重最后一般为金属氧化物,由质量守恒得m氧,由n金属∶n氧,即可求出失重后物质的化学式.解题的关键在于弄清物质质量变化的原因,从而计算出变化物质的物质的量.
五、利用滴定实验数据进行计算
例5 碱式次氯酸镁[Mga(ClO)b(OH)c·xH2O]是一种有开发价值的微溶于水的无机抗菌剂.为确定碱式次氯酸镁的组成,进行如下实验:


(1)步骤①需要用到的指示剂是____.
(2)步骤②若滴定管在使用前未用EDTA标准溶液润洗,测得的Mg2+物质的量将____(填“偏高”“偏低”或“不变”).
(3)通过计算确定碱式次氯酸镁的化学式(写出计算过程).
解析(1)I2遇淀粉显蓝色,当Na2S2O3将I2完全消耗时,溶液的蓝色褪去,故选择淀粉作指示剂.
(2)若滴定管没有润洗,则其浓度变小,与Mg2+反应时,EDTA的消耗量增多,所得Mg2+的量偏高.

答案:(1)淀粉溶液 (2)偏高
n(Mg2+)=0.020 00 mol·L-1×25.00×10-3L×1 000 mL/25.00 mL=2.000×10-2mol
根据电荷守恒,可得:
n(OH-)=2n(Mg2+)-n(ClO-)=2×2.000×10-2mol-1.000×10-2mol=3.000×10-2mol
m(H2O)=1.685 g-1.000×10-2mol×51.5 g·mol-1-2.000×10-2mol×24 g·mol-1-3.000×10-2mol×17 g·mol-1=0.180 g
n(Mg2+)∶n(ClO-)∶n(OH-)∶n(H2O)
=2.000×10-2mol∶1.000×10-2mol∶3.000×
10-2mol∶1.000×10-2mol=2∶1∶3∶1
则碱式次氯酸镁的化学式为Mg2ClO(OH)3·H2O.
点评本题利用滴定实验测定出ClO-、Mg2+的物质的量,再利用电荷守恒和质量守恒计算出OH-和H2O的量,最后确定出化学式.解题的关键在于根据滴定实验找出关系式,从而进行计算.
