巧用守恒法解决大计算
——关于硝酸与金属反应计算之巧解
2019-04-04张伟
张 伟
(山东省泰安市宁阳第一中学 271400)
一、守恒法简介
守恒表示在化学反应中某种不变的关系,常常以等式的形式表示之.常见的守恒包括包括质量守恒、原子个数守恒、电子得失个数守恒、电荷守恒.利用守恒关系解决问题的方法叫做守恒法.守恒法在中学化学计算中很常用.守恒法在列式时常常可不考虑中间具体过程,故很简便.在计算中运用守恒法,可以大大简化解题的过程,提高解题的速度和正确率.
二、硝酸与金属的反应分析

1.质量守恒
m(参加反应的Cu)+m(参加反应的HNO3)=m(Cu(NO3)2)+m(NO)+m(H2O)
2.原子个数守恒
(1)对于Cu原子:N(参加反应的Cu)=N(Cu(NO3)2)
(2)对于N原子:n(参加反应的HNO3)
=n(Cu(NO3)2中的N原子)+n(NO中的N原子)
=n(Cu(NO3)2)×2+n(NO)
3.电子得失守恒
Cu失电子总数=N得电子总数.即n(Cu)×2=n(NO)×3
4.电荷守恒

在硝酸与金属的反应计算中,常用的是原子个数守恒、电子得失守恒和电荷守恒,质量守恒很少用到.
三、典型例题
1.原子个数守恒
例1 把0.4 mol Cu加入适量浓HNO3中,Cu完全溶解,共收集到0.3mol气体,则反应消耗的硝酸是____mol.
分析如果HNO3一直是浓HNO3,则根据电子守恒,0.4 mol Cu失去0.8 mol电子,n(气体)=n(NO2)=0.8 mol.这与题意不符.所以反应过程应是开始是Cu与浓HNO3反应,由于HNO3不断消耗,后来就成了Cu与稀HNO3反应了.这需要写出2个化学方程式进行计算,计算过程繁琐.但如果运用原子个数守恒法,则可不写化学方程式就能快速而准确地计算出最终结果.
根据Cu守恒,有n(反消耗的Cu)=n(Cu(NO3)2)×2
根据N守恒,有n(反应消耗的硝酸)=n(Cu(NO3)2)×2+n(NO)
=0.4 mol×2+0.3 mol=1.1 mol
例2 将30 g某铜银混合物放入80 mL 13.5 mol/L的浓硝酸中,铜银混合物完全溶解,共收集到0.3 mol气体,反应后溶液中的H+的物质的量浓度为1 mol·L-1.假设反应后溶液的体积仍为80 mL,计算该混合物中铜和银的物质的量各为多少.
分析设合金中铜银的物质的量分别为x、y.
根据N原子守恒,有
n(原来的HNO3)=n(Cu(NO3)2)×2+n(AgNO3)+n(气体)+n(剩余的HNO3)
即:0.08 L×13.5 mol·L-1=2x+y+0.3+0.08 L×1 mol·L-1
再根据合金的质量是30 g,有m(Cu)+m(Ag)=30 g
即:64 mol·L-1×x+108 mol·L-1×y=30 g
联立二方程,解得,x=0.3 mol,y=0.1 mol.
2.得失电子个数守恒
例3 把0.4 mol Cu加入适量浓HNO3中,Cu完全溶解,共收集到0.3 mol气体,计算该0.3 mol气体中NO和NO2各多少mol?
分析设该0.3 mol气体中NO和NO2的物质的量分别为x、y.则有x+y=0.3 mol.
根据还原剂失电子总数=氧化剂得电子总数,有n(Cu)×2=n(NO)×3+n(NO2)
即:0.4 mol×2=3x+y
联立二方程,解得,x=0.1 mol,y=0.2 mol.
例4 足量铜与一定量浓硝酸反应,放出NO2、NO的混合气体,把这些气体与0.075 mol O2混合并通入水中,可使气体完全被水吸收.若向所得硝酸铜溶液中加入5 mol·L-1NaOH溶液至Cu2+恰好完全转化为Cu(OH)2,则至少需要加入的NaOH溶液的体积是____mL.
分析本题涉及反应很多.如果不用守恒法,由于反应有很多,所以解题过程非常繁琐.本题涉及的反应过程有:
①Cu和浓HNO3的反应:

②Cu和稀HNO3的反应:



⑤稀HNO3与NaOH溶液的反应:

⑥Cu(OH)2与NaOH溶液的反应:


3.电荷守恒

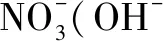
综上所述,在金属与HNO3的反应计算中,经常使用守恒法,可使计算过程简便且计算结果准确度高.本文通过对金属与HNO3的反应的探究,希能对广大师生的教学起到促进作用.
