黄连花的光合日变化及干旱对其光合特性的影响
2019-04-04张彦妮
雷 蕾,张彦妮
(1. 东北林业大学园林学院,黑龙江 哈尔滨 150040;2. 太原植物园,山西 太原 030025)
光合作用是植物生长发育过程中重要的化学反应[1],其将光能转化为可储存的化学能,为植物的一系列活动提供最初的营养[2]。光合速率的大小不仅与物种的遗传特性有关,而且还受许多环境因素的限制,对环境变化较为敏感。作为植物进行光合作用的能量来源,光合有效辐射(PAR)直接影响了植物的光合作用[3]。不同植物光合日变化表现不同,矾根(Heuchera micrantha)的光合日变化呈双峰型,具有明显的“午休”现象[4];黄芩(Scutellaria baicalensis)的光合日变化呈不明显双峰曲线,有轻微光合“午休”现象[5];而有的植物光合日变化随着季节的变化而变化,5月份呈现双峰型,8和10月份呈现单峰型[6]。水分作为光合作用的原材料之一,它的缺失会降低光合酶的活性,影响植物的光合速率,延缓植物的正常生长。如干旱导致东北玉簪 (Hosta clausavar.ensata)和射干 (Belamcanda chinensis)净光合速率显著降低[7-8];随着干旱时间的增加,沟叶结缕草(Zoysia matrella)植株的净光合速率和胞间CO2浓度先增加后降低,气孔导度和蒸腾速率逐渐降低[9]。王莹博等[10]对白芨(Bletilla striata)的研究表明干旱只降低了叶片的光合参数,而对光反应系统并没有造成不可逆的破坏。因此,干旱对植物光合特性的影响因植物而异。
黄连花(Lysimachia davurica)作为报春花科珍珠菜属多年生野生花卉,在国内主要分布于东北三省、内蒙古东北部及华北平原的东北部。其花期在春末至秋初,花期长,花大、色黄、密集,具有很高的观赏价值,且其耐寒性强,在寒冷的东北地区根部宿存于地下而不死,是较为理想的高寒地区绿化资源。此外黄连花还是一种重要的药用材料,具有镇静、降压、治失眠和高血压的功效[11]。目前关于黄连花的研究主要集中在其化学成分的鉴定、分离提取[12-14]、种子萌发、组培快繁体系的建立[15-16]、驯化栽培[17]、自然干旱胁迫对黄连花部分生理指标的影响[18],关于干旱对其光合生理特性的影响尚未见报道。因此,本研究以黄连花幼苗为试验材料,运用LI-6400光合仪测定了自然条件下的光合日变化和不同干旱胁迫下的光合特性,分析黄连花的净光合速率、蒸腾速率、气孔导度等参数的变化,以明确黄连花的光合特性,揭示干旱胁迫对黄连花生长和光合作用的影响机理,为提高植物水分利用效率,实行节水栽培以及园林应用提供参考。
1 材料与方法
1.1 试验材料与处理
试验于东北林业大学园林学院花圃的温室进行。黄连花的组培苗经过缓苗、驯化、移栽后作为备用试验材料。2015年4月选择高度约为8 cm,生长状况基本一致的黄连花生根苗,移栽到装有蛭石的花盆中置于室内阳台(光照强度为自然光照,温度范围为 15~25 ℃)驯化 20 d。其间每周浇灌1次稀释了5~10倍的MS营养液10 mL为其补充营养。驯化结束后,将黄连花移栽至花盆中 (上口径 13 cm,下口径 9.5 cm,高 11 cm),每盆装花卉市场上购买的育苗基质土300 g进行正常的栽培管理,育苗基质土壤pH 4.59,有机质含量15.27 g·kg-1, 全 氮 含 量 18.52 g·kg-1, 全 磷 含 量3.3 g·kg-1,全钾含量 21.41 g·kg-1。
2015年6月14日开始进行盆栽控水(植株的高度为20 cm)。此时温室的温度变化范围为28~38 ℃。试验设置了4个干旱梯度:胁迫时间分别为5、10、15和20 d。每个梯度6盆。试验开始前,对黄连花盆栽进行充足浇水,使土壤水分达到饱和,作为干旱开始(0 d)。开始控水后,对照组每天09:00测量其土壤含水量并对其进行补水,使其含水量控制在85%~87%。待不同梯度的胁迫到达设定的时间后,分别测定对照组的光合日进程以及不同胁迫梯度植株的光响应曲线。
1.2 测量项目及方法
土壤含水量:人工采取盆土1/3位置的新鲜土样,采用恒温箱烘干法,分别测定不同干旱梯度的土壤含水量。
光合日变化:于晴朗无风的天气(18~30 ℃),选用美国LI-COR公司生产的LI-6400便携式光合仪(透明叶室)对黄连花进行不离体测量。测量时采用开放式气路,时间为08:00至18:00,每隔2 h测量一次。机器自动记录净光合速率 [Pn,μmol·(m2·s)-1]、胞 间 CO2浓 度 (Ci, μmol·mol-1)、 蒸 腾 速 率 [Tr,mmol·(m2·s)-1]和气孔导度 [Gs,mmol·(m2·s)-1]。水分利用效率(WUE,μmol·mmol-1)为净光合速率与蒸腾速率的比值[19]。
光响应曲线的测定:于不同干旱梯度的黄连花盆栽中,选取长势和光照相似部位的叶片(从顶部向下数第3片叶子),利用LI-6400便携式光合系统测定各处理的光响应曲线。测量时间为09:00-11:30,采用开放式气路,大气的CO2浓度保持在380~390 μmol·mol-1。LI-6400 的红蓝光源模拟设定光强依次为 1 800、1 600、1 400、1 200、1 000、800、600、400、200、100、50、25、0 μmol·(m2·s)-1。机器自动记录Pn、Ci、Tr和Gs等参数。
1.3 数据处理与分析
采用SPSS 20.0对光响应曲线进行非直角双曲线模型拟合[20],得到最大净光合速率(Amax)、暗呼吸速率(Rd)。根据实测光合数据,对弱光下的光合速率进行直线回归,得到表观量子效率(AQE)和光补偿点(LCP)。将直线回归得到的线性方程与最大净光合速率相交,得到光饱和点(LSP)。采用Excel 2003 进行作图,SPSS 20.0 进行One-way ANOVA单因素方差和显著性分析。
2 结果与分析
2.1 干旱胁迫对土壤含水量的影响
随着干旱胁迫时间的延长,土壤含水量呈现逐渐下降的趋势,胁迫时间越长,影响越严重(图1),各处理组和对照差异明显。0~15 d内,土壤含水量急剧下降,5 d时,土壤含水量降为38.92%,此时叶片出现轻度萎蔫现象,与茎尖方向的夹角变大。胁迫10 d时,土壤含水量为14.25%,叶片皱缩严重,特别是茎尖严重缺水,以致弯曲下垂。胁迫15和20 d的土壤含水量变化不明显,15 d时为4.54%,此时地上部分干枯,复水后可以萌发出新芽,20 d仅为3.93%,整个植株干旱死亡。
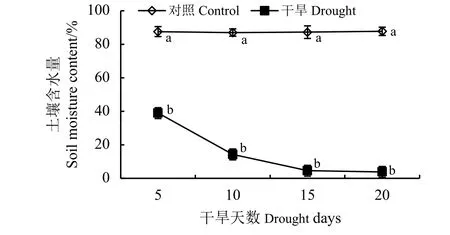
图 1 不同胁迫天数的土壤含水量Figure 1 The soil moisture content after different drought stress
2.2 光合有效辐射日变化和水分利用效率
自然条件下,PAR虽然瞬时变化较大,但日变化规律总体呈“单峰”型,1 d中的最大值出现在10:00-12:00[1 200~1 300 μmol·(m2·s)-1],随后开始减小,到 18:00 时达到最小值 [50 μmol·(m2·s)-1],变化幅度较大(图2)。
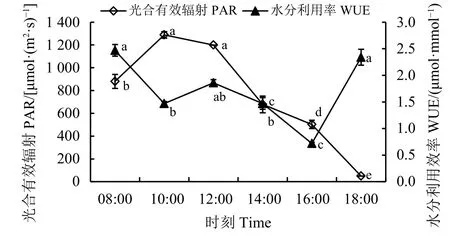
图 2 光合有效辐射日变化和水分利用效率Figure 2 The daily variation of photosynthetically active radiation (PAR) and water use efficiency (WUE)
黄连花全天的WUE值相较于抗旱植物青绿苔草(Carex leucochlora)而言[6]均较低,最大值约为2.5 μmol·mmol-1,分别在 08:00 和 18:00,Pn在 14:00最大时 WUE 仅为 1.45 μmol·mmol-1(图 2),这可能和两个时间段的气孔导度较低有关。而青绿苔草的 WUE 全天最高可达 8.95 μmol·mmol-1,说明黄连花对外界环境中水分的依赖性较高,抗旱能力一般,对干旱环境的适应力较弱。
2.3 黄连花的光合日变化
黄连花的净光合速率(Pn)在1 d中的变化呈“单峰”型,没有“午休”现象(图3)。08:00时由于气温较低、光强较弱,Pn值较低。随着PAR的增强,叶片可利用的光能变多,Pn逐渐增大,14:00左右达到最大值[9.18 μmol·(m2·s)-1]。Pn的最大值相对于PAR 出现时间推迟,可能与PAR的瞬时变化幅度较大有关。
胞间CO2浓度(Ci)日变化规律与Pn基本相反,在08:00到16:00趋于平稳,波动较小,差异不显著(P>0.05)。18:00时突然急剧上升,并达到一天中的最大值 (699.07 μmol·mol-1)(图 3)。

图 3 净光合速率和胞间CO2浓度日变化Figure 3 The daily variation of net photosynthetic rate (Pn)and the internal CO2 concentration (Ci)
蒸腾速率(Tr)在1 d中的变化呈现“双峰”型,两个峰值分别位于 10:00 [4.92 mmol·(m2·s)-1]和 16:00[6.47 mmol·(m2·s)-1], 18:00 达 到 最 小 值 [0.17 mmol·(m2·s)-1]。气孔导度 (Gs)日变化随着时间的变化呈“单峰”型曲线(图4),14:00前呈现逐渐增加的趋势,且12:00前差异不显著,14:00时有了大幅度的提升,达到最大值[0.32 μmol·(m2·s)-1]。14:00 后开始逐渐降低,且各时间段之间差异显著(P<0.05)。
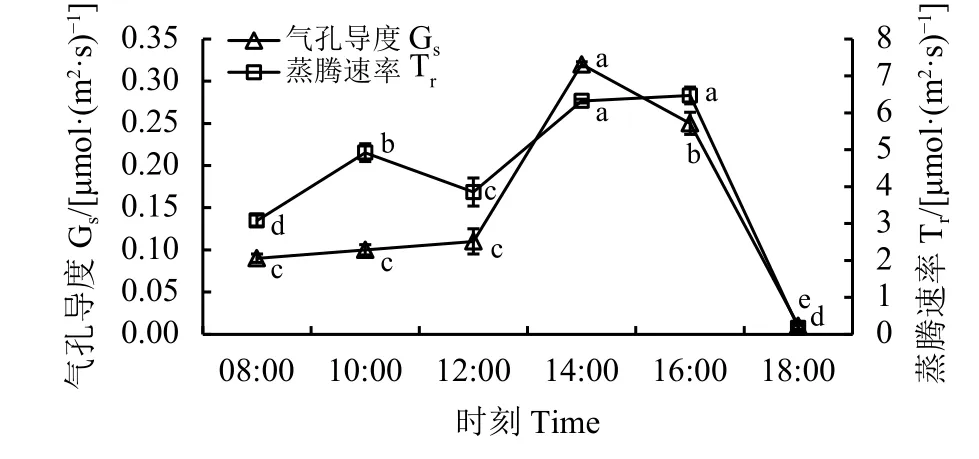
图 4 蒸腾速率和气孔导度日变化Figure 4 The daily variation of transpiration rate (Tr) and stomatal conductance (Gs)
2.4 干旱胁迫对黄连花幼苗光响应曲线的影响
自然条件下,黄连花的Pn在PAR小于400 μmol·(m2·s)-1时呈直线型增长,随后增长率逐渐减小,在 PAR 为 1 200 μmol·(m2·s)-1时达到最大值 [11.61 μmol·(m2·s)-1]。而在干旱条件下,干旱胁迫 5 和 10 d的黄连花尽管生长状况较弱,Pn明显低于CK,但是依然保持正值缓慢增长,在PAR为1 200 μmol·(m2·s)-1时 达 到 最 大 值 , 分 别 为 1.38 和 0.11 μmol·(m2·s)-1,较对照分别减小了 88.11% 和 99.05%(图5)。而干旱15 d时Pn全程均为负值。
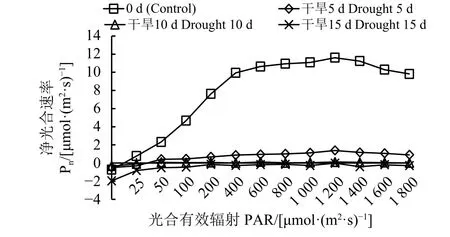
图 5 干旱胁迫对黄连花净光合速率的影响Figure 5 Effect of drought stress on net photosynthetic rate(Pn) of L. davurica
自然和干旱条件下黄连花的胞间CO2浓度(Ci)整体表现为随着光照的增加而减小,变化趋势基本与净光合速率相反(图6)。除干旱10 d在光合有效辐射为 50 μmol·(m2·s)-1时低于对照组外,其余各处理组的Ci浓度高于CK,胁迫15 d最高。

图 6 干旱胁迫对黄连花胞间CO2浓度的影响Figure 6 Effect of drought stress on the internal CO2 concentration (Ci) of L. davurica
干旱条件下,气孔导度和蒸腾速率的变化趋势与净光合速率基本相同(图7、图8),且随着胁迫

图 7 干旱胁迫对黄连花气孔导度的影响Figure 7 Effect of drought stress on the stomatal conductance (Gs) of L. davurica
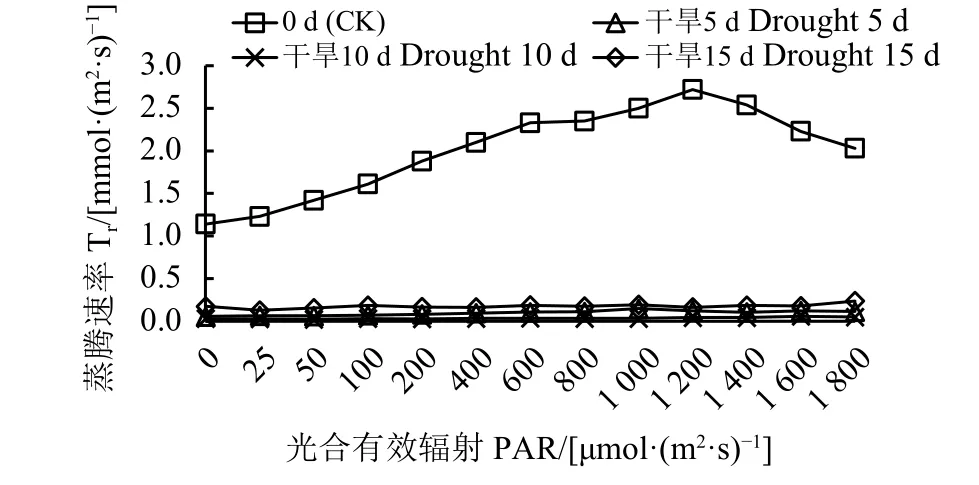
图 8 干旱胁迫对黄连花蒸腾速率的影响Figure 8 Effect of drought stress on the transpiration rate(Tr) of L. davurica
时间的延长先下降后上升。胁迫 5 d 及 10 d 内二者呈下降趋势,15 d时有一个小幅度的上升。
利用非直角双曲线模型对各处理的光响应曲线进行拟合,决定系数(R2)均在0.9以上(表1),说明此模型能够较好地说明不同干旱胁迫条件下黄连花的光响应过程。
干旱胁迫下,随着胁迫程度增加黄连花的最大净光合速率(Amax)呈现快速下降的趋势。干旱胁迫 5、10和 15 d的 Amax与对照相比分别降低了85.32%、96.59%和102.30%(表1)。说明干旱胁迫对黄连花的最大净光合速率有明显的抑制作用。

表 1 不同胁迫时间的黄连花光响应参数拟合值Table 1 The fitting value of light response parameter in different time of drought stress of L. davurica
暗呼吸速率 (Rd)在胁迫10 d及 10 d内缓慢降低,干旱15 d明显增加,总体呈现先降低后增加的趋势。干旱胁迫下光补偿点(LCP)与对照相比均有不同程度的增加,其中胁迫15 d时LCP最大,较对照增加了15.39倍(表1)。表明干旱胁迫下,光合作用受到限制,植物对弱光的利用率降低。
随着胁迫时间的延长,光饱和点(LSP)呈现先增加后下降的趋势,分别于干旱5和15 d时达到最大值和最小值。胁迫下的表观量子效率(AQE)低于对照,且随着胁迫时间的延长先减小后增大,5和10 d时达到最小值。综合各项指标,表明轻度的干旱胁迫(干旱5 d)降低了黄连花对弱光的利用能力,却提高了对强光的适应能力。而中度和重度的胁迫正好与之相反,这是可能植物对干旱胁迫做出的适应性调整。
3 讨论
受物种本身的遗传特性影响,不同植物其光合作用日变化不同。一般情况下,日变化不外乎单峰型、双峰型、平坦型和不规则型4种日变化模式[21],其中单峰型和双峰型最为常见。本研究中,黄连花的净光合速率(Pn)在1 d中的变化呈“单峰”型,没有“午休”现象,在 14:00 达到峰值 [9.18 μmol·(m2·s)-1]。因此,黄连花和其他植物一样,其光合速率主要受光照影响。在光合日进程中,黄连花保持较高的净光合速率 [≥5 μmol·(m2·s)-1]的时间较长,长达8 h,且无“午休”,表明其对光环境的适应能力较强,能够高效地积累光合产物。蒸腾速率(Tr)和气孔导度(Gs)日变化趋势与Pn基本相同,14:00达到最大值。这与任建武等[22]、柯世省等[23]的研究相一致,因为光合作用的原料(水和部分矿质营养元素)的运输均依赖于蒸腾作用。因此,一般来说,蒸腾速率与光合速率呈正比。胞间CO2浓度(Ci)日变化与Pn基本相反,18:00时达到最大值,这可能是由于傍晚时分的光照较弱,气温较低,植物对CO2的固定能力下降,导致CO2在细胞内积累增多[24]。
干旱环境中植物的光合速率降低是所有植物的共同现象[25]。对于黄连花,所有处理的净光合速率(Pn)在一定范围内(光饱和点)均会随着光强增大而增大,达到最大值后开始逐渐减小,即出现了光抑制效应。而干旱15 d时Pn全程均为负值,此时植株的能耗输出显著大于输入,已不再具有维持生命活动的能力,这与张彦妮等[18]所得到的干旱15 d时部分植株的地上部分死亡的结论相符合。干旱下Ci高于对照,这可能是由于干旱降低了植株的净光合速率,导致叶片对CO2的固定能力较弱,胞间CO2得不到有效利用导致其大量积累。而CO2利用率的减小可能与干旱降低了光合作用关键酶的活性有关[26]。气孔导度在干旱条件下明显降低,且在1 d内的变化不明显,这可能是干旱在一定的时间范围内诱导了气孔关闭,降低了蒸腾速率,且此时的干旱胁迫已对气孔间接造成了一定的伤害,导致气孔对光强的响应不敏感,基本失去了调节控制作用[27]。
引起Pn降低的原因有气孔和非气孔因素[28]。前者是指逆境使气孔导度受到限制,导致胞间CO2浓度不能满足光合作用的需求,后者是叶绿体活性与核酮糖-1, 5-二磷酸羧化酶(Rubisco)活性降低、1, 5-二磷酸核酮糖(RuBP)再生能力降低等引起光合作用能力降低。检验Pn下降的原因是否为气孔因素关键是Gs和Ci[29]:二者在同一时间范围内变化趋势一致即为气孔因素,反之则为非气孔因素。本研究中,Gs随着胁迫时间的延长先降低后上升,而Ci则持续上升。气孔导度逐渐下降,这可能是黄连花主动适应干旱胁迫的一种生态避旱策略,通过减少气孔的开度,减少体内水分过度的蒸腾,但是这也限制了胞间CO2和空气中O2的交换,限制了CO2及时排出,导致Ci上升。参照以上标准,干旱胁迫10 d以下,非气孔因素是导致Pn下降的主要原因,而胁迫15 d,气孔限制是引起Pn降低的主要原因。此结果与黑麦草(Lolium perenne)和苇状羊茅(Festuca arundinacea)[30]、高羊茅 (Festuca pratensiscv. Houndog V)[31]的研究结果相一致。
叶片光响应曲线是叶片净光合速率随定额光源强度变化而变化的趋势。其中,AQE是净光合速率与光合有效辐射的比值,其大小反映了植物对于光能的提高光能转化效率[32],结合LSP和LCP可以在一定程度上反映植物的抗旱机制。张志刚和尚庆茂[33]对辣椒(Capsicum annuum)的研究发现,其通过提高光能转化效率,降低强光的适应性和对弱光的利用能力以响应逆境。而黄芪(Scutellaria baicalensis)通过提升植株对强光的适应性和对弱光的利用能力来加强自己的防御系统[5]。本研究中,黄连花的AQE降低,LSP先增大后减小,LCP增大,表明轻度干旱降低了黄连花对弱光的利用能力,却提高了对强光的适应能力。这与华北绣线菊(Spiraea fritschianad)和金山绣线菊(Spiraea japonica)[34]在轻度胁迫下的抗旱机制相同。
4 结论
自然条件下,黄连花净光合速率(Pn)在1 d中的变化呈“单峰”型,在14:00达到最大值[9.18 μmol·(m2·s)-1],没有“午休”现象,基本与 PAR 的日变化趋势相同。自然干旱条件下,黄连花可以承受10 d的胁迫,其通过增大光照的适应范围,提高强光的利用率以响应逆境,这是植物对于干旱胁迫的适应性调整。综上所述,黄连花对外界环境中水分的依赖性较高,抗旱能力一般,对干旱环境的适应力较弱。
