常州市仿制药一致性评价工作分析与对策
2019-04-04潘华阳郭伟滕一万偰蜀江蒋鹏举
潘华阳,郭伟,滕一万,偰蜀江,蒋鹏举
(1. 常州市生物技术发展中心,江苏 常州213131;2. 中国生物技术发展中心,北京 100039;3. 常州大学制药与生命科学学院&护理学院,江苏 常州 213164)
首个获得某新药生产许可的具有知识产权的药品通常称为原研药,申请人享有该药品的专利保护。当专利过期后,其他申请人以相同的化学名称或通用名称、剂型、规格、用法用量申报注册的药品便是仿制药[1]。
对已批准上市的仿制药,按与原研药质量以及疗效一致的原则,分期分批开展质量和疗效一致性评价即为仿制药一致性评价(简称一致性评价)工作[2]。
1 一致性评价工作的背景
目前,国内医药消费市场主体仍为仿制药,大量低水平重复建设充斥其间,同质化竞争相当严重。据了解,在我国近3 300个化学药品中,大约有260个品种占据注册文号总量近70%;在医药学研究方面,早期批准的仿制药做得并不十分完善,进入市场也相对容易,这些因素也导致了国内仿制药整体水平不高;尽管本土仿制药相比进口原研药品有很大的价格优势,但在临床疗效方面确与原研药存在不小的差距;上海华山医院某专家对尼莫地平片(国产仿制)和拜耳集团所产的尼莫地平片(原研)进行生物等效性(简称BE)对比试验后发现,国产仿制尼莫地平片的生物利用度远低于原研尼莫地平片[3-7]。
原国家食品药品监督管理总局(简称国家食药监总局)在《药品注册管理办法》(2007年)中强调,仿制药与原研药在质量、用药方式、治疗效果等方面要求一致。该办法旨在确保仿制药与原研药的质量与疗效一致,使得我国仿制药质量在一定程度上有所提高。但《药品注册管理办法》只针对该办法出台后新申报的仿制药,对此前已上市的仿制药并无约束。
《国家药品安全“十二五”规划》中明确规定要争取在5 ~ 10年内完成对《药品注册管理办法》(2007年)实施前注册的仿制药与原研药的对比研究,该研究的内容就包括药品质量、疗效等。随后,国务院办公厅、原国家食药监总局陆续出台相关政策来推进该工作,因这些政策不具有强制性,相关企业的意愿并不强烈,截至2014年底,此项工作并无明显进展。
国务院于2015年下半年发布《关于改革药品医疗器械审评审批制度的意见》,开展一致性评价工作又一次被提出,并且该工作的开展刻不容缓,这标志着我国一致性评价工作再次启动,成为国家医改工作的重点。
国务院办公厅于2016年初发布《关于开展仿制药质量和疗效一致性评价的意见》,针对一致性评价工作提出了更为明确、详细以及带有强制属性的要求,我国一致性评价工作正式进入实质性阶段。之后,相关部门陆续出台一系列相关政策措施(见表1)来大力推进该项工作迅速而全面地展开,一致性评价工作正式开始[8-11]。

表1 我国出台的一致性评价相关重要政策Table 1 Important policies related to consistency evaluation issued in China
开展一致性评价,将促使我国仿制药行业一直以来“小、乱、散”的局面得到扭转,大幅度提升我国制药行业整体水平、药品安全性及有效性,加快医药产业转型升级的步伐,提高我国在医药领域的国际地位[12]。
2 国内一致性评价工作整体进展情况
推进一致性评价是国家药品监督管理局(简称NMPA)近年来的重点工作之一。截至2018年10月底,NMPA已通过其官方网站陆续发布了17个批次关于一致性评价的参比制剂目录,共610个品规,覆盖2018年底前须完成仿制药一致性评价的289个品种目录(简称289目录)中的大部分品种,但仍有少部分品种的参比制剂没有被公布[根据国家药品审评中心(CDE)发布的参比制剂目录统计]。
结合一致性评价各个阶段统计数据看,部分药企已完成所申报一致性评价品种的药学研究工作,现已进入选定医药研发合同外包服务机构(CRO)进入临床BE试验阶段。同时,有少部分药企的部分品种已获得NMPA的批准,通过了一致性评价。
根据“丁香园Insight一致性评价数据库”统计,截至2018年10月,289目录目前启动率为39.9%,通过的289目录品种仅19个(19个品种涉及多个品规)。截至2018年10月,一致性评价药品通过药企达3家以上的品种已增至7个(数据来源于《中国上市药品目录集》),包括:苯磺酸氨氯地平片、瑞舒伐他汀钙片、厄贝沙坦片、头孢呋辛酯片、富马酸替诺福韦二吡呋酯片、草酸艾司西酞普兰片、蒙脱石散[13]。
据《新华日报》报道,截至2018年10月,江苏省开展一致性评价的口服固体制剂达到451个,涉及93家相关药企和254个品种,已完成研究并获受理的品规达62个,排名全国第1位;16个品规获批通过一致性评价,排名全国第2位[14]。
3 常州市一致性评价工作面临的形势分析
从常州市新医药产业整体经济产值来看,仿制药仍是常州市新医药产业发展的重点。据常州市食品药品监督管理局提供的数据显示,2017年常州市药品生产持证企业有49家,目前正常运营的有38家,实现产值83.82亿元,销售84.58亿元,利润12.57亿元,利税23.26亿元,出口2.1亿美元。按生产类型分类,这些企业中原料药和制剂生产企业共计27家,占正常运营药品持证企业的70%以上,且大多以仿制药生产为主营业务。此次一致性评价工作,对常州市药企来说,既是挑战,更是机遇。
从企业数量来看,目前受到一致性评价影响的包括常州四药、常州制药、常州康普药业、亚邦集团等9家药企,其中不乏主营业务年收入超过20亿元的明星药企。笔者对常州市涉及一致性评价的企业进行了密集走访,针对其中主营业务收入高且受此次一致性评价影响较大的常州市3家医药产业龙头企业(常州四药、常州制药厂、亚邦集团)通过实地调研、现场办公及结合线上线下问卷调查的方式进行了更为细致深入的研究,发现这3家药企涉及到需开展一致性评价品规数均在10个(含10个)以上。
CDE已于2017年12月发布《已上市化学仿制药(注射剂)一致性评价技术要求》(征求意见稿),由此注意到,一致性评价(注射剂)工作也已很紧迫,常州市相关政府部门及企业均需提前布局筹划。
3.1 常州企业一致性评价工作进展情况
整体来看,常州属于全国第一批对一致性评价做出快速应对并对相关企业给予专项政策及资金扶持的地区,常州市推行的一系列措施对企业开展一致性评价工作起到了积极的推动作用,一定程度上为企业减负增效。
具体来看,2018年7月,常州制药厂从NMPA领取了《药品补充申请批件》,该公司生产的卡托普利(captopril,1)片(规格:25 mg)经NMPA审查,符合一致性评价要求,成为常州市首个也是唯一一个通过一致性评价的药品。据了解,常州制药厂是国内卡托普利片生产厂家中首批通过该品种一致性评价的企业[15-16]。

卡托普利片主要成分是卡托普利。卡托普利是一种血管紧张素转换酶抑制剂,主要适应证为高血压与心衰[17]。美国施贵宝公司3位科研人员于1975年开发出此药,1977年在美国获得该药专利。常州制药厂卡托普利片2017年销售额超过1亿元,且常年占据近40%市场份额,排全国第一。
自一致性评价工作开展以来,常州制药厂已累计投入资金3 000万元以上,此次卡托普利片率先通过一致性评价,可实现原研药的临床替代。同时,在医保支付、药品集中采购、政府奖励、产业基金扶持等方面均将获得大力支持[18]。卡托普利片已被纳入《国家基本医疗保险、工伤保险和生育保险药品目录(2017年版)》[简称医保目录(2017版)]中的甲类用药,这将大大有益于通过一致性评价的药品。治疗高血压的药物虽说市场需求巨大,但也竞争激烈,先通过一致性评价的药企无疑占据了市场优势高地,未通过评价的药企在面对3家已通过同一品规药品一致性评价的药企时,将失去进入医院药品集中采购目录的资格。常州制药厂卡托普利片此次顺利通过一致性评价,将对该公司占得市场先机、进一步发展产生积极作用。
主要用于治疗轻、中度原发性高血压的一款血管紧张素Ⅱ受体拮抗剂抗高血压类药物缬沙坦(valsartan,2)片是常州市一家药企的明星产品,由于缬沙坦片在289目录之中,因此也需要进行一致性评价。据了解,该企业的缬沙坦年销售额在5亿元以上,占该企业全年主营业务收入约20%。

此前,华海药业因为在缬沙坦原料药中被检出基因毒性杂质亚硝基二甲胺(NDMA),美国FDA与欧洲EMA均对华海药业部分产品发布进口禁令,并且美国消费者对华海药业发起了要求赔偿2 000万美元的诉讼。我市这家生产缬沙坦片的药企第一时间找到权威检测机构进行针对NDMA的检测,经过多次多批次的检测,结果是意料之中的零检出。如果该企业此次能通过一致性评价,势必将进一步抢占市场份额,获得更多利润。该企业目前已经完成缬沙坦的药学研究工作,并已委托CRO进行BE试验阶段工作。据CDE数据显示(更新日期为2018年9月20日),该企业的缬沙坦BE试验,于2018年7月19日通过伦理审查委员会审查,并于2018年8月23日接受第一例受试者入组,现已完成招募,BE试验正在有序进行中。在顺利通过BE试验之后,即可开始准备资料向CDE进行申报,等待现场核查通过后获得发件批准。
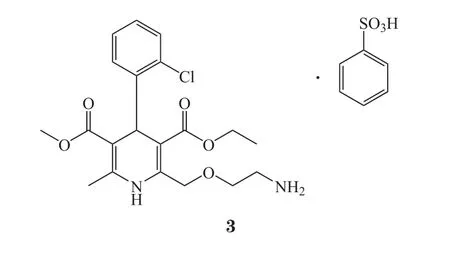
苯磺酸氨氯地平(amlodipine besylate,3)片是一种钙通道拮抗剂,可用于治疗心绞痛和高血压[19]。该产品常州市至少有2家药企将其作为主打降压产品之一在生产,其销售额在本就竞争激烈的高血压药品市场还继续能保持在千万元级别以上。据了解,扬子江药业和江苏黄河药业所生产的苯磺酸氨氯地平片均已通过一致性评价,苯磺酸氨氯地平片一致性评价通过厂家已达到3家,对于国内该品种其他仿制药生产厂家而言,若未能在2018年底前通过一致性评价,将彻底失去市场,NMPA也针对此类情况做出了相应的规定[20]。因此,常州市生产该药品的药企,若想继续分享市场利益,则面临着巨大的压力,必须抢在2018年底前通过一致性评价。价格方面,国产仿制苯磺酸氨氯地平片与原研药相比几乎没有优势,降价空间小,当前对于通过一致性评价企业的激励政策,国内企业也应当牢牢抓住。常州市药企唯有加快进度通过一致性评价,才能不被市场淘汰。据CDE临床试验登记平台最新数据显示,我市已有至少2家企业进入苯磺酸氨氯地平片一致性评价的BE试验阶段,招募工作均已完成,临床试验正在进行中。
上述3家企业均已完成了一致性评价品种的药学研究工作,极少数品规暂时还在确定CRO阶段,超过60%的品规已完成BE备案,并已完成临床试验招募,正在进行临床试验,还有少数品规已完成BE试验,进入到申报或准备接受现场核查阶段。
整体来看,常州市重点品种的一致性评价工作进展较为顺利,如无意外,这些品种均能在2018年底前向NMPA递交申报材料。
3.2 一致性评价工作给常州医药行业发展带来的机遇
目前,大部分临床效果好、深受患者青睐的药品,其大部分市场份额还是被外企也就是原研厂家所占有。同品种的国内仿制药生产企业只能占据很小一部分市场份额,企业销售所得到的利润往往也只能勉强维持运营。国产仿制药与原研药的竞争明显处于劣势。国家开展一致性评价,是要以此为契机,推动国产药与原研药“同质等效”,利用国产药的价格优势逐步对售价高昂的原研药实现替代,同时淘汰行业内无法通过一致性评价的中小企业,实现医药行业资源的重新优化整合。
通过一致性评价不是护身符,更大意义上是得到一张共享药品市场份额的“入场券”。所以,常州市医药企业若能抓住这次机会通过一致性评价,获得进一步分享与扩大市场份额的“通行证”,才能享受各级政府给予通过一致性评价企业的政策、资金等红利,才能获得资本市场给予的奖励与回报。常州市药企可以凭与原研药相比同等的质量,但更低的价格抢占原研药的市场份额,获得更多的资金和经验积累,为企业未来继续做大做强,提升原始创新能力,实现更高层次的自主创新打下基础,推动常州市医药企业以优质的产品、确切的疗效逐步扩大对欧美发达国家的药品输出,提升常州市制药行业的国际地位和影响力。
4 一致性评价工作中遇到的问题
在调研中得知,常州市药企在开展一致性评价工作中并非一帆风顺,也遇到了不少的问题。目前阶段主要在以下几个共性方面问题比较突出。
4.1 参比制剂不明确、难获得
截至2018年10月,NMPA已经陆续发布17批参比制剂目录,其中289目录中仍然有部分品规的参比制剂仍处于研究中,或者无企业备案暂不推荐。除此之外,部分已经发布的参比制剂采购不到或已经退市的情况也有存在[8]。
另外,现在已经发布的目录存在不够合理的地方。以常州市某药企涉及一致性评价的抗生素类产品阿奇霉素为例,在进行该产品一致性评价的40多家药企均选择某国外药企生产的阿奇霉素作为参比制剂的60天内,原国家食药监总局并没有给出关于该备案的否定意见,企业为了赶进度,立即投入大量人力、物力、财力开展一致性评价,在数月之后原国家食药监总局公布的参比制剂却与企业备案的完全不同,这意味着企业将面临巨大的损失,先前的巨额投入可能白费[21-22]。幸运的是,原国家食药监总局后期补充了前期大多数药企备案时所选择的美国辉瑞所产希舒美作为阿奇霉素胶囊(250 mg)参比制剂,科学合理地避免了企业的损失。
此外,在调研中不少企业反映,原研进口参比制剂需要向国外机构购买,由于进口药品通关检验手续复杂,检验周期长等原因,导致企业购买参比制剂的到货周期过于漫长,一定程度上拖慢了企业一致性评价的进度,且由于近阶段中美贸易战升级等原因也给需要从美国境内购买参比制剂的企业造成了一定的困难。
4.2 临床资源短缺且费用高
尽管针对BE试验机构数量和效能不足的问题,原国家食药监总局已在相关文件中规定,对BE试验机构从2015年底实行新型管理模式(备案管理制度)。一致性评价中的BE试验,企业可以选择在现有已经认定且具备相应资质的临床试验机构开展,也可以选择在其他已经备案且具备相应条件的试验机构进行。但由于短时间内需要开展BE试验的仿制药生产厂家数量过多,且备案管理相关的配套规定和标准还不够细化,这些原因均使得有能力开展BE试验的临床机构数量和效能严重不足[20]。
在调研中,大多数企业均反映,BE试验中,受试者的招募也是一个难题,尤其是一些精神类药物需要进行受试者招募时,这个问题则更为突出。受试者招募往往对受试人员的数量、性别、年龄、身体健康状况等有着近乎苛刻的要求;患者获取相应新药进行临床试验的渠道也较为单一,通常仅仅是在门诊就诊时获得相关信息,或者从病友口中得知,这样也导致有一部分符合条件的受试者因无法及时获知新药临床试验受试者招募信息而无法参加临床试验;相比于国外,国内企业向受试者支付的临床损害补偿费也没有竞争力,同品种药品,部分受试者更倾向于报名参加欧美药企在国内组织进行的临床试验。
从临床试验风险角度考虑,临床机构更愿意承担欧美知名药企更为成熟品种的临床试验。一些三甲医院的临床试验机构中部分工作人员并不是专职人员,还要兼顾门诊和手术的工作,所以临床机构的工作人员也相对紧缺。因此,一致性评价中BE试验周期长,临床试验成本高也不难理解[23-24]。
4.3 资金投入大
常州市医药企业一致性评价工作的牵头人在座谈中反映,其在一致性评价中每一个品种至少要投入1 000万元用于药品的药学研究、工艺改进、硬件升级、临床试验等环节。这些企业往往手握的在289目录中的药品批文不是1个,而是10多个甚至20个,在经过市场调研,利润考虑,权衡利弊后往往还有8个以上的品种必须要开展一致性评价,这就意味着在短短一两年时间内要集中投入将近1亿元开展一致性评价。对于上市公司或者集团化运营的药企来说,这笔费用是可以在短时间内筹措的,但是对于一些中小微企业,其每年的利润才刚过千万元,甚至不足千万元,这笔巨额的投入对其而言无疑是毁灭性地打击,以至于一些企业不得不退出市场,或者被生产同品种药品的大企业收购,作为其代工厂才能继续生存下去[25-26]。
4.4 一致性评价相关人才紧缺
制药企业在药品研发领域人才紧缺。一致性评价开展之前很多制药企业对研发重视力度不够,相当数量生产型企业没有药学相关研发人员、临床研究人员等。一致性评价项目只能委托到部分CRO公司进行处方工艺再开发。随着越来越多产品进入临床阶段,临床监察员等岗位也出现供不应求的局面。
5 常州市推动一致性评价工作的相关对策建议
5.1 科学、合理、有据可依选择参比制剂
企业开展一致性评价过程中,选择参比制剂应当遵循科学、合理的原则。根据企业需开展一致性评价的产品,严格对照NMPA发布的各批次参比制剂目录,寻求对应的参比制剂。同时,企业在购买参比制剂时,必须按照目录中指定的生产厂家、产地、规格等要素去执行,缺一不可,否则企业极有可能自行承担研究工作不被CDE认可的巨大风险。若企业开展一致性评价的产品,NMPA还未公布指定参比制剂,建议企业在提前开展相关研究时,就自行选定的参比制剂相关事宜与CDE保持密切沟通,以免造成不必要的人力、财力、物力的浪费[27-30]。当企业在购买NMPA公布的参比制剂时遇到依靠自身无法解决的困难时,也可以及时与中检院取得联系,寻求帮助。
5.2 保证充足优质临床资源供给
建议常州结合国家发布的临床试验机构领域相关政策,筛选储备一批具有承接临床试验能力的机构。鼓励有能力开展BE试验的医疗机构加大投入、加快进度, 在保证临床试验高质量开展的前提下,多承接本地药企一致性评价BE试验。此外,药物临床试验机构应当跟上国家药品审评审批制度改革的步伐,主动加强政策学习。常州市食品药品监督管理局、卫计委等相关部门应协同推进常州市优质临床机构建设及一致性评价工作的开展[31]。
在受试者招募方面,充分利用各平台媒体、互联网建立,并畅通药物临床试验信息流通渠道,扩大信息流通面,便于更多符合条件的受试者参与到药物临床试验中来。同时建议相关企业或临床试验机构加大对受试者的临床损害补偿,以提高受试者的参与积极性。
5.3 多元化加强产业金融扶持,缓解企业资金压力
企业在积极争取政府专项资金支持的同时,政府也应科学引导企业合理引入风险投资资金等金融资本来缓解企业的资金压力,保障药企顺利开展一致性评价工作。同时积极落实税收优惠政策。开展一致性评价工作的药企,在产品工艺改良、硬件提升、新技术开发等方面产生的研发费用,符合条件的按相关规定税前加计扣除。此外,对通过一致性评价的我市药企在金融贷款方面也考虑给予一定的政策优惠[32]。
5.4 多渠道保障专业人才供给
市科技局、市人社局、市科协等相关部门深入了解企业一致性评价工作过程中急需的人才类型,有针对性地帮助招纳相关专业人才,助推专业人才多方向流动,多地点提供技术支持。同时,企业也应当积极培养、引进技术研发人员以及临床监察员,以适应一致性评价工作的要求和发展。
5.5 推进药品招标采购科学改革
常州市药品集中采购相关部门,应保持药品分类采购常态化,突显药品临床价值,在充分考虑药品成本的基础上,在常州市形成一套升降有序、科学合理的采购机制,进一步激发常州市药企提高药品质量的积极性。
常州市负责药品招标采购的相关部门在制定相关政策时,也可酌情参考浙江、上海等兄弟省市关于药品招标采购的政策[33]。
5.6 充分合理利用药品上市许可持有人制度
2017年11月,常州市食品药品监督管理局印发了《常州市药品上市许可持有人(MAH)制度试点实施方案》,鼓励加大新药研发力度,促进产业升级的同时,更好地推进常州市一致性评价工作。在常州市医药产业转型升级的大背景下,部分品种的产业链布局也正在重新配置,尤其是仿制药品种。在此过程中,为了更好推动常州市医药产业转型升级,需加快推动MAH制度与仿制药一致性评价政策的联动和衔接,推动仿制药一致性评价品种充分利用MAH制度加快落地。
5.7 提前布局注射剂产品一致性评价工作
在《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》已经发布的大前提下,一致性评价(注射剂)工作在常州市也已逐步有序开展。《意见》中虽没有提出具体的完成时间,但也指出了将在未来5 ~ 10年内完成该项工作[34]。据2018年9月对美迪西生物医药有限公司CMC副总裁李国栋先生的一次专访中得知,目前全国已经向NMPA提出注射剂参比制剂备案的企业至少有52家,拟评价的注射剂品种达66个以上,经历了固体制剂一致性评价后,企业对此次的注射剂一致性评价工作重视程度可见一斑。另据不完全统计,常州市至少有2家药企(千红制药、常山生化)也已正式启动了注射剂一致性评价的相关工作。因此,涉及注射剂一致性评价的常州市药企应当尽快布局相关工作,包括政策、技术研究、资金准备等。常州市地方政府也可以制定相关激励政策提前支持相关注射剂品种开展研究和探索。
6 结语
随着常州市一致性评价工作不断地深入,医药产业资源将进行重新优化重整,资源利用率大大提升。同时,同一通用名的仿制药质量也得到同步大幅提升,仿制药产品是否通过一致性评价将在药品集中采购中成为评价药品质量的重要因素。一致性评价结束后,仿制药质量及临床疗效等同于原研药,这也将促使企业技术升级。部分仿制药企业由于受仿制药研发成本的影响,可能会逐步将研发重心向创新药转移。很多早期上市的仿制药产品在此次一致性评价过程中,面临处方工艺变更,从而引发企业工艺技术改进、软硬件升级改造,这又进一步推动了常州市医药产业的创新。
