Tet蛋白在阿尔茨海默病疾病进程中的作用研究进展
2019-04-04张弘刘昊晨何华柳晓泉
张弘,刘昊晨,何华,柳晓泉
(中国药科大学药物代谢动力学研究中心,江苏 南京 210009)
阿尔茨海默病(Alzheimer’s disease,AD)是一种慢性神经退行性疾病[1]。AD的疾病成因至今尚未被阐明[2],但随着神经细胞培养和动物模型研究的深入,人们发现某些早期环境改变诱导的DNA甲基化水平变化可导致β-淀粉样蛋白(amyloid-β peptide,Aβ)表达上调,从而将AD发病与DNA甲基化联系起来[3]。此后,人们开始在全基因组水平和基因特异性水平上展开了对AD样本DNA甲基化的研究[4]。同时,作为DNA甲基化的重要标志物5-甲基胞嘧啶(5-methylcytosine,5mC)和5-羟甲基胞嘧啶(5-hydroxymethylcytosine,5hmC),其含量在AD患者多个脑区的显著变化引起了研究者的注意[5-6],这表明DNA甲基化和去甲基化的动态变化可能在AD疾病进程中起重要作用。作为介导DNA去甲基化的重要催化酶,Tet蛋白家族(teneleven translocation proteins,Tets)的研究受到越来越多的关注,本文对Tet蛋白在AD疾病进程中的作用研究进展进行综述,以期为寻找AD的早期诊断方法与新的治疗策略提供参考。
1 Fe2+、α酮戊二酸依赖的Tet蛋白家族
过去普遍认为,DNA甲基化是细胞为了自身发展而沉默一些基因组的不必要基因的过程。在去甲基酶发现之前,DNA甲基化被认为是一种转录沉默中重要的不可逆机制,该观点在发现Tets具有DNA去甲基化能力之后被推翻,这意味着在生物体的整个生命过程中DNA甲基化是一种高度动态平衡过程[7]。Tet蛋白最初是在急性髓细胞和淋巴细胞白血病的罕见病例中被发现[8]。在哺乳动物中Tet蛋白存在3个亚型即Tet1、Tet2和 Tet3。
所有Tet蛋白均含有一个C端催化域,由一个富含半胱氨酸的区域和一个双链螺旋状结构组成(见图 1)[9],其是二价铁离子(Fe2+)和α-酮戊二酸(α-ketoglutarate,AKG)依赖的双加氧酶超家族;Tets需要Fe2+作为辅因子,AKG作为辅底物来催化其反应。铁结合位点的基因突变可以消除Tets的活性。在氧化反应中,一个Tet蛋白将一个氧原子从氧分子(O2)转移至底物的羟基(羟基化),将另一个氧原子结合到AKG,从而导致AKG的脱羧作用,释放CO2并产生琥珀酸盐[10]。Tet蛋白可以反复氧化DNA的5mC生成 5hmC、5-甲酰胞嘧啶(5-formylcytosine,5fmC)和5-羧基胞嘧啶(5-carboxylcytosine,5caC)(见图2)。一方面,5fC和5caC可由胸腺嘧啶DNA糖基酶(thymine DNA glycosylase,TDG)进一步催化,进行碱基基础切除修复(base excision repair,BER),该过程被称为DNA的主动脱甲基化[11];另一方面,在DNA复制过程中,5hmC不能被DNA甲基转移酶(DNA methyltransferase,DNMT)识别,5mC到5hmC的转换将停止,维持现有的DNA甲基化模式,并导致增殖细胞中的DNA被动甲基化减少。因此,通过促进主动DNA脱甲基化和减少DNA被动甲基化从而调节基因的表达,可以动态地调节全局或特定细胞的5mC和5hmC水平[12]。

图1 Tet蛋白结构和Tet1空间结构简图Figure 1 Schematic diagrams of Tet proteins and schematic spatial structure of Tet1

图2 DNA甲基化、去甲基化修饰示意图Figure 2 Schematic diagram of DNA methylation and demethylation
在基因表达调控方面,Tet蛋白起着至关重要的作用。目前普遍认为,Tet蛋白通过其甲基胞嘧啶双加氧酶活性动态调节DNA甲基化,进而调节基因转录。DNA甲基化水平与基因转录成反比。作为DNA去甲基酶,Tet蛋白可动态调节DNA甲基化水平:一方面,Tet蛋白通过结合到CpG富集区域来调节DNA甲基化,进而抑制DNMT活性;另一方面,Tet蛋白通过其羟化酶活性将5mC转换成5hmC以调控DNA甲基化[12]。
Tet蛋白可影响神经干细胞(neural stem cell,NSC)和胚胎干细胞(embryonic stem cell,ESC)的增殖分化(见图3)[13]。多项研究表明Tet1影响成人神经发育[14],在Tet1敲除(Tet1 knockout,Tet1-KO)小鼠中,放射状胶质细胞(radial glia like cell,RGL)的增殖没有变化,但中间神经元祖细胞(neuronal intermediate progenitor cell,nIPC)的增殖减少,导致新生神经元数量减少[15]。Tet2可与神经转录激活因子Foxo3a(forkhead box O 3a)相互作用,参与成人神经干细胞(adult neural stem cell,aNSC)关键基因的转录过程[16]。Moran-Crusio 等[17]的研究发现,Tet2的耗竭刺激了aNSC的增殖,但减弱了aNSC 的分化。同时,过表达的Tet2和Tet3也推动ESC的分化过程。在Sirt6敲除ESC中,抑制Oct4、Sox2和Nanog(Sirt6的下游基因)的表达,可上调Tet蛋白,导致ESC倾向于分化成神经外胚层而非内皮层或中胚层,这表明Sirt6调控的ESC分化是一种Tet蛋白依赖的调控方式[18]。
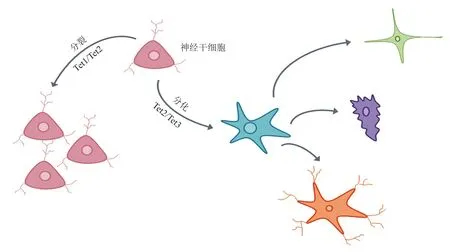
图3 Tet蛋白影响神经干细胞分裂分化过程示意图Figure 3 Schematic diagram of the influence of Tet proteins on the division and differentiation of neural stem cells
此外,Tet蛋白表达还与认知功能有关[19]。研究发现,Tet1-KO动物的海马神经元受损,学习和认知功能存在缺陷[15]。在与神经发生相关的老年海马体中,Tet2表达有所下降;在幼年小鼠海马中模拟与年龄相关的Tet2损失,可以减少神经元形成,损害认知能力;在成熟的海马体中恢复Tet2,可以恢复神经元再生能力,增强认知能力;这表明Tet2是认知损伤恢复的关键分子介质[20]。Tet2在整个大脑皮层处于高表达状态,一项关于Tet2和大脑低灌注的研究表明:大脑皮层中Tet2的增加对于神经元的存活至关重要。功能性实验结果也表明:初生的皮质神经元Tet2耗竭容易导致细胞的死亡[21]。Tet3在原代皮层神经元的表达具有活动依赖性,在成人的前额皮质中Tet3的表达是快速行为适应的必要条件,并且在恐惧消退的记忆形成中起关键作用[22]。
2 Tet蛋白在AD疾病进程中的作用
Tet蛋白在AD疾病进程中主要具有三方面作用:1)Tet基因的单核苷酸多态性(single nucleotide polymorphism,SNP)可能与迟发型AD(late-onset AD,LOAD)具有一定联系[23];2)AD状态下Tet活性改变可导致脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)表达调控异常从而损伤认知功能[24];3)AD疾病进程中Tet蛋白活性改变可能导致海马体区域DNA甲基化异常加重,从而导致认知功能损伤[25]。
2.1 Tet基因SNP与迟发型AD的关联
Morgan等[23]收集了1 160名LOAD患者和1 389名对照组患者的DNA样本和临床数据,分析其10号染色体上已知基因的SNP发现, LOAD患者Tet基因(rs5030882)的SNP相较对照组有所降低,这表明Tet基因的SNP可能参与LOAD的疾病进程。此外,Tet蛋白表达的下调引起神经元形成减少从而导致学习和认知功能障碍,可能是AD疾病进程中重要的一环。
2.2 Tet介导的脑源性神经营养因子表达调控异常
Tet活性改变导致相关BDNF表达调控异常,这在AD疾病进程中起重要作用。BDNF基因的表达受到严格控制,其异常调节与AD和一系列神经发育障碍有关,而BDNF启动子的表观遗传调控是由Tet1完成的,Tet1可通过控制BDNF启动子的可访问性来调控BDNF的表达[24]。对Tet1-KO小鼠的分析发现,多个神经元活动调节基因(包括Npas4、c-cfo和Arc)呈下行调节,此外Tet1-KO小鼠也出现海马区异常和记忆力减退,最终导致突触可塑性受损、记忆减退,这表明神经元Tet1可调节正常神经细胞的甲基化水平,从而调控基因的表达[26]。
2.3 Tet介导的海马体DNA甲基化异常
与正常对照组相比,临床前AD(preclinical AD,PCAD)和晚期AD(late-stage AD,LAD)受试者的海马-海马旁回(hippocampus/parahippocampal gyrus,HPG)中5hmC水平显著升高,表明HPG在疾病进展早期开始主动去甲基化,PCAD组和LAD组的HPG中Tet1显著升高,其表达增加可能是导致5mC氧化明显增加的原因[25]。研究发现,Tet1蛋白水平变化与5hmC水平变化之间不匹配,提示核定位的Tet蛋白的活性可能受到损害[25]。总之,在AD的临床症状出现之前,易受攻击的大脑区域的去甲基化模式已经发生了改变,这表明在AD的发病机制中,DNA去甲基化过程起到重要作用[25]。中枢神经系统中Tet1缺乏,可减少海马齿状回的aNSC增殖,同时导致成人亚粒区神经祖细胞减少。有研究表明:Tet1-KO小鼠显示出海马神经受损,进而导致学习和记忆的损伤[13]。另有研究表明:在AD患者海马体内Tet1蛋白表达减少[26],这可能是导致AD患者学习障碍产生的原因之一。
3 Tet蛋白代谢产物在AD疾病进程中的作用
5hmC是5mC经Tet蛋白催化得到的脱甲基化产物,其在大脑中广泛存在,在发育过程和神经元活动中受到动态调节[27],近年来的研究发现,5hmC在转录表观遗传调节中起着重要作用,能够调节大脑发育和维持成人大脑的功能。因此,5hmC的分布或功能异常可能是神经退行疾病的重要因素[28]。通过对不同去甲基化区域的基因进行筛选发现,与正常对照组相比,AD患者海马体内5hmC的改变影响了包括能量代谢、细胞功能、基因表达、蛋白质降解、细胞结构稳定性等重要信号通路[29]。同时,5hmC在额颞上回的富集与AD的病理特征(包括神经系统缠结、Aβ沉积和泛素负荷)呈正相关,这表明5hmC可能是参与AD疾病进程的主要分子成分[30]。
研究表明:AD晚期几个脑区5hmC水平较低[4,31],如新皮质、海马、鼻内皮和小脑。但亦有研究表明:在AD患者内皮、海马和颞回神经中存在5hmC水平升高[6,32]。这些差异可能是由于研究者研究的脑群(例如鼻内皮质、海马和颞回)以及测定手段 (例如免疫组织化学、蛋白免疫印迹)不同而产生的。
全基因组的研究发现,一些基因与AD患者前额皮质异常的神经形态和突触功能有关,对死后的AD患者前额皮质的5hmC进行全基因组测序及转录测序发现,325个含有不同去甲基化位点(differentially hydroxymethylated loci,DhML)的基因[33]。这些基因的表达与神经元投射发育和神经发生的通路有关,由这些基因编码的蛋白质与AD相关的基因形成直接的蛋白质-蛋白质相互作用,从而扩大了与AD相关的基因网络[33]。同时,在DhML中发现了与AD相关的SNP,表明这些SNP可能识别在AD发病机制中起作用的表观遗传基因调控区域[33]。通过全基因组捕获和高通量测序技术发现,与老年斑显著相关的517个不同去甲基化区域(differentially hydroxymethylated region,DhMR)和60个与神经纤维缠结相关的DhMR。同时还发现,基因体的DNA去甲基化主要与顺式排列基因表达呈正相关[34]。通过观察APP-PSEN1双转基因(DTg)小鼠的大脑皮层、小脑和海马区发现,在海马体中5hmC的含量显著下降,但在大脑皮层和小脑中并未发现5hmC含量下降;通过全基因组分析确定了DTg小鼠的DhMR,发现其在内含子、外显子和基因间区域中高度富集,同时在与神经元发育/分化和神经元功能/生存相关的多个信号通路中,与DhMR关联的基因高度富集[35]。
总之,5hmC水平的变化不仅与正常的大脑功能和衰老有关,也与AD有关。虽然目前仍缺乏在关键脑区特定神经元群体中去甲基化特定模式的信息,但研究发现通过DNA去甲基化过程可以控制AD转录变化以引起分子级联的改变,最终导致AD出现或加速AD的形成[36]。
4 Tet蛋白应用于AD治疗的前景
现阶段虽然没有以Tet蛋白为靶点的AD治疗药物,但通过调节Tet蛋白表达来改善学习和认知功能或可成为潜在的改善或治疗AD的可行方案。如在与神经发生相关的老年海马体中,Tet2表达和5hmC水平有所下降。在幼年的小鼠海马中模拟与年龄相关的Tet2损失,可以减少神经元形成,损害认知能力[20]。在成熟的海马体中过表达Tet2可以恢复神经元再生能力,增强认知能力,这表明Tet2是神经元恢复的关键分子介质[20]。在对5xFAD小鼠(一种过表达2个与AD相关的人源化基因APP和PS1的转基因小鼠)进行环境强化训练后发现,Tet2蛋白表达上调,小鼠记忆和认知能力有所改善[37],表明Tet2可能是AD治疗或辅助治疗的潜在靶点。此外,有研究表明Tet3是调节焦虑、空间学习和短期记忆的关键参与者,Tet3的缺乏会导致关键神经元活动调节基因中的DNA超甲基化[38]。Tet3可以精准地定位于涉及溶酶体功能、mRNA出路和基本切除修复途径的关键基因的转录起始位点,同时Tet3可作为5caC的调节剂,通过基础切除修复,从大脑有丝分裂的神经元主动清除5mC的蓄积,从而起到预防神经退行性疾病的作用[39]。
此外,由于Tet蛋白具有神经元亲和性,越来越多的研究者将其作为脑靶向药物的靶头应用于AD药物。纳豆激酶具有抗Aβ、抗纤维蛋白溶解和抗血栓活性,是针对Aβ的潜在药物,通过纳米封装可改善其不稳定性,但纳米材料的亲水性限制其通过血脑屏障,借助Tet1蛋白的神经元亲和性,将聚乳酸-共聚乙醇酸(PLGA)-包裹纳豆激酶与Tet1蛋白结合,能在不影响其药效的同时增强血脑屏障对药物的通过率,实现纳豆激酶的脑靶向性从而作为抗AD的有效治疗药物[40]。Jia等[41]研制出的由转铁蛋白(Tf)和Tet-1蛋白功能化的双脑靶向聚合体(Tf/Tet-1-POs)能够促进姜黄素进入大脑并提供神经保护。小鼠大脑毛细血管内皮细胞与神经元共培养模型的细胞摄取结果表明:Tf/Tet-1-POs具有明显的转运特性,对神经元具有亲和性,由Tf/Tet-1-POs包裹的姜黄素血脑屏障通过率明显升高。
5 Tet相关生物标志物用于AD诊断面临的挑战
研究人员通过全基因组捕获并进行高通量测序,研究5hmC在AD大脑内特定基因组位点的全基因组分布发现,DNA去甲基化在AD病理过程中发挥重要作用[33-34]。进一步的研究发现,BDNF的外周血异常甲基化与AD发病风险有关[42],提示外周血特定基因去甲基化位点可能与AD疾病进程具有一定关系,这为DNA甲基化/去甲基化相关生物标志物作为AD早期诊断生物标志物提供可能。
现有的大多数DNA甲基化相关生物标志物的临床研究是针对死后的AD患者样本进行基因组甲基化和去甲基化的研究,并没有将基因组甲基化和去甲基化相关生物标志物与早期AD患者的神经心理测试以及影像学建立联系,这是目前DNA甲基化作为AD生物标志物相关研究的局限[43]。若能对早期AD患者进行长时间跟踪随访,定期监测其外周血中5mC和5hmC含量的变化,通过外周血高通量测序分析不同位点DNA甲基化和去甲基化,并建立其与AD患者的神经心理学以及影像学相关数据的联系,找出相关性较强的甲基化或去甲基化位点加以验证,最终找出与AD疾病相关的血液DNA甲基化相关生物标志物,这有可能成为AD早期诊断研究的一大突破。
6 结语与展望
基因表观遗传调控的改变可能在AD的神经退化及认知功能障碍中起关键作用。Tet蛋白的相关表达调控影响了神经细胞的分裂和分化,进而影响了机体的认知功能,成为影响AD疾病进程的重要环节。以Tet蛋白作为潜在治疗靶点可能成为下一阶段AD治疗的研究方向之一。Tet蛋白作用于5mC得到的脱甲基化产物5hmC可作为独立的表观遗传生物标志物,5hmC在不同脑区的分布异常影响了AD患者的认知功能,同时对外周血中特定基因的5mC及5hmC的测序用作AD早期诊断的研究也已不断深入,相关生物标志物有望成为AD早期诊断研究的新方向。
