PARP抑制剂PJ34在绿脓菌素引起的巨噬细胞损伤中的作用
2019-04-03祝飞美何瑾晨黄宁王祎
祝飞美 何瑾晨 黄宁 王祎
(四川大学华西基础医学与法医学院病理生理学教研室,四川 成都 610041)
铜绿假单胞菌(Pseudomonasaeruginosa,PA)是一类易引起多种急慢性感染的革兰阴性机会致病菌,该菌分泌的绿脓菌素(Pyocyanin,PCN)是一种具有氧化还原活性的吩嗪类物质,可自由穿透生物膜[1],通过产生活性氧(Reactive oxidant species, ROS)消耗细胞内还原性GSH并通过抑制细胞内抗氧化信号通路的活化引起广泛的细胞氧化应激损伤,进一步引起细胞功能紊乱,导致包括中性粒细胞[2]、肺上皮细胞[3]等多种细胞死亡。巨噬细胞在PA感染引起的一线免疫应答反应中起重要作用[4],但目前关于PCN对巨噬细胞的损伤作用及机制知之甚少,因此,深入探讨PCN介导的巨噬细胞损伤的具体机制,对于研究新型的免疫辅助药物和解毒药物对抗铜绿假单胞菌感染治疗具有重要意义。
瞬时受体电位2(Transient receptor potential melastain 2,TRPM2)通道广泛表达于多种免疫细胞表面,能被二磷酸腺苷核糖以及H2O2刺激产生的活性氧自由基ROS激活而开放,介导Ca2+离子内流入单核细胞、巨噬细胞、中性粒细胞等,从而进一步引起细胞死亡[5]。PJ34是DNA修复蛋白(poly(ADP-ribose)polymerase,PARP)的抑制剂,可以有效阻断活性氧自由基ROS引起的细胞膜上TRPM2通道[6]。本文拟选用小鼠腹腔来源巨噬细胞RAW264.7作为细胞感染模型,探讨TRPM2离子通道抑制剂PJ34在PCN引起的氧化应激损伤中的作用,为绿脓菌素感染的治疗提供新的思路。
1 材料与方法
1.1 试剂与细胞
MTT (Beyotime公司);胎牛血清(Hyaline公司);DMEM(Gebico公司);RAW264.7细胞均购自上海中科院细胞中心,培养在含10%胎牛血清的DMEM培养基中。
1.2 方法
1.2.1 MTT细胞毒性实验
收集对数生长期RAW264.7细胞制成单细胞悬液,按4×104个细胞·孔-1接种于96孔板,过夜培养后更换含不同浓度PJ34(0,100,200,400,800,1600 nM)或者含不同浓度PCN(0,12.5,25,50,100 μ)的新鲜培养基100 μL。处理24 h后,每孔加入5 mg·mL-1MTT溶液10 μL,于37℃、5%CO2孵箱中避光孵育2 h,弃去孔中培养液,每孔加入150 μL DMSO溶解底部蓝色结晶,摇床避光震荡10 min后上机,于595nm处检测吸光度,每次试验重复3次。细胞生长抑制率
1.2.2荧光显微镜和流式细胞术测定细胞内ROS水平
RAW264.7细胞按照每孔16×104个·孔-1接种于24孔板,过夜后800 nM PJ34预处理2 h(对照组给与0.1% DMSO))加入100 μ的PCN孵育3 h后,PBS洗3次,更换新鲜培养基,加DHE10 μ每孔37 ℃孵育20 min,OLYMPUS倒置荧光显微镜IX73(Ex/Em=518 nm/605 nm)观察。另收集细胞采用流式细胞仪检测细胞内DHE荧光强度。
1.2.3 激光共聚焦显微镜观察细胞内Ca2+水平
取激光共聚焦培养皿,按照每皿1×105个细胞/孔接种。过夜后800 nM PJ34预处理2 h(对照组给与0.1%DMSO),加入 100 μ的PCN孵育3 h,HBSS缓冲液洗3次,后每孔加Rhod-/AM(5 μ),37 ℃孵育30 min,激光共聚焦显微镜(Zeiss LMS 710)下观察细胞内Ca2+水平。
1.2.4 荧光显微镜观察巨噬细胞吞噬功能
RAW264.7细胞按照每孔16×104个·孔-1接种于24孔板,过夜后800 nM PJ34预处理2 h(对照组给与0.1% DMSO),加入100 μ的PCN孵育3 h后,加入18 μg·mL-1碳颗粒继续共孵育2 h,显微镜下观察巨噬细胞吞噬碳颗粒的情况。
1.2.5 统计学分析
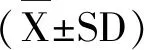
2 结果
2.1 细胞毒性实验
结果如图1A所示,当采用PJ34(0,100,200,400,800,1600 nM)处理RAW264.7细胞24 h,对细胞活力无显著影响。但PCN(25,50,100 μ)显著降低RAW264.7细胞存活率,并呈一定的浓度依赖趋势,如图1B所示。在PCN 100 μM处理24 h的条件下,与空白组相比较,细胞的存活率仅有31%-35%,具有显著性统计学差异(P<0.01)。并且与单用PCN 100 μM组相比较,PJ34预处理组的细胞存活率明显较高(P<0.01)。
2.2 PCN对RAW264.7细胞内ROS和Ca2+水平的影响及PJ34的作用
荧光显微镜观察各组细胞内ROS的水平,结果如图2A所示,PCN未处理时,细胞内ROS水平较低,PCN(100 μM)刺激3 h,PJ34未预处理组与预处理组比较,细胞内ROS水平明显较高。流式细胞术检测结果如图2C,800nM的PJ34预处理可有效缓解PCN刺激引起的细胞内ROS水平升高(P<0.05)。根据文献报道,细胞内的ROS水平与Ca2+水平密切相关,PCN能通过调节细胞线粒体膜的通透性增加细胞内Ca2+水平,从而对细胞产生进一步的氧化应激损伤[7]。激光共聚焦荧光显微镜下观察细胞内Ca2+水平结果如图2B所示,PCN刺激下,细胞内ROS水平的增加伴随着细胞内Ca2+水平的升高,而PJ34可有效抑制PCN引起的细胞内Ca2+水平增加。
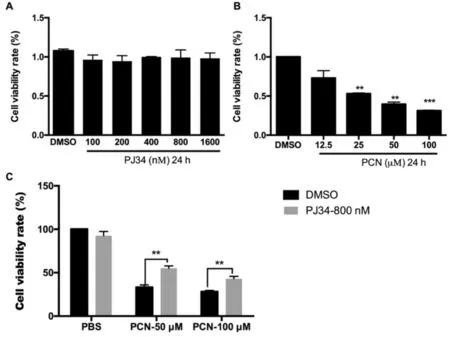
图1 PJ34 和PCN 对RAW264.7细胞活力的影响注:A:不同浓度PJ34对RAW264.7细胞的影响;B:不同浓度PCN对RAW264.7细胞活力的影响;C:PJ34对PCN诱导的巨噬细胞存活率的影响。n=6,与未用PJ34 预处理组比较,*P﹤0.05;**P﹤0.01;***P<0.001。

图2 PJ34对PCN引起的RAW264.7细胞内ROS和Ca2+水平的影响注:A和C:PJ34对RAW264.7细胞内ROS水平的影响;B:PJ34对RAW264.7细胞内Ca2+水平的影响。与单用PCN组比较,*P﹤0.05。
2.3 PJ34缓解PCN引起的巨噬细胞吞噬功能损伤
巨噬细胞是重要的免疫细胞,其主要功能之一是清除吞噬病原体或外来物质。为了研究PCN及PJ34对巨噬细胞吞噬功能的影响,我们采用PBS制备合适浓度的碳粒,经超声处理,得到18 μg·mL-1的碳颗粒混悬液,在各处理组条件下加入18 μg·mL-1碳颗粒混悬液与细胞共孵育,显微镜下观察巨噬细胞吞噬碳粒的情况。如图3A所示,在PCN未处理组,巨噬细胞对碳颗粒的吞噬能力较强,当给与100 μ的PCN处理3 h后,巨噬细胞几乎丧失吞噬碳颗粒的能力,而PJ34预处理则可提高由PCN引起的RAW264.7细胞吞噬功能损伤(P<0.05)。各处理条件下巨噬细胞吞噬碳粒的统计学分析结果如图3B所示。

图3 PCN及PJ34对RAW264.7细胞吞噬功能的影响A:显微镜下观察各处理组细胞吞噬碳粒的能力;B:Image J统计分析各处理组细胞吞噬碳粒的水平。与PCM-100 μm相比,*P<0.05;**P<0.01。n=3。
3 讨论
在现阶段世界范围内广泛爆发的多重耐药铜绿假单胞菌感染以及治疗策略严重缺乏的严峻形势下,研发新的补充治疗策略迫在眉睫。而目前国内外关于PA感染以及PCN感染的研究多集中在肺泡上皮细胞及中性粒细胞,关于PCN对单核巨噬细胞的研究报道较少。同时越来越多的研究表明,广泛分布于免疫细胞表面的TRPM2离子通道在炎症小体的活化,ROS的产生以及肺部炎症和疼痛等过程中发挥着非常重要的作用[8]。这些研究结果强烈提示研究TRPM2离子通道在免疫细胞中的信号传导机制对于多种疾病意义重大。因此在本研究中我们提出假设,TRPM2通道的活化是PCN介导的巨噬细胞损伤的重要机制。
PARP是广泛表达于真核细胞内的DNA修复蛋白,PARP的表达活化是氧化应激引起的细胞内NAD+增高,TRPM2通道开放及TRPM2通道依赖的钙离子转运的必要条件[9]。在PARP-1敲除细胞中,氧化应激刺激不能引起细胞的TRPM2通道开放[10,11]。在本研究中,我们采用PARP抑制剂PJ34预处理细胞,抑制巨噬细胞表面TRPM2通道的开放,观察其对PCN引起的细胞损伤的作用。我们的研究结果显示铜绿假单胞菌分泌的毒力因子绿脓菌素能诱导巨噬细胞RAW264.7细胞内的ROS水平和Ca2+水平升高,并导致巨噬细胞的吞噬功能损伤,最终引起巨噬细胞死亡。而当给与PJ34预处理后,PCN对巨噬细胞的毒性损伤作用得到有效缓解,PCN引起的ROS水平和Ca2+水平增高得到抑制,对巨噬细胞吞噬功能的损伤作用减弱,并提高了PCN刺激下巨噬细胞的存活率。
本研究结果提示细胞膜TRPM2离子通道在免疫细胞抵抗外来应激时发挥的重要作用,可以明确的是本研究通过PARP抑制剂PJ34阻断TRPM2离子通道的活化,抑制由于该离子通道活化引起的细胞内钙离子水平失衡,可以有效缓解PCN感染条件下的巨噬细胞死亡,维持PCN状态下巨噬细胞的吞噬功能,保护巨噬细胞氧化应激损伤,为绿脓菌素感染的治疗提供了新的思路,也为TRPM2离子通道在氧化应激疾病发病中的作用提供有力证据。
