硫对酵母生物富铬过程中铬胁迫的缓解作用
2019-04-03李函彤甲承立张书文芦晶逄晓阳刘鹭吕加平
李函彤,甲承立,张书文,芦晶,逄晓阳,刘鹭,吕加平
(1中国农业科学院农产品加工研究所/农业部农产品加工与质量控制重点开放实验室,北京 100093;2北京市营养源研究所/系统营养工程技术研究中心,北京 100069)
0 引言
【研究意义】作为人体必需的微量元素,Cr(Ⅲ)可以促进机体葡萄糖代谢,降低甘油三酯和游离脂肪酸含量,维持体内糖脂代谢平衡[1]。酵母可以通过生物吸附和转化作用将环境中的无机铬转化为有机铬。这种来源于酵母的有机铬也被称为葡萄糖耐量因子(glucose tolerance factor,GTF)[2-4],它具有吸收率高、安全性高的特点,被认为是最安全的铬补充剂[5]。但作为重金属,Cr(Ⅲ)对酵母的生长有两面性。一方面,低浓度的铬可促进酵母的生长;另一方面,高浓度的铬可对酵母生长造成一定的氧化胁迫作用,抑制酵母的正常生命活动、生长和GTF的生成。因此,研究酿酒酵母在富集 Cr(Ⅲ)形成葡萄糖耐量因子(GTF)过程中自身抗氧化机制以及硫在该过程中发挥的作用,对揭示硫降低铬胁迫,进而提高生物富铬的作用机理具有重要意义。【前人研究进展】环境中的氧化还原剂或重金属等能刺激细胞产生超氧负离子、羟基和过氧化氢等内源性活性氧族物质(reactive oxygen species,ROS)等代谢产物。这些代谢产物在细胞中累积到一定程度,可对DNA、脂质和蛋白质等细胞组分造成一定的损害,进而影响细胞的功能甚至造成细胞死亡[6]。研究发现,高浓度 Cu2+会对酵母造成胁迫作用[7-8],铜是氧化还原反应的活泼因子,参与Fenton反应[9],产生有害的氢氧根离子[10],氢氧根离子可引起细胞膜脂质、蛋白质的氧化以及 DNA和RNA分子的解链,导致细胞的死亡[11]。重金属会对生物造成氧化应激,破坏 DNA结构,抑制酶的功能,破坏蛋白质在细胞增殖、细胞周期、细胞凋亡和变异过程中的作用[12-13]。据报道,Cd(Ⅱ)、As(Ⅲ)和Cr(Ⅵ)可以在酵母中产生ROS,诱导酵母体内氧化应激和脂质过氧化反应从而造成酵母细胞损伤[14-16]。有研究表明,Cr(Ⅲ)容易与酵母中 DNA和其他生物组分形成稳定的胞内配体,特别是与抗坏血酸盐、组氨酸、谷胱甘肽、半胱氨酸等[17]。刘鹭等[18]研究发现,培养液中高浓度Cr(Ⅲ)(800 μg·mL-1)严重抑制菌体生长;而低浓度的 Cr(Ⅲ)(200—400 μg·mL-1)对菌体的生长具有轻微刺激作用,但有机铬富集率较低。高氧化价态的金属在硫的作用下可以转变为低价态[19],硫的补充可以降低Cr(Ⅵ)对于酵母细胞的毒性,促进酵母对废水液中Cr(Ⅵ)的吸收[20]。【本研究切入点】关于 Cr(Ⅲ)对酵母在生成 GTF过程中产生的氧化胁迫作用鲜有报道,而针对缓解铬的氧化胁迫作用、提高酵母富铬含量的研究更少。本研究利用前期转录组学结果对比分析了富铬酵母和对照酵母的差异基因及其代谢通路,发现酵母富铬过程与硫代谢和GSH代谢通路有密切的关系。基于以往文献报道硫吸收和 GSH生物合成相互联系,并在缓解重金属Cr(Ⅵ)对微生物的胁迫时发挥了重要的作用[21],本研究拟在富铬酵母发酵过程中添加不同种类的硫化合物,对比观察富铬酵母的生长,包括富集有机铬、总铬以及体内氧化应激的变化。【拟解决的关键问题】基于转录组学对酵母富铬代谢通路的分析结果,研究不同种类的硫对酵母富铬以及体内氧化应激的影响,揭示硫对Cr(Ⅲ)胁迫下酵母生物富铬调节机制,为酵母生物富集铬生成 GTF的发酵条件优化提供理论依据。
1 材料与方法
1.1 试验材料
试验菌株和对照菌株均为酿酒酵母YSI-3.7,保藏于中国普通微生物菌种保藏管理中心(CGMCC No.2687)。YPD培养基(大豆蛋白胨 20 g,葡萄糖20 g,酵母浸粉10 g,蒸馏水1 L,pH 5.8,121℃,灭菌 15 min)的大豆蛋白胨和酵母浸粉,北京奥博星生物技术公司;葡萄糖、无水亚硫酸钠、硫化钠,国药集团;硝酸、氨水和高氯酸,上海晶纯科技公司;三氯化铬(Ⅲ)六水化合物,上海阿拉丁公司。
1.2 试验设计
以高产GTF的YSI-3.7为出发菌株,研究和分析不同浓度(0、200、500 和 800 μg·mL-1)Cr(Ⅲ)对酵母富集Cr(Ⅲ)情况及氧化应激的影响,寻找酵母培养最适Cr(Ⅲ)浓度;在最适Cr(Ⅲ)浓度条件下(500 μg·mL-1),对比研究不同种类硫化合物(Na2SO3、Na2S、(NH4)2SO3)对缓解 Cr(Ⅲ)胁迫的氧化应激的影响;在最适硫化合物及浓度下(1 mmol·L-1Na2SO3),测定酵母菌体生物量、丙二醛(MDA)、超氧化物歧化酶(SOD)、过氧化物酶(CAT)、还原型谷胱甘肽(GSH)、氧化型谷胱甘肽(GSSG)、谷胱甘肽氧化酶(GSH-PX)、总巯基、总抗氧化能力(T-AOC)等参数,探讨硫对Cr(Ⅲ)胁迫下酵母生物富铬调节机制。
1.3 方法
1.3.1 富铬酵母 YSI-3.7培养 将通过梯度铬平板(200、500、800 和 1 000 μg·mL-1Cr(Ⅲ)筛选出的富铬能力最强、生物量最大的酿酒酵母 YSI-3.7单菌落(有机铬含量 1 033.91 μg·g-1DCW,总铬含量 1 603.87 μg·g-1DCW,生物量 1.041 g/100 mL YPD)接种于YPD培养基中培养至第3代,然后以10%(v/v)接种量分别接种于含有一定铬浓度的YPD培养基中,于恒温培养振荡器中28℃、200 r/min摇瓶培养44 h。于4℃、6 000 r/min离心10 min收集菌体,用无菌水洗涤3次,称其湿重;-60℃冷冻干燥48 h得到冻干菌粉。
1.3.2 有机铬、总铬含量的测定 参考火焰原子吸收法[22]。
1.3.2.1 富铬酵母菌体中有机铬测定 富铬酵母中有机铬可溶于氨水,称取0.1 g冻干酵母菌粉溶于10 mL 0.1 mol·L-1氨水溶液中,于37℃、200 r/min提取3 h。于4℃、5 000 r/min离心10 min,收集上清液于溶样杯中,加入6 mL浓硝酸。将其置于加热板于160℃预加热30 min,再加入0.5 mL高氯酸和5 mL 5%(m/v)的过硫酸铵,进行微波消解,参数如表 1所示。消解完全后用10% NH4Cl溶液定容至25 mL,参照GB/T15555.6—1995火焰原子吸收光谱法测定消化液中铬含量,即为富铬酵母菌体中有机铬的含量。
1.3.2.2 富铬酵母菌体总铬测定 直接称取0.1 g冻干菌粉于溶样杯中,加入6 mL浓硝酸。将其置于加热板于160℃预加热30 min,再加入0.5 mL高氯酸和5 mL 5%(m/v)的过硫酸铵,进行微波消解,微波消解参数设置如表1所示。消解完全后用10% NH4Cl溶液定容至25 mL,参照GB/T15555.6—1995火焰原子吸收光谱法测定消化液中铬含量,即为富铬酵母菌体的总铬含量。
1.3.3 相关生理指标的测定
1.3.3.1 丙二醛(MDA)含量 取菌体破壁、离心后的上清液,按照丙二醛(MDA)测试盒说明书步骤进行。
1.3.3.2 超氧化物歧化酶(SOD)活力 取菌体破壁、离心后的上清液,按照超氧化物歧化酶(SOD)测定试剂盒说明书步骤进行。
1.3.3.3 过氧化氢酶(CAT) 取菌体破壁、离心后的上清液,按照过氧化氢酶(CAT)测定试剂盒说明书步骤进行。
1.3.3.4 谷胱甘肽(GSH,GSSG) 取菌体破壁、离心后的上清液,按照GSH和GSSG检测试剂盒说明书步骤进行。
1.3.3.5 总抗氧化能力(T-AOC) 取菌体破壁、离心后的上清液,按照 T-AOC检测试剂盒说明书步骤进行。
1.3.3.6 总巯基 取菌体破壁、离心后的上清液,按照巯基检测试剂盒说明书步骤进行。
1.3.3.7 谷胱甘肽过氧化物酶(GSH-Px) 取菌体破壁、离心后的上清液,按照谷胱甘肽检测试剂盒说明书步骤进行。
1.4 数据分析
应用SPSS16.0对所有数据进行统计分析和绘图。
2 结果
2.1 Cr(Ⅲ)胁迫对酵母YSI-3.7生物富铬及氧化应激影响
2.1.1 生物量及富铬情况 随着培养液中 Cr(Ⅲ)浓度的升高,YSI-3.7菌体富集铬的总量升高(包括有机铬和总铬),生物量下降。与对照组(Cr(Ⅲ)浓度为 0)酵母相比,200、500 和 800 μg·mL-1Cr(Ⅲ)浓度下酵母生物量分别降低 24.29%、30.71%和67.86%。在500 μg·mL-1Cr(Ⅲ)浓度下,酵母中的有机铬含量达到725.55 μg·g-1DCW,有机铬率最高,达到57.79%;酵母于800 μg·mL-1Cr(Ⅲ)浓度下虽然吸附的总铬高至1 812.22 μg·mL-1,但生物量降低较为严重,并且有机铬率仅为29.59%(表1)。综合考虑菌体生物量以及富集铬的情况,Cr(Ⅲ)浓度为500 μg·mL-1为酵母发酵富铬最佳浓度。

表1 Cr(Ⅲ)对酵母YSI-3.7生物量及生物富铬的影响Table 1 Effect of Cr (Ⅲ) on YSI-3.7 growth and its chromium enrichment
2.1.2 Cr(Ⅲ)胁迫对酵母 YSI-3.7氧化应激影响通过研究Cr(Ⅲ)胁迫对酵母YSI-3.7各氧化应激指标的影响可知(表2),酵母细胞中丙二醛(MDA)的含量随着培养基中 Cr(Ⅲ)浓度的增加而增加。MDA的量可以反映酵母细胞内脂质过氧化的程度,间接地反映出细胞损伤的程度。200、500和 800 μg·mL-1铬浓度下,丙二醛含量分别比对照组增加31.36%、42.94%和52.49%。
随着Cr(Ⅲ)浓度升高,YSI-3.7中SOD活力略有下降,在 200、500 和 800 μg·mL-1Cr(Ⅲ)浓度下,分别比对照组下降3.83%、7.90%和14.63%。在对照酵母中,CAT的活力可达到 9.09 U·mg-1prot,随着Cr(Ⅲ)浓度升高,CAT活力有所下降,在200、500和800 μg·mL-1Cr(Ⅲ)浓度下,分别比对照组下降13.86%、48.07%和59.96%。
在对照酵母中,还原型谷胱甘肽(GSH)含量随着Cr(Ⅲ)浓度升高,呈现先增加后减少趋势,GSH含量于 500 μg·mL-1Cr(Ⅲ) 浓度下达到最高 48.52 μmol·g-1prot。在 200、500 和 800 μg·mL-1Cr(Ⅲ) 浓度下,分别比对照组增加28.01%、54.42%和39.53%。与GSH变化趋势不同,氧化型谷胱甘肽(GSSG)含量随着Cr(Ⅲ)浓度的升高而升高,在Cr(Ⅲ)浓度为800 μg·mL-1时含量达到最高,为15.46 μmol·g-1prot,比对照组增加96.69%。在Cr(Ⅲ)浓度为200、500 μg·mL-1时,GSSG 的含量也高于对照组,分别增加21.63%和57.51%。GSH/GSSG通常用来表示生物体的抗氧化能力。GSH/GSSG的比值在对照组中为4,在Cr(Ⅲ)浓度为200、500和800 μg·mL-1时分别为4.21、3.92和2.84。
Cr(Ⅲ)添加浓度为 200 和 500 μg·mL-1时,培养基中巯基含量分别比对照组提高 38.77%和 53.34%。在800 μg·mL-1Cr(Ⅲ)浓度下,巯基含量相对于对照组酵母降低约 7.19%。酵母细胞中总抗氧化能力(T-AOC)于 0—500 μg·mL-1Cr(Ⅲ)浓度下持续升高。当Cr(Ⅲ)浓度继续升高至 800 μg·mL-1时,T-AOC比对照降低56.25%。培养基中Cr(Ⅲ)浓度从0升高到500 μg·mL-1时,酵母细胞中T-AOC持续升高,说明在此浓度范围内,Cr(Ⅲ)胁迫使酵母细胞的抗氧化能力提高,而当Cr(Ⅲ)浓度升高至800 μg·mL-1时,酵母细胞的抗氧化能力降低,并且远低于对照组。说明高Cr(Ⅲ)对酵母造成了很大的破坏作用,酵母自身的抗氧化能力已经不足以应对此浓度下Cr(Ⅲ)的氧化胁迫。
2.2 不同硫化合物对铬胁迫下酵母 YSI-3.7生物量及生物富铬的影响
由表3可以看出,培养基中添加不同硫酸盐培养的酵母细胞生物量(干重)几乎均随着其浓度的增加而减少。其中有机铬含量随着培养基中添加Na2SO3、Na2S、(NH4)2SO3浓度的升高先增加后减少,并分别在浓度5、1和1 mmol·L-1时达到最大值。对于培养基中添加 Na2SO3和(NH4)2SO3的酵母而言,酵母中总铬含量随着亚硫酸盐添加浓度的升高先增加后减少,分别在5、15 mmol·L-1时达到最大值。而对于添加Na2S的酵母,其总铬的含量在0.5—15 mmol·L-1浓度持续增加。对于培养基中添加 Na2SO3、Na2S的酵母,其有机铬率均先上升后下降,且均在浓度为1 mmol·L-1时达到最大值,分别为对照的85.65%和67.75%。而对于添加(NH4)2SO3后发酵的酵母,其有机铬率随着其浓度升高而下降。结合细胞干重、有机铬、总铬、有机铬率等指标,当在培养基中添加
1 mmol·L-1Na2SO3时,对于酵母富集Cr(Ⅲ)形成有机铬最有利。此时,酵母细胞生物量为只添加 500 μg·mL-1Cr(Ⅲ)的84.83%,总铬含量提高31.03%,有机铬率提高32.88%。综上,选择1 mmol·L-1Na2SO3进行后续研究。

表2 Cr(Ⅲ) 对酵母细胞氧化应激的影响Table 2 Effect of Cr (Ⅲ) on YSI-3.7 oxidative stress
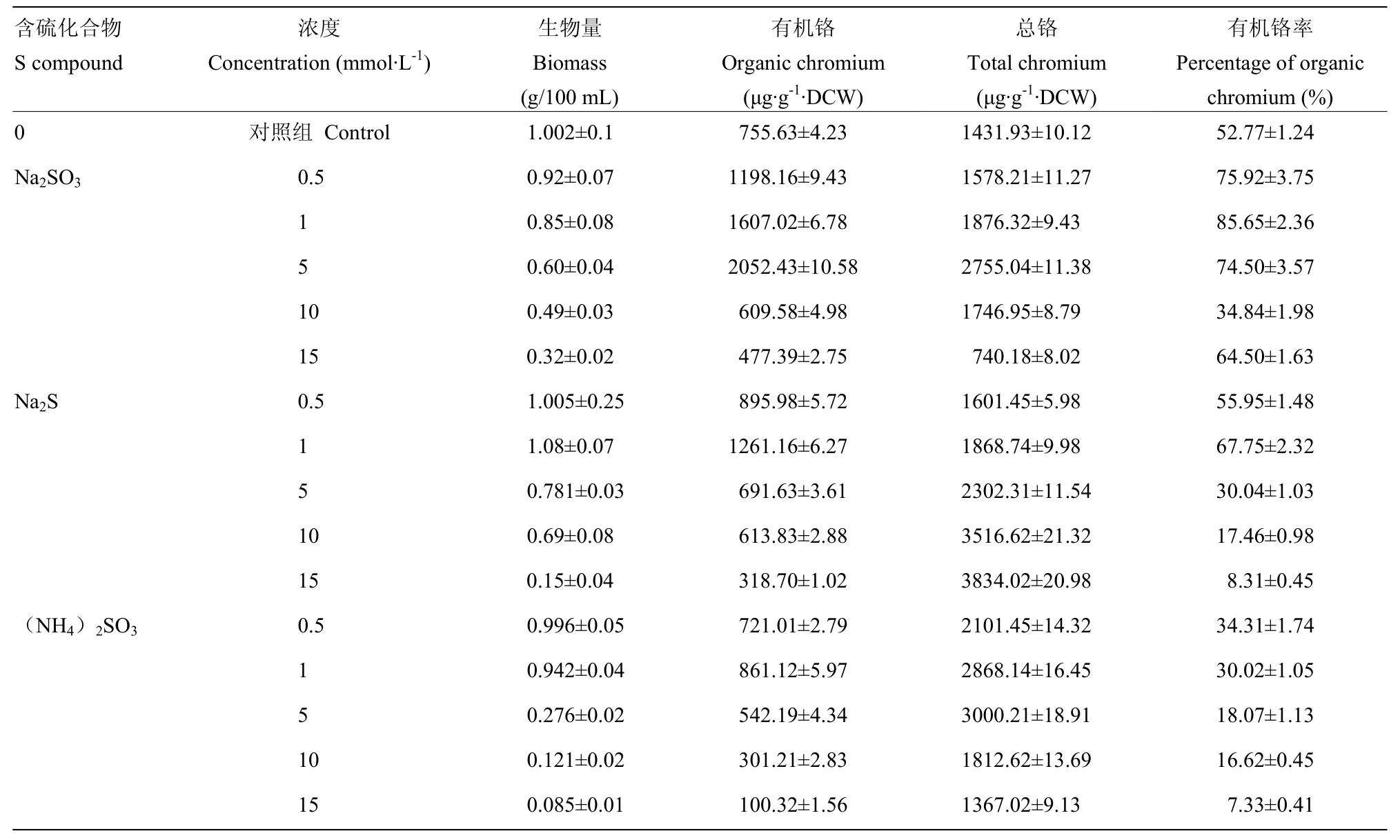
表3 硫化合物对酿酒酵母YSI-3.7生物量及生物富铬的影响Table 3 Effect of various S compounds on YSI-3.7 biomass and its chromium enrichment
2.3 Na2SO3对酵母YSI-3.7富铬及铬胁迫下氧化应激的影响
2.3.1 对应激代谢产物的影响 氧自由基能攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化作用,形成脂质过氧化物,如丙二醛。MDA的量可以反映酵母细胞内脂质过氧化的程度,间接地反映出细胞损伤的程度。如图1-A所示,500 μg·mL-1Cr(Ⅲ)处理的酵母体内MDA含量为16.91 nmol·mL-1,相比于空白组,提高了24.60%;1 mmol·L-1Na2SO3可有效降低因Cr(Ⅲ)引起的 MDA 含量,相比于500 μg·mL-1Cr(Ⅲ)处理组,MDA含量降低了12.8%。
如图1-B所示,500 μg·mL-1Cr(Ⅲ)处理的酵母体内巯基含量为 59.05 μg·g-1prot;1 mmol·L-1Na2SO3可促进富铬酵母体内巯基含量的增加,达到 65.51 μg·g-1prot;相比于 500 μg·mL-1Cr(Ⅲ)处理组,巯基含量提高了16.87%。
如图1-C所示,500 μg·mL-1Cr(Ⅲ)处理的酵母细胞内还原型谷胱甘肽(GSH)含量为 48.52 μmol·g-1prot,相比于对照酵母组增加了54.42%。1 mmol·L-1Na2SO3可促进富铬酵母体内GSH 增加至62.51 μmol·g-1prot。相比于空白组和500 μg·mL-1Cr(Ⅲ)处理组分别提高98.95%和28.83%。
如图 1-D 所示,500 μg·mL-1Cr(Ⅲ)处理的酵母体内氧化型谷胱甘肽(GSSG)含量为 12.38 μmol·g-1prot,相比于空白酵母组增加 57.71%。1 mmol·L-1Na2SO3可促进富铬酵母体内 GSSG 降低至7.85 μmol·g-1prot。相较于 500 μg·mL-1Cr(Ⅲ)处理组,GSSG降低了57.71%,与空白组酵母体内GSSG含量近似。
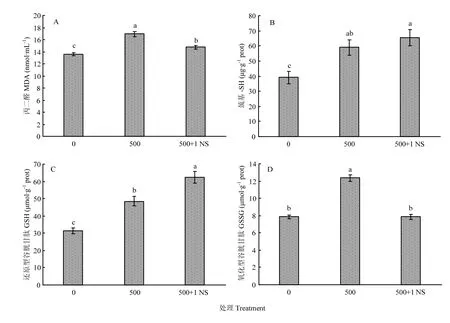
图1 Na2SO3对铬胁迫下酵母氧化应激代谢产物的影响Fig. 1 Effects of Na2SO3 on reactive oxygen species related intermediate metabolites by YSI-3.7
2.3.2 对酵母抗氧化能力的影响 金属离子的氧化胁迫会激活微生物机体自身抗氧化保护酶系统,消除自由基,维持体内自由基动态平衡[23]。如图2-A 所示,500 μg·mL-1Cr(Ⅲ)处理的酵母体内SOD含量为7.93 U·mg-1prot,相比于空白酵母组降低7.9%。1 mmol·L-1Na2SO3可促进富铬酵母体内SOD 增加至 8.28 U·mg-1prot,比 500 μg·mL-1Cr(Ⅲ)单独处理组提高4.41%。空白对照组中酵母的 CAT的活力达到 9.09 U·mg-1·prot;其他两组处理相比,酵母细胞中 CAT活力无显著变化(图2-B),表明硫的添加对SOD、CAT的活力提高不明显。
总抗氧化能力(T-AOC)是衡量机体抗氧化酶系统和非酶促系统功能状况的综合性指标。它的大小可代表和反映机体抗氧化酶系统和非酶系统对外来刺激的代偿能力以及机体自由基代谢的状态。由图2-C所示,在Cr(Ⅲ)胁迫下,酵母的总抗氧化能力有所提升,酵母发挥自身调节作用以对抗外界氧化胁迫作用;500 μg·mL-1Cr(Ⅲ)处理的酵母体内T-AOC含量为1.61 U·g-1prot,相比于空白酵母组提高 101.25%。1 mmol·L-1Na2SO3可促进富铬酵母体内T-AOC增加至1.84 U·g-1prot,分别比空白酵母和500 μg·mL-1Cr(Ⅲ)处理组中T-AOC含量提高130%和14.29%。表明硫的添加可以提高酵母的总抗氧化能力。
谷胱甘肽过氧化物酶(GSH-Px)可以促进过氧化氢(H2O2)与还原型谷胱甘肽反应生成 H2O和氧化型谷胱甘肽(GSSG)。由图2-D可知,500 μg·mL-1Cr(Ⅲ)处理的酵母体内GSH-Px含量为763.94 U·mg-1prot,相比于空白酵母组降低 26.86%。1 mmol·L-1Na2SO3可使富铬酵母体内 GSH-Px增加至907.53 U·mg-1prot,比 500 μg·mL-1Cr(Ⅲ)处理组提高18.80%。以上结果表明,硫的添加可以提高谷胱甘肽过氧化物酶的活力,促进氧化氢(H2O2)与还原型谷胱甘肽反应,促进过氧化氢的分解。

图2 Na2SO3对酵母抗氧化能力的影响Fig. 2 Effect of Na2SO3 on YSI-3.7 antioxidant capacity
3 讨论
动物、植物细胞在代谢过程中不断产生自由基,这些自由基会被细胞本身具有的防御体系所清除,在正常生理条件下,二者之间始终处于动态平衡。一旦平衡被打破,机体组织内的活性氧自由基不断聚积,使组织代谢功能出现异常并发生组织过氧化现象,从而引发一系列病理及生理变化[24]。过量的重金属会诱导活性氧基团(ROS)的产生,如超氧离子(O2-)、羟基(-OH)、过氧化氢(H2O2)等活跃的微粒。这些微粒能与大量细胞成分反应,氧化核酸、蛋白质、糖类和脂肪等大分子,引起细胞内氧化应激反应导致细胞死亡[25]。铬和其他金属一样,会显著诱导活性氧的产生,可以直接或者间接地对生物体中核酸、叶绿体结构和细胞膜造成破坏[26]。PEREIAR等[27]在研究氧化胁迫与酵母抗逆性的关系时也发现,在高温、饥饿、金属离子等逆境因子存在时可诱使酵母细胞产生活性氧ROS。ROS的清除主要包括非酶促和酶促两种机制。其中,非酶促清除机制主要依赖于抗坏血酸、谷胱甘肽、类黄酮和生物碱等还原性物质[28];而酶促清除机制则依赖于超氧化物歧化酶、过氧化氢酶、过氧化物酶、抗坏血酸过氧化物酶和谷胱甘肽过氧化物酶等[29]。KEUNEN 等[30]认为,铬(Ⅵ)主要通过硫转运体进入细胞,并且竞争性地抑制硫的摄取,导致硫饥饿,从而引起硫摄取量的减少。在这两者竞争下,硫的补充可以解除铬的毒性,使酵母生长状态变好,蛋白含量增加。GSH等含半胱氨酸残基的巯基化合物,具有抗氧化、提高机体免疫、重金属解毒,维持生物细胞特定的氧化还原氛围等多种生物学功能,是生物细胞内重要的活性物质。硫在蛋白质中的保存增加了GSH的合成。硫通路的激活,不仅可以控制GSH的合成,而且保存蛋白中的硫,为GSH的合成提供S原子。
3.1 Na2SO3对酵母膜脂质过氧化程度的影响
六价铬胁迫可能会导致脂质的过氧化以及细胞膜损伤,产生氧化应激损伤[31-32]。在胁迫下,植物组织和器官膜脂质过氧化的主要产物是丙二醛,细胞膜发生过氧化后细胞内电解质大量渗透。植物体内 MDA的含量和细胞膜透性可以一定程度上反应植物受胁迫损伤的程度,也能反映细胞膜所受伤害程度的高低[33-34]。Cd2+胁迫可以使美人蕉 MDA 含量升高[35],SHAH等[36]在Cd2+处理的两种水稻品种中均检测到了 MDA的积累。杜君等报道,铜胁迫可以使酿酒酵母膜脂过氧化程度加剧且细胞内丙二醛含量随着铜处理浓度的增加而增加[37]。Al3+作用可以造成烟草细胞的膜脂过氧化[38],对酵母的毒性很大程度上也是膜脂过氧化造成细胞膜完整性和流动性消失引起的[39]。本研究发现,酵母富铬过程中,随着 Cr(Ⅲ) 浓度的升高,酵母中 MDA含量上升,说明酵母细胞膜质过氧化的程度升高,细胞膜所受伤害程度不断加深。适当浓度的 Na2SO3可以使酵母细胞中MDA含量降低,缓解细胞膜脂质过氧化的程度。有报道指出,H2S可以增强抗氧化酶活性,参与调节盐胁迫下植物活性氧代谢,显著降低O2-、H2O2和MDA含量,缓解盐胁迫引起的氧化损伤[40-42]。
3.2 Na2SO3对酵母生物富铬过程中抗氧化能力的影响
超氧化物歧化酶(SOD)是细胞中最重要的清除自由基的酶之一,以为基质进行歧化反应,将毒性较强的转化为毒性次级的H2O2和基态氧,避免毒性更大的·OH的生成。研究表明,Cd2+使美人蕉根部 SOD活性明显增加,Cu2+对其活性无明显影响[35]。酿酒酵母细胞内超氧化物歧化酶活性在不同浓度铜胁迫下有不同程度的升高[37]。本研究中添加 Na2SO3后酵母中 SOD活力比只添加 500 μg·mL-1Cr(Ⅲ)略有上升,说明Na2SO3可以通过提高酵母 SOD活力抵抗铬胁迫。本研究还发现,Cr(Ⅲ)可降低酵母体内 CAT含量,使酵母体内过氧化氢分解能力减弱,外源添加 Na2SO3对 CAT酶系没有影响。杜君等[37]发现,酿酒酵母细胞内氧化氢酶的活性在不同浓度铜胁迫下有不同程度的升高。三价铬和铜对酵母过氧化氢酶影响不同,可能与酵母对不同种的金属的抗氧化能力和途径有所不同有关。
GSH是含半胱氨酸残基的巯基化合物,具有抗氧化、提高机体免疫、重金属解毒,维持生物细胞特定的氧化还原氛围等多种生物学功能,是生物细胞内重要的活性物质[31]。生物体对重金属的抗逆性、解毒及积累作用与生物细胞内含有丰富的GSH和金属硫蛋白等疏基化合物有关[42-45]。Fe3+、Cu2+、Cr(Ⅲ)这些变价离子在胁迫细胞时,与酵母细胞中的巯基化合物中巯基发生直接的配位作用[46]。有研究表明,镉处理诱导了水稻根系产生大量的包括还原型谷胱甘肽在内的含巯基物质。谷胱甘肽几乎是所有活细胞中抗氧化剂中最丰富的物质。铬对酵母细胞既然存在氧化胁迫,那么,酵母细胞内必然也存在相应的反应机制来对抗或消除氧化毒性。研究结果说明低浓度的Cr(Ⅲ)可以刺激酵母产生GSH,抵抗氧化毒性。GSH被称为生物体中抵抗重金属压力的缓解剂[47]。GSH在缓解氧化毒性中具有多种功能,如:动物呼吸作用产生的 H2O2由线粒体中的谷胱甘肽过氧化物酶(GPx)消除,而 GSH就是该酶的电子供体;在植物中,GSH也是活性氧自由基防御反应中的关键因子,并作为一种植物螯合肽底物,可以帮助植物应对金属毒性[48-50],如抵抗氧化剂对巯基(-SH)的破坏,与α-生育酚协调清除细胞中积累的氧自由基。GSH还被发现在酿酒酵母的热激、H2O2、Hg、Cu等引起的氧化胁迫中起到关键作用[51-54]。谷胱甘肽在体内以还原型(GSH)和氧化型(GSSG)两种形式存在,正常时主要以还原型为主,具有清除自由基的能力,可在谷胱甘肽过氧化酶(GPx)的催化下与过氧化物、自由基等反应,形成氧化态的 GSSG,GSSG又可在还原型辅酶Ⅱ(NADPH)和 GSH 还原酶(GSR)的作用下还原成GSH,形成一个循环,这个过程被认为是谷胱甘肽最重要的抗氧化机制。此外,一些报道发现,GSH还具有其他抗性功能。有报道认为,GSH可以保护一些同样含巯基的蛋白质及酶免受氧化,也可以作为一些酶的辅助因子或者具有调节相关氨基酸的运输等功能[55]。还有人发现,GSH可以直接与 Cd等金属螯合形成复合物储存到液泡中[13],在植物中,GSH还是植物螯合肽的合成底物[7]。GSH/GSSG是氧化压力的生物标志[56]。随着Cr(Ⅲ)浓度不断升高(0—800 μg·mL-1),GSH/GSSG 分别为 4、4.2、3.9和 2.8,呈先升高后下降的趋势,说明酵母对低浓度的Cr(Ⅲ)自身抗氧化能力较强,对高浓度的铬抵抗力变弱。
总抗氧化能力(T-AOC)是衡量机体抗氧化酶系统和非酶促系统功能状况的综合性指标。它的大小可代表和反映机体抗氧化酶系统和非酶系统对外来刺激的代偿能力以及机体自由基代谢的状态[57]。在低 Cr(Ⅲ)浓度下(≤500 μg·mL-1),机体自身氧化应激调整,酵母细胞中总抗氧化能力升高;而高浓度Cr(Ⅲ)胁迫下,总抗氧化能力远低于对照组,酵母细胞的抗氧化能力降低,说明高Cr(Ⅲ)对酵母造成了很大的破坏作用,酵母自身氧化应激的调整无法应对此浓度下Cr(Ⅲ)的氧化胁迫。适当浓度的 Na2SO3使酵母细胞 T-AOC进一步升高,表明Na2SO3可以通过提高酵母总抗氧化能力防御Cr(Ⅲ)带来的氧化作用。
4 结论
酵母在富集Cr(Ⅲ)形成GTF过程中,会受到Cr(Ⅲ)的氧化胁迫作用。较低浓度 Cr(Ⅲ)会刺激酵母细胞生长,而较高浓度的 Cr(Ⅲ)则会抑制其生长。酵母细胞的膜脂过氧化程度随 Cr(Ⅲ)浓度的升高而加重。在较低浓度 Cr(Ⅲ)作用下,酵母自身可通过增加 T-AOC、GSH、巯基含量以及GSH-Px活力以防御 Cr(Ⅲ)的氧化胁迫。但在高Cr(Ⅲ)浓度下,有些未得到及时清除的自由基对细胞产生不可逆的伤害,使细胞膜脂过氧化程度大大加重,酵母自身无法抵抗其氧化胁迫作用。适当浓度Na2SO3可以通过增加酵母中-SH、GSH、T-AOC含量,提高GSH-Px酶活力,降低膜脂过氧化程度,从而帮助酵母细胞抵御一定浓度的 Cr(Ⅲ)氧化胁迫作用,进而提高有机铬生成率。
[1] 徐晨晨. 微量元素铬对营养代谢调控的研究进展. 家禽科学,2012(1): 12-15.XU C C. Research progress on the regulation of nutrient metabolism by trace element chromium.Poultry Science, 2012(1): 12-15. (in Chinese)
[2] YEH G Y, EISENBERG D M, KAPTCHUK T J, PHILLIPS R. S.Systematic review of herbs and dietary supplements for glycemic control in diabetes.Diabetes Care, 2003, 26(4): 1277-1294.
[3] HATFIELD M J, GILLESPIE S, CHEN Y, LI Z, CASSADY C J,VINCENT J B. Low-molecular-weight chromium-binding substance from chicken liver and American alligator liver.Comparative Biochemistry & Physiology, Part B, Biochemistry & Molecular Biology2006, 144(4): 423-431.
[4] CHEN Y, WATSON H M, GAO J, SINHA S H, CASSADY C J,VINCENT J. B. Characterization of the organic component of low-molecular-weight chromium-binding substance and its binding of chromium.Journal of Nutrition, 2011, 141(7): 1225-1232.
[5] BERNER T O, MURPHY M M, SLESINSKI R. Determining the safety of chromium tripicolinate for addition to foods as a nutrient supplement.Food & Chemical Toxicology, 2004, 42(6): 1029.
[6] MOLIN M, RENAULT J P, LAGNIEL G, PIN S , TOLEDANO M ,LABARRE J. Ionizing radiation induces a Yap1-dependent peroxide stress response in yeast.Free Radical Biology & Medicine, 2007, 43:136-144.
[7] LI H, GUO A, WANG H. Mechanisms of oxidative browning of wine.Food Chemistry, 2008, 108(1): 1-13.
[8] FERREIRA J, DU TOIT M, DU TOIT W J. The effects of copper and high sugar concentrations on growth, fermentation efficiency and volatile acidity production of different commercial wine yeast strains.Australian Journal of Grape & Wine Research, 2006, 12(1): 50-56.
[9] 廖芸, 曾英杰, 许笑男, 钟秋平, 赵久香. 铜离子对荔枝酒降酸酵母发酵性能及醋酸代谢的影响. 食品科技, 2014(10): 43-47.LIAO Y, ZENG Y J, XU X N, ZHONG Q P, ZHAO J X. Effect of copper ion on the fermentation performance and acetic acid metabolism of lychee wine yeast.Food Science and Technology,2014(10): 43-47. (in Chinese)
[10] PANDA S K. Impact of copper on reactive oxygen species, lipid peroxidation and antioxidants inLemna minor.Biologia Plantarum,2008, 52(3): 561-564.
[11] GAETKE L M, CHOW C K. Copper toxicity, oxidative stress, and antioxidant nutrients.Toxicology, 2003, 189(1/2): 147.
[12] LIN C C, KAO C H. Effect of NaCl stress on H2O2metabolism in rice leaves.Plant Growth Regulation, 2000, 30(2): 151-155.
[13] BRENNAN R J, SCHIESTL R H. Cadmium is an inducer of oxidative stress in yeast.Mutation Research,1996, 356(2): 171-178.
[14] MENEZES R A, AMARAL C, BATISTA-NASCIMMENTO L,SANTOS C, RODRIGUES-POUSADA C. Contribution of Yap1 towardsSaccharomyces cerevisiaeadaptation to arsenic-mediated oxidative stress.Biochemical Journal, 2008, 414(2): 301-311.
[15] BEYERSMANN D, HARTWIG A. Carcinogenic metal compounds:recent insight into molecular and cellular mechanisms.Archives of Toxicology, 2008, 82(8): 493-512.
[16] HARRIS G K, SHI X L. Signaling by carcinogenic metals and metal-induced reactive oxygen species.Mutation Research,2003,533(1): 183-200.
[17] BEYERSMANN D, HARTWIG A. Carcinogenic metal compounds:recent insight into molecular and cellular mechanisms.Archives of Toxicology, 2008, 82(8): 493-512.
[18] 刘鹭, 吕加平, 高艳红. 空间搭载高产葡萄糖耐量因子(GTF)酵母的选育. 微生物学通报, 2009, 36(2): 223-230.LIU L, LÜ J P, GAO Y H. Breeding of high yield glucose tolerance factor (GTF) yeast in space.Microbiology, 2009, 36(2): 223-230. (in Chinese)
[19] ALEXANDER J, AASETH J. Uptake of chromate in human red-blood-cells and isolated rat-liver cells - the role of the anion carrier.Analyst, 1995, 120(3): 931-933.
[20] SUMMERS A O. Damage control: Regulating defenses against toxic metals and metalloids.Current Opinion Microbiology, 2009, 12(2):138.
[21] SALNIKOW K, ZHIKOVICH A. Genetic and epigenetic mechanisms in metal carcinogenesis and cocarcinogenesis: Nickel, arsenic and chromium.Chemical Research Toxicology, 2008, 21(1): 28-24.
[22] PEREIRA Y, LAGNIEL G, GODAT E, BAUDOUIN-CORNU P,JUNOT C, LABARRE J. Chromate causes sulfur starvation in yeast.Toxicological Sciences, 2008, 106(2): 400-412.
[23] 冯建永, 庞民好, 张金林, 刘颖超. 复杂盐碱对黄顶菊种子萌发和幼苗生长的影响及机理初探. 草业学报, 2010, 19(5): 77-86.FENG J Y, PANG M H, ZHANG J L, LIU Y C. Study on complex effects on saline flaveriabidentis seed germination and seedling growth and its mechanism.Acta prataculturae sinica, 2010, 19(5):77-86. (in Chinese)
[24] 高春生, 王春秀, 张书松. 水体铜对黄河鲤肝胰脏抗氧化酶活性和总抗氧化能力的影响. 农业环境科学学报, 2008, 27(3): 1157-1162.GAO C S, WANG C X, ZHANG S S. Effect of water copper on antioxidant enzyme activity and total antioxidant capacity of hepatopancreas in the Yellow River carp.Journal of Agricultural Environmental Science, 2008, 27(3): 1157-1162. (in Chinese)
[25] GADJEV I, STONE J M, GECHEV T S. Programmed cell death in plants: new insights into redox regulation and the role of hydrogen peroxide.International Review of Cell & Molecular Biology, 2008,270: 87-144.
[26] TIWARI K, DWIVEDI K, SINGH S. Chromium (VI) induced phytotoxicity and oxidative stress in pea (Pisum sativumL.):Biochemical changes and translocation of essential nutrients.Journal of Environmental Biology, 2009, 30(3): 389.
[27] PEREIRA M D, HERDERIRO R S, FERNANDES P N,ELEUTHERIO E C A, PANEK A D. Targets of oxidative stress in yeastsodmutants.Biochinica et Biophysica Acta, 2003, 1620(1-3):245-251.
[28] APEL K, HIRTIRT H. Reactive oxygen species: Metabolism,oxidative stress and signal transduction.Annual Review of Plant Biology, 2004, 55: 373-399.
[29] MITTLER R, VANDERAUWERA S, GOLLERY M, BREUSEGEM F V. Reactive oxygen gene network of plants.Trends in Plant Science,2004, 9(10): 490-498.
[30] KEUNEN E, REMANS T, BOHLER S, VANGRONSVELD J,CUYPERS A. Metal-induced oxidative stress and plant mitochondria.International Journal of Molecular Sciences,2011, 12(10): 6894-6918.
[31] MANGABEIRA P A, FERREIRA A S, DE ALMEIDA A A F,FERNANDES V F, LUCENA E, SOUZA V L, DOS SANTOS JÚNIOR A J, OLIVEIRA A H, GRENIER-LOUSTALOT M F,BARBIER F, SILVA D C. Compartmentalization and ultrastructural alterations induced by chromium in aquatic macrophytes.Biometals,2011, 24(6):1017-1026.
[32] DAUD M K, MEI L, VARIATH M T, ALI S, LI C, RAFIQ M T, ZHU S J. Chromium (VI) uptake and tolerance potential in cotton cultivars:Effect on their root physiology, ultramorphology, and oxidative metabolism.Biomed Research International, 2014, 2014(2): 975946.
[33] 赵风斌, 王丽卿, 季高华, 李为星. 盐胁迫对 3种沉水植物生物学指标及叶片中丙二醛含量的影响. 环境污染与防治, 2012, 34(10):40-44.ZHAO F B, WANG L Q, JI G H, LI W X. Effects of salt stress on the biological indexes of 3 submerged plants and the content of malondialdehyde in leaves.Environmental Pollution and Prevention,2012, 34(10): 40-44. (in Chinese)
[34] 孟衡玲, 张薇, 卢丙越, 何芳芳, 鲁海菊. 金银花幼苗对盐胁迫的生理响应. 江苏农业科学, 2015, 43(4): 247-249.MENG H L, ZHANG W, LU B Y, HE F F, LU H J.Physiological response ofLonicera japonicaseedlings to salt stress.Jiangsu Agricultural Sciences, 2015, 43(4): 247-249. (in Chinese)
[35] 吴灵琼, 成水平, 杨立华, 吴振斌. Cd2+和 Cu2+对美人蕉的氧化胁迫及抗性机理研究. 农业环境科学学报, 2007, 26(4): 1365-1369.WU L Q, CHENG S P, YANG L H, WU Z B.Effects of Cd2+and Cu2+on oxidative stress and resistance mechanism ofCanna indica.Journal of Agricultural Environmental Science, 2007, 26(4):1365-1369. (in Chinese)
[36] SHAH K, KUMAR R G, VERMA S, DUBEY R S. Effects of cadmium on lipid peroxidation, superoxide anion generation and activities of antioxidant enzymes in growing rice seedlings.Plant Science, 2001, 161(6): 1135-1144.
[37] 杜君, 李海兰, 李慧, 战吉宬, 黄卫东. 铜对葡萄酒酿酒酵母的氧化胁迫机制. 中国农业科学, 2011, 44(2): 369-378.DU J, LI H L, LI H, ZHAN J C, HUANG W D.Oxidative stress of wine yeasts under copper exposure.Scientia Agricultura Sinica, 2011,44(2): 369-378. (in Chinese)
[38] DEVI S R, YAMMAOTO Y, MASTUMOTO H. An intracellular mechanism of aluminum tolerance associaced antioxidant status in cultured tobacco cells.Journal of Inorganic Biochemistry, 2003, 97(1):59-68.
[39] 金承涛. Al3+、高温对酿酒酵母的胁迫作用及其耐性机制的研究[D].杭州: 浙江大学, 2005.JIN C T. The effect of Al3+, high temperature stress onSaccharomycescerevisiaeand its tolerance mechanism research [D]. Hangzhou:Zhejiang University, 2005.
[40] LI J S, JIA H L, WANG J, CAO Q H, WEN Z C. Hydrogen sulfide is involved in maintaining ion homeostasis via regulating plasma membrane Na+/H+antiporter system in the hydrogen peroxide-dependent manner in saltstressArabidopsis thalianaroot.Protoplasma, 2014,251(4): 899-912.
[41] CHRISTOU A, MANGANARIS G A, PAPADOPOULOS I,FOTOPOULOS V. Hydrogen sulfide induces systemic tolerance to salinity and non-ionic osmotic stress in strawberry plants through modification of reactive species biosynthesis and transcriptional regulation of multiole defence pathways.Journal of Experimental Botany, 2013, 64: 1953-1966.
[42] SHI H T, YE T T, CHAN Z L. Exogenous application of hydrogen sulfide donor sodium hydrosulfide enhanced multiple abiotic stress tolerance in bermudagrass.Plant Physiology & Biochemistry, 2013,71(2): 226-234.
[43] 安志装, 王校常, 严蔚东, 施卫明, 曹志洪. 植物螯合肽及其在重金属胁迫下的适应机制. 植物生理学报, 2001, 37(5): 463-467.AN Z Z, WANG X C, YAN W D, SHI W M, CAO Z H.Phytochelatins and its adaptive mechanism under heavy metal stress.Plant Physiology Communications,2001, 37(5): 463-467. (in Chinese)
[44] 李文学, 陈同斌. 超富集植物吸收富集重金属的生理和分子生物学机制. 应用生态学报, 2003, 14(4): 627-631.LI W X, CHEN T B. Physiobgical and molecular biological mechanisms of heavy metal absorption and accumulation in hyperaccumulators.Chinese Journal of Applied Ecology, 2003, 14(4):627-631. (in Chinese)
[45] 郞飞波, 张国平. 植物螯合肽及其在重金属耐性中的作用. 应用生态学报, 2003, 14(4): 632-636.LANG F B, ZHANG G P. Phytochelatin and its function in heavy metal tolerance of higher plants.Chinese Journal of Applied Ecology,2003, 14(4): 632-636. (in Chinese).
[46] 王宁. 重金属胁迫与生物样品中巯基化合物的应答作用[D]. 延吉:延边大学, 2014.WANG N. Heavy metal stress and the response of sulfhydryl compounds in biological samples [D]. Yanji: Yanbian University,2014. (in Chinese)
[47] COLEMAN J, BLAKE-KALFF M, DAVIES E. Detoxification of xenobiotics by plants: Chemical modification and vacuolar compartmentation.Trends in Plant Science, 1997, 2(4): 144-151.
[48] FREEMAN J L, PERSANS M W, NIEMAN K.Increased glutathione biosynthesis plays a role in nickel tolerance in Thlaspi nickel hyper accumulators.Plant Cell, 2004, 16(8): 2176-2191.
[49] COBBETT C, GOLDSBROUGH P. Phytochelatins and metallothioneins:Roles in heavy metal detoxification and homeostasis.Annual Review of Plant Biology, 2002, 53(1): 159.
[50] NOCTOR G, GOMEZ L, VANACKER H, FOYER C H. Interaction between biosynthesis, compartmentation and tansport in the control of gluthione homeostasis and signaling.Journal of Experimental Botany,2002, 53(372): 1283-1304.
[51] SUGIYAMA K, IZAWA S, INOUE Y. The Yap 1p- dependent induction of glutathione synthesis in heat shock response ofSaccharomyces cerevisiae.Journal of Biological Chemistry, 2000,275(20): 15535-15540.
[52] IZAWA S, INOUE Y, KIMURA A. Oxidative stress response in yeast:Effect of glutathione on adaptatin to hydrogen peroxide stress inSaccharomyces cerevisiae.FEBS Letters, 1995, 368(1): 73-76.
[53] WESTWATER J, MCLAREN N F, DORMER U H, JAMIESON D J.The adaptive response ofSaccharomyces cerevisiaeto mercury exposure.Yeast, 2002, 19(3): 233-239.
[54] SHANMUGANATHANA, AVERY SV, WILLETTS S A.Copperinduced oxidative stress inSaccharomyces cerevisiaetargets enzymes of the glycolytic pathway.FEBS Letters, 2004, 556(1-3): 253-259.
[55] SUGIYAMA K, KAWANRA A, IZAWA S, INOUE Y.Role of glutathione in heat-shock-induced cell death ofSaccharomyces cerevisiae.Biochemical Journal, 2000, 352(1): 71-78.
[56] TONGUL B, KAVAKCIOGLU B, TARHAN L. Chloramine T induced oxidative stress and the response of antioxidant system inPhanerochaete chrysosporium.Folia Microbiologica, 2017(1-2):1-9.
[57] MUKAI K, MORINCOTO H, OKAUCHI Y, NAGAOKA S. Kinetic study of reactions between tocopheroxyl radicals and fatty acids.Lipids, 1993, 28(8): 753-756.
