柑橘大实蝇滞育型与非滞育型蛹的代谢谱比较
2019-04-03王佳王攀樊欢刘映红
王佳,王攀,樊欢,刘映红
(西南大学植物保护学院,重庆 400716)
0 引言
【研究意义】柑橘大实蝇(Bactrocera minax)是一种重要的柑橘害虫,近年来对柑橘产业造成了巨大损失[1-3]。该虫为一化性害虫,越冬蛹历期可长达6个月,其间发生专性滞育。滞育在协调昆虫与环境之间的关系中具有十分重要的作用,探讨柑橘大实蝇滞育过程中体内物质代谢的变化,不仅有利于了解其生长发育的内在规律,也有助于揭示柑橘大实蝇发生滞育并适应恶劣环境的分子机制。【前人研究进展】一化性昆虫的专性滞育固定发生在特定的虫态下,不需要接受任何外界因子的诱导[4]。柑橘大实蝇在蛹期出现专性滞育,但滞育起始和终止的确切时间长期以来都不明确,而新陈代谢受到强烈抑制是滞育的典型特征,因此可以将呼吸速率作为判断滞育进程的指标[5-6]。前期通过对柑橘大实蝇整个蛹期进行呼吸速率的监测,发现在化蛹一个月以后进入深度滞育状态,大约持续两个月后滞育解除并恢复发育[7]。滞育是一个复杂的生理过程,而各种高通量、大规模的组学检测分析技术为全面、深入地发掘滞育机理提供了便利,并且得到广泛应用[7-13]。核磁共振技术(nuclear magnetic resonance,NMR)是代谢组学研究的主要方法之一,可全面检测生物体内各种代谢路径的底物和产物小分子代谢物水平在某种刺激或状态下所产生的整体变化(量变以及质变),来探索生命体的生物过程[14-15]。近年来,代谢组检测在昆虫研究领域中逐渐得到应用,包括昆虫滞育的相关研究[7,9-10,13]。目前,已有研究利用表达谱和代谢谱技术对柑橘大实蝇不同发育阶段的蛹进行比较分析,发掘出在蛹滞育期与滞育前、后有显著变化的基因和代谢物,它们可能参与到滞育的起始或结束过程中[7-8]。在此基础上,进一步将滞育蛹与非滞育蛹进行组学比较分析,能够验证并最终明确与滞育相关的代谢物、基因和蛋白质等。鉴于柑橘大实蝇发生专性滞育的习性,无法通过改变环境来获取非滞育蛹,但可通过在化蛹初期注射20-羟基蜕皮酮(20E)来解除滞育[16-17]。此外,已有的柑橘大实蝇转录组数据能够为后期深入研究滞育相关生理途径的作用机理提供基础[8,18]。【本研究切入点】通过在柑橘大实蝇化蛹初期注射20E和溶剂,分别获取非滞育型蛹(non-diapause-destined,ND)与对照滞育型蛹(diapause-destined,D),再利用NMR检测技术对两者的代谢组进行组内和组间的对比分析。【拟解决的关键问题】通过代谢组分析明确D型与ND型蛹各自在不同时间点之间的代谢物水平变化情况,以及相同时间点上D型与ND型蛹之间的代谢物浓度变化情况。发掘出与滞育相关的代谢物,为后续深入研究其在滞育中的作用机理打下基础。
1 材料与方法
试验于 2017—2018年在西南大学和武汉安隆科讯技术有限公司完成。
1.1 供试昆虫
于重庆市武隆县一个橘园中(29°20′56″N,107°45′20″E)采集柑橘大实蝇受害果并带回实验室。将受害果逐一剖开,取出柑橘大实蝇老熟幼虫,放置于沙土上使其自然入土化蛹。试验中所使用的蛹全都埋于沙土中,并放置于室外自然环境温度下。定期向土壤中喷水,使土壤湿度保持在适宜蛹存活的40%—70%。
1.2 非滞育型蛹与滞育型蛹的获取
柑橘大实蝇蛹滞育类型为专性滞育,自然状态下,所有虫体在化蛹约1个月后都将进入深度滞育状态。为了获取非滞育型蛹,在化蛹后1 d内,将20E粉末(HPLC级,Sigma公司)溶解于10%乙醇溶液中,配制终浓度为1.0 μg·μL-1的20E溶液,随后使用微注射仪(美国Drummond公司)在蛹的尾部背面注射1.0 μL的 20E溶液以解除滞育[16];同时,向其余部分蛹体内注射10%乙醇溶剂以获取对照滞育型蛹。最后将所有注射后的蛹埋入沙土中备用。
1.3 代谢物提取
在注射后的1、15和30 d,分别收集滞育型蛹(D1、D15和D30)与非滞育型蛹(ND1、ND15和ND30),将蛹置于研钵中,加入液氮充分研磨至粉末。每个时间点上的处理均设置5个生物学重复,每个重复取1头蛹。在每个重复中取15 mg研磨后的样品粉末,加入500 μL纯水,涡旋振荡1 min;在冰浴中超声波破碎4 s,间隔3 s,循环8次;13 000 r/min、4℃离心5 min后,将上清液于预洗的超滤膜(美国Millipore公司)中以13 000 r/min、4℃离心45 min过滤;取300 μL滤液与-80℃中预冷冻,然后再移至冻干机(美国LABCONCO公司)中冷冻干燥;加入135 μL重水复溶样本,再加入 15 μL ACDSS(Anachro Certified DSS Standard Solution)标准溶液,充分混匀;13 000 r/min、4℃离心2 min后,将上清液转移至微量管中,加入400 μL重水,将微量管装入核磁管中,封口备用。
1.4 样品的NMR检测
采用NMR谱仪(Agilent DD2 600 MHz spectrometer equipped with a triple-resonance cryoprobe,美国Agilent公司)采集核磁共振谱图。设置采集参数:温度298.15 K,共振频率599.79 MHz,采样数据点32 768个,累加次数128,谱宽7 225.434 Hz。将1H NMR自由感应衰减(free induction decay,FID)信号导入到Chenomx NMR suit(version 8.3,Chenomx,Edmonton,Canada)软件中,自动进行傅立叶转换,调整相位,校正基线。以DSS峰(0.0 ppm)作为全部谱图化学位移的标准,并对其进行反转卷积操作,调整谱图峰形(CSI)。根据NMR谱图中信号的相关信息(如化学位移、峰形、半峰宽、耦合裂分等),以 DSS的浓度和谱峰面积为标准,结合 Chenomx自带数据库对谱图的信号逐一比对分析,确定代谢物种类和对应的绝对浓度值。然后把代谢物和对应的绝对浓度值导出到 EXCEL表格中,得到变量矩阵,用于后续分析。
1.5 数据分析
将变量矩阵作为源数据进行质量归一化处理,导入 R平台的 PLS工具包,用偏最小二乘判别分析法(partial least squares discriminant analysis,PLS-DA)进行数据分析[19],判定D型与ND型蛹各自在不同时间点之间(D1对D15对D30;ND1对ND15对ND30),以及相同时间点上D型与ND型蛹之间的代谢谱差异(D1对 ND1;D15对 ND15;D30对 ND30),通过观察 PLS-DA得分图上各处理样品点之间的分离情况,判断代谢谱差异的显著性。样本组之间分离越远,则代谢谱差异越显著,反之则越相似。此外,在PLS-DA分析的基础上计算变量投影重要性值(variable importance in projection,VIP),VIP值越大说明代谢物在区分样品中所作贡献越大。随后,采用SPSS21.0软件对两种处理组内不同时间点的代谢物浓度进行单因素方差分析;对两种处理组间相同时间点上的代谢物浓度进行t检验。同时满足VIP>1,且P<0.05的代谢物被认定为在比较中具有显著性差异。
2 结果
2.1 柑橘大实蝇蛹的NMR图谱分析
根据柑橘大实蝇蛹的代谢物NMR归属图谱,参照Chenomx自带数据库对30张样本谱图的信号进行逐一比对分析,共获得50种代谢物及其浓度。其中,氨基酸及其衍生物20种、有机酸11种、糖类4种、核酸组分5种,其他代谢物10种(图1)。将代谢物的浓度进行质量归一化处理后,得到了每种代谢物在6个不同处理间的浓度比例(图2)。
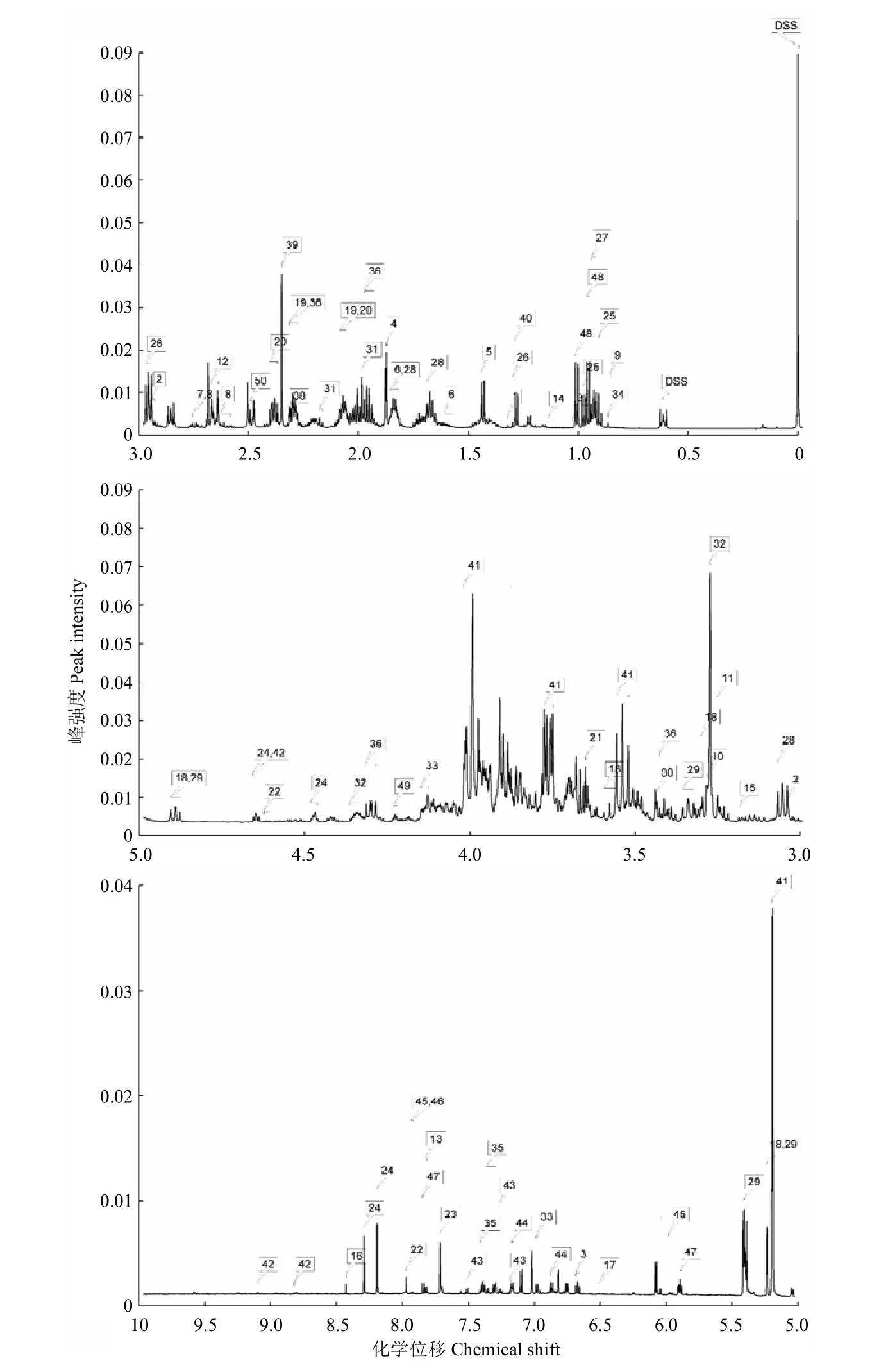
图1 柑橘大实蝇蛹代谢物的NMR图谱Fig. 1 NMR spectra of metabolites in B. minax pupae
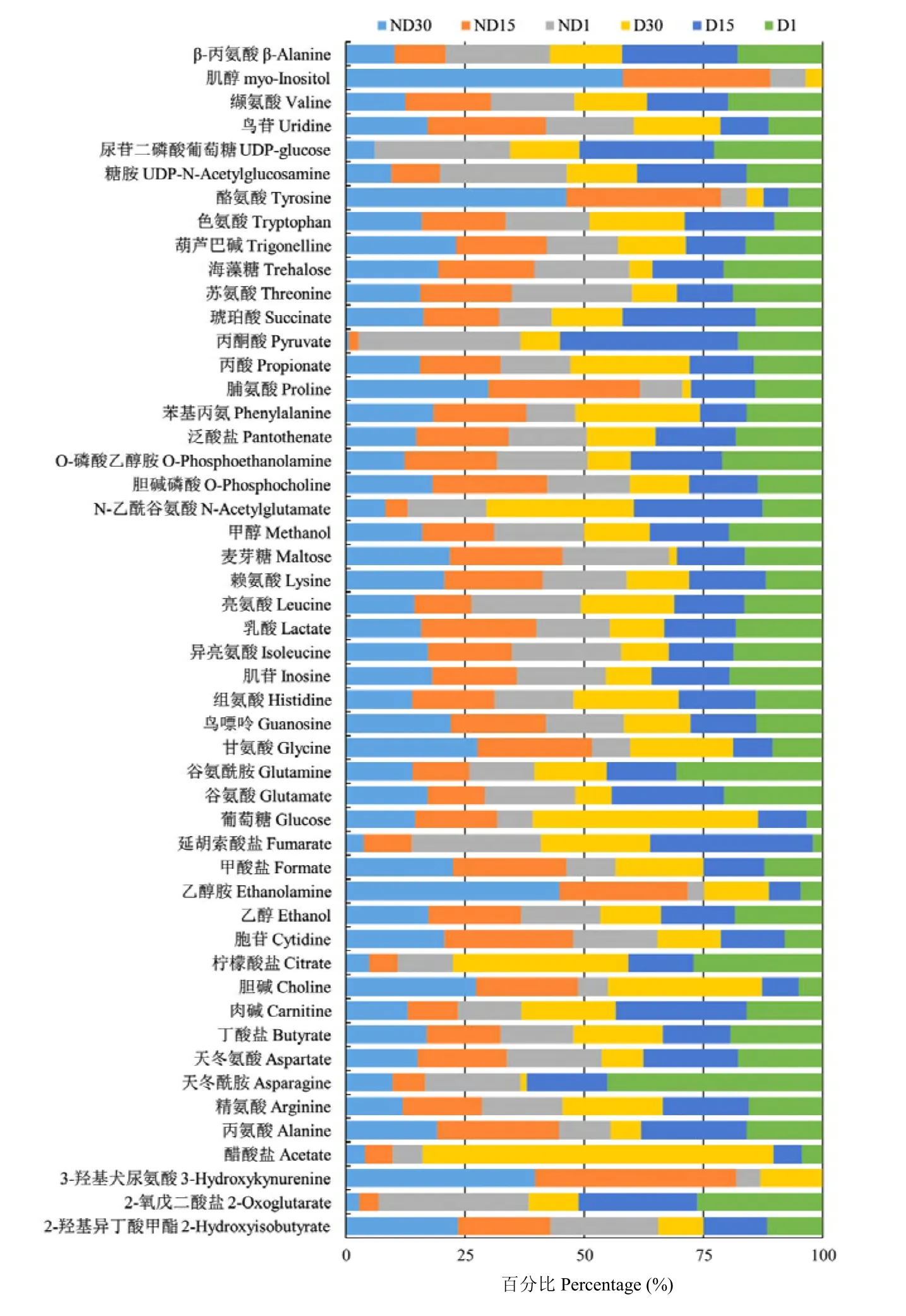
图2 柑橘大实蝇蛹代谢物在不同处理中的浓度百分比Fig. 2 Percentage of metabolite concentrations in different treatments of B. minax pupae
2.2 代谢谱差异的PLS-DA分析
利用PLS-DA分析D型与ND型蛹在组内不同时间点,以及组间相同时间点的代谢谱差异。共5种对比组合,分别绘制得分图。D型蛹的3个时间点样品在得分图中分离较好,且每个时间点5个样品相对聚拢,表示不同时间点样品代谢谱差异显著,且各处理重复性较好(图3-A);ND型蛹在注射20E后15 d和30 d样品之间的分离性较差,无显著差异,但两者均与注射后1 d样品之间的分离性较好,差异显著(图3-B)。在3个不同时间点上,D型与ND型蛹样品在得分图中均明显分离,呈现显著差异(图3-C、3-D、3-E)。进一步对5种对比组合的载荷图进行分析发现,大多数代谢物集中在原点附近,表示对差异贡献不大;少数代谢物在载荷1和载荷2方向上都远离原点,表示对差异贡献较大,且距离越远,对差异贡献越大(图4)。
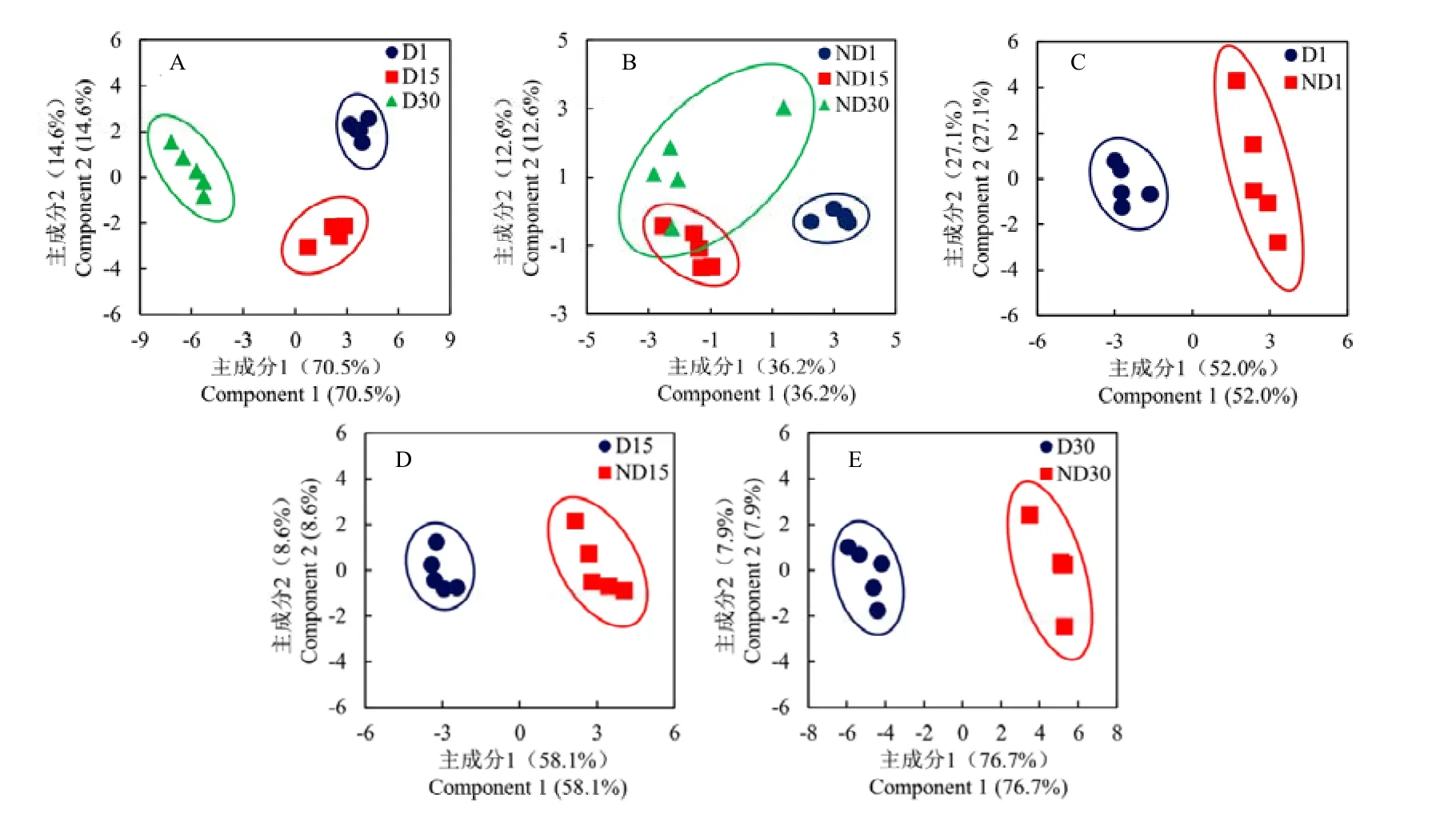
图3 不同对比组合间的PLS-DA得分图Fig. 3 PLS-DA scores plot for different types of comparisons
2.3 代谢谱差异的VIP分析
在PLS-DA分析的基础上,计算每个代谢物的VIP值,对VIP>1的代谢物进行方差分析或t检验。在5个对比组合中,共发现21种具有显著差异的代谢物(VIP>1且P<0.05),其中,D1对D15对D30组合中有10种(图5-A);ND1对ND15对ND30组合中有12种(图5-B);D1对ND1组合中有6种(图5-C);D15对ND15组合中有12种(图5-D);D30对ND30组合中有8种(图5-E)。在这21种代谢物中,柠檬酸、葡萄糖在5个对比组合中都差异显著;麦芽糖和脯氨酸在 4个对比组合中差异显著(麦芽糖:D1对D15对D30、D1对ND1、D15对ND15、D30对ND30;脯氨酸:D1对D15对D30、ND1对 ND15对ND30、D15对ND15、D30对 ND30);海藻糖、谷氨酸、天冬酰胺和N-乙酰谷氨酸在3个对比组合中差异显著(海藻糖、谷氨酸:D1对D15对D30、D15对 ND15、D30对 ND30;天冬酰胺:D1对D15对D30、ND1对ND15对ND30、D1对ND1;N-乙酰谷氨酸:ND1对ND15对ND30、D15对ND15、D30对ND30)。
3 讨论
柑橘大实蝇D型蛹在3个时间上的代谢谱呈现显著差异,这与滞育深度逐渐加强,代谢水平逐渐受到抑制有关。ND15与ND30的代谢谱差异不显著,这可能是由于 ND型蛹在这两个时间点上均处于解除滞育后的发育状态,物质代谢相对保持稳定。D型与 ND型蛹在不同时间点上的代谢谱均具有显著差异,但在D1对ND1组合中,差异显著的代谢物数量较少,且大多数代谢物在PLS-DA载荷图中分布更集中,距离原点更近,说明此时代谢谱差异小于其他两个时间点。

图4 不同对比组合间的PLS-DA载荷图Fig. 4 PLS-DA loading plot for different types of comparisons
在本研究5个组合中,共有21种代谢物呈现出显著差异,其中柠檬酸、葡萄糖、麦芽糖、脯氨酸、海藻糖、谷氨酸、天冬酰胺和N-乙酰谷氨酸出现显著差异的次数最多,且在相应组合中的VIP值排名靠前。这与麻蝇(Sarcophaga crassipalpis)[9]和棉铃虫(Helicoverpa armigera)[10]中的相关研究结果相似,表明这些物质与昆虫滞育存在普遍联系。在这些物质中,柠檬酸是三羧酸循环的中间产物;葡萄糖经糖酵解后生成丙酮酸,可作为三羧酸循环的起始物质;麦芽糖和海藻糖可分解成葡萄糖,随后进入糖酵解和三羧酸循环;谷氨酸和天冬酰胺经过转化后可分别生成三羧酸循环中间物质 2-氧戊二酸和草酰乙酸[20]。此外,三羧酸循环中的2-氧戊二酸、丙酮酸和琥珀酸也在特定组合中呈现显著差异。这些结果表明,柑橘大实蝇滞育对三羧酸循环产生了显著影响。在生命体中,三羧酸循环不仅为生命体提供能量,同时也是糖类、脂类和氨基酸三者之间相互转化的枢纽[20]。已有研究表明,三羧酸循环在昆虫滞育期间受到抑制[9,21-23],这与滞育期间代谢减弱相符合。另外,三羧酸循环的中间物质还能够刺激蜕皮激素分泌,从而调控昆虫的滞育进程[22]。在本研究中,三羧酸循环中的柠檬酸、丙酮酸和2-氧戊二酸在解除滞育15 d和30 d后,含量显著下降。一方面可能是因为蛹恢复发育后需要大量能量,从而增加了其消耗;另一方面可能是其转化为了其他物质,以保证正常发育下的物质平衡。然而,该循环在柑橘大实蝇滞育过程中的作用仍有待进一步研究。
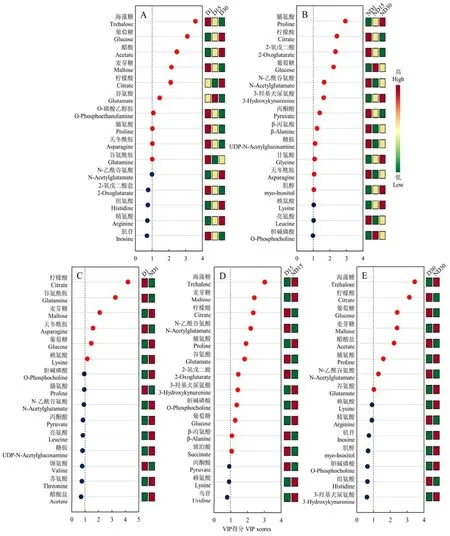
图5 不同对比组合间的VIP得分图Fig. 5 VIP scores plot for different types of comparisons
本研究发掘的一些差异显著的代谢物还与抗逆性有关。海藻糖在昆虫体内发挥至关重要的作用,既能作为能量来源物质,也能协助细胞抵御干燥、脱水、低温及氧化等多种环境胁迫[24-26]。研究表明,许多昆虫在越冬滞育期间通过积累海藻糖来抵御低温[27-29]。脯氨酸也能作为昆虫防冻剂,在低温下避免体液结冰对细胞造成伤害[30-31]。前期研究结果表明,柑橘大实蝇 D型蛹体内海藻糖和脯氨酸含量在深度滞育期间显著高于滞育前和滞育后,总体含量呈倒“U”字型变化[7]。在本研究中发现,D型蛹体内海藻糖和脯氨酸含量在化蛹后30 d内呈下降趋势,而在ND型蛹体内呈稳定或上升趋势。结合前后研究结果推断,D型蛹在进入深度滞育前,由于代谢水平逐渐降低,海藻糖和脯氨酸的含量也随之降低;进入深度滞育后,随着气温的降低,海藻糖和脯氨酸的含量也随之上升,以协助细胞抵御低温。而ND型蛹在彻底解除滞育后,海藻糖和脯氨酸的含量与代谢水平一样保持相对稳定。此外,肌醇也能够在低温环境下为多种昆虫提供抗冻保护,尤其是提高一些滞育越冬昆虫的耐寒性[21,32-33]。在本研究中,随着时间推移,D型蛹体内的肌醇含量始终较低,而ND型蛹体内的肌醇含量逐渐上升,这可能有助于提高耐寒性,从而应对冬季低温。
此外,还有一些差异显著的代谢物具有其他重要的功能。3-羟基犬尿氨酸是色氨酸的代谢产物,与眼色素的形成有密切关系[34-35],因此,ND型蛹体内高浓度的 3-羟基犬尿氨酸可能与复眼发育需要大量眼色素有关。N-乙酰谷氨酸是尿素循环的强制激活剂,促进新陈代谢中产生的有毒物质氨进入尿素循环,最终转化为无毒的尿素[36]。在注射后15 d和30 d,N-乙酰谷氨酸在 D型蛹中浓度高于非滞育型蛹,表明 D型蛹体内将有更多的氨进入尿素循环。这可能是由于D型蛹较弱的新陈代谢抑制了氨基酸的合成,导致氨过剩的结果。此外,有研究报道,滞育型棉铃虫幼虫可能通过在体内积累大量尿素达到抵御低温的作用[10]。柑橘大实蝇 D型蛹也同样可能利用尿素来提高其耐寒性。
4 结论
在柑橘大实蝇非滞育型蛹(ND)与对照滞育型蛹(D)的5个组合(D1对D15对D30;ND1对ND15对ND30;D1对ND1;D15对ND15;D30对ND30)中,共有21种代谢物浓度至少出现一次显著差异,其中柠檬酸、葡萄糖、麦芽糖、脯氨酸、海藻糖、谷氨酸、天冬酰胺和N-乙酰谷氨酸出现显著差异的次数最多。这些物质能直接或间接进入三羧酸循环,说明柑橘大实蝇滞育期间能量代谢和物质转化产生了显著变化。此外,海藻糖、脯氨酸、N-乙酰谷氨酸和肌醇的显著差异有助于调控柑橘大实蝇滞育期间的耐寒性。研究结果可为后续解析重要代谢物及相关生理途径在柑橘大实蝇滞育中的作用机理提供依据。
[1] DORJI C, CLARKE A R, DREW R A I, FLETCHER B S, LODAY P,MAHAT K, RAGHU S, ROMIG M C. Seasonal phenology ofBactrocera minax(Diptera: Tephritidae) in western Bhutan.Bulletin of Entomological Research, 2006, 96(5): 531-538.
[2] DREW R A I, DORJI C, ROMIG M C, LODAY P. Attractiveness of various combinations of colors and shapes to females and males ofBactrocera minax(Diptera: Tephritidae) in a commercial mandarin grove in Bhutan.Journal of Economic Entomology, 2006, 99(5):1651-1656.
[3] 王小蕾, 张润杰. 桔大实蝇生物学、生态学及其防治研究概述. 环境昆虫学报, 2009, 31(1): 73-79.WANG X L, ZHANG R J. Review on biology, ecology and control ofBactrocera(Tetradacus)minaxEnderlein.Journal of Environmental Entomology, 2009, 31(1): 73-79. (in Chinese)
[4] DENLINGER D L. Regulation of diapause.Annual Review of Entomology, 2002, 47: 93-122.
[5] HAHN D A, DENLINGER D L. Meeting the energetic demands of insect diapause: Nutrient storage and utilization.Journal of Insect Physiology, 2007, 53(8): 760-773.
[6] RAGLAND G J, FULLER J, FEDER J L, HAHN D A. Biphasic metabolic rate trajectory of pupal diapause termination and post-diapause development in a tephritid fly.Journal of Insect Physiology, 2009, 55(4): 344-350.
[7] WANG J, FAN H, XIONG K C, LIU Y H. Transcriptomic and metabolomic profiles of Chinese citrus fly,Bactrocera minax(Diptera:Tephritidae), along with pupal development provide insight into diapause program.PLoS ONE, 2017, 12(7): e0181033.
[8] DONG Y C, DESNEUX N, LEI C L, NIU C Y. Transcriptome characterization analysis ofBactrocera minaxand new insights into its pupal diapause development with gene expression a nalysis.International Journal of Biological Sciences, 2014, 10(9):1051-1063.
[9] MICHAUD M R, DENLINGER D L. Shifts in the carbohydrate,polyol, and amino acid pools during rapid cold-hardening and diapause-associated cold-hardening in flesh flies (Sarcophaga crassipalpis): a metabolomic comparison.Journal of Comparative Physiology B-Biochemical Systemic and Environmental Physiology,2007, 177(7): 753-763.
[10] ZHANG Q, LU Y X, XU W H. Proteomic and metabolomic profiles of larval hemolymph associated with diapause in the cotton bollworm,Helicoverpa armigera.BMC Genomics, 2013, 14: 751.
[11] KOŠTÁL V, ŠTĚTINA T, POUPARDIN R, KORBELOVÁ J, BRUCE A W. Conceptual framework of the eco-physiological phases of insect diapause development justified by transcriptomic profiling.Proceedings of the National Academy of Sciences of the United States of America,2017, 114(32): 8532-8537.
[12] TU X, WANG J, HAO K, WHITMAN D W, FAN Y, CAO G, ZHANG Z. Transcriptomic and proteomic analysis of pre-diapause and non-diapause eggs of migratory locust,Locusta migratoriaL.(Orthoptera: Acridoidea).Scientific Reports, 2015, 5: 11402.
[13] ZHANG Q, LU Y X, XU W H. Integrated proteomic and metabolomic analysis of larval brain associated with diapause induction and preparation in the cotton bollworm,Helicoverpa armigera.Journal of Proteome Research, 2012, 11(2): 1042-1053.
[14] WISHART D S. Quantitative metabolomics using NMR.Trends in Analytical Chemistry, 2008, 27(3): 228-237.
[15] 夏建飞, 梁琼麟, 胡坪, 王义明, 罗国安. 代谢组学研究策略与方法的新进展. 分析化学, 2009, 37(1): 136-143.XIA J F, LIANG Q L, HU P, WANG Y M, LUO G A. Recent trends in strategies and methodologies for metabonomics.Chinese Journal of Analytical Chemistry, 2009, 37(1): 136-143. (in Chinese)
[16] WANG J, ZHOU H Y, ZHAO Z M, LIU Y H. Effects of juvenile hormone analogue and ecdysteroid on adult eclosion of the fruit flyBactrocera minax(Diptera: Tephritidae).Journal of Economic Entomology, 2014, 107(4): 1519-1525.
[17] CHEN Z, DONG Y, WANG Y, ANDONGMA A A, RASHID M A,KRUTMUANG P, NIU C. Pupal diapause termination inBactrocera minax: an insight on 20-hydroxyecdysone induced phenotypic and genotypic expressions.Scientific Reports, 2016, 6: 27440.
[18] WANG J, XIONG K C, LIU Y H.De novotranscriptome analysis of Chinese citrus fly,Bactrocera minax(Diptera: Tephritidae), by high-throughput Illumina sequencing.PLoS ONE, 2016, 11(6):e0157656.
[19] MEVIK B H, WEHRENS R. The pls package: Principal component and partial least squares regression in R.Journal of Statistical Software, 2007, 18(2): 1-23.
[20] BERG J M, TYMOCZKO J L, STRYER L.Biochemistry. 5th ed. New York: W.H. Freeman & Co Ltd, 2002.
[21] LU Y X, ZHANG Q, XU W H. Global metabolomic analyses of the hemolymph and brain during the initiation, maintenance, and termination of pupal diapause in the cotton bollworm,Helicoverpa armigera.PLoS ONE, 2014, 9(6): e99948.
[22] XU W H, LU Y X, DENLINGER D L. Cross-talk between the fat body and brain regulates insect developmental arrest.Proceedings of the National Academy of Sciences of the United States of America, 2012,109(36): 14687-14692.
[23] 刘遥, 张礼生, 陈红印, 黄凤霞, 蒋莎, 任小云. 苹果酸脱氢酶与异柠檬酸脱氢酶在滞育七星瓢虫中的差异表达. 中国生物防治学报, 2014, 30(5): 593-599.LIU Y, ZHANG L S, CHEN H Y, HUANG F X, JIANG S, REN X Y.Differential expression of malate dehydrogenase and isocitrate dehydrogenase in diapaused ladybird,Coccinella septempunctataL.Chinese Journal of Biological Control, 2014, 30(5): 593-599. (in Chinese)
[24] JAIN N K, ROY I. Effect of trehalose on protein structure.Protein Science, 2009, 18(1): 24-36.
[25] THOMPSON S N. Trehalose-The insect ‘blood’ sugar//SIMPSON S J.Advances in Insect Physiology. Elsevier Ltd., 2003, 31: 205-285.
[26] 唐斌, 张露, 熊旭萍, 汪慧娟, 王世贵. 海藻糖代谢及其调控昆虫几丁质合成研究进展. 中国农业科学, 2018, 51(4): 697-707.TANG B, ZHANG L, XIONG X P, WANG H J, WANG S G.Advances in trehalose metabolism and its regulation of insect chitin synthesis.Scientia Agricultura Sinica, 2018, 51(4): 697-707. (in Chinese)
[27] GUO Q, HAO Y J, LI Y, ZHANG Y J, REN S, SI F L, CHEN B.Gene cloning, characterization and expression and enzymatic activities related to trehalose metabolism during diapause of the onion maggotDelia antiqua(Diptera: Anthomyiidae).Gene, 2015,565(1): 106-115.
[28] KOŠTÁL V, ŠIMEK P. Dynamics of cold-hardiness, supercooling and cryoprotectants in diapausing and non-diapausing pupae of the cabbage root fly,Delia radicumL..Journal of Insect Physiology, 1995,41(7): 627-634.
[29] ROZSYPAL J, KOŠTÁL V, ZAHRADNÍČKOVÁ H, ŠIMEK P.Overwintering strategy and mechanisms of cold tolerance in the codling moth (Cydia pomonella).PLoS ONE, 2013, 8(4): e61745.
[30] KOŠTÁL V, ŠIMEK P, ZAHRADNÍČKOVÁ H, CIMLOVA J,STETINA T. Conversion of the chill susceptible fruit fly larva(Drosophila melanogaster) to a freeze tolerant organism.Proceedings of the National Academy of Sciences of the United States of America,2012, 109(9): 3270-3274.
[31] KOŠTÁL V, ZAHRADNÍČKOVÁ H, ŠIMEK P. Hyperprolinemic larvae of the drosophilid fly,Chymomyza costata, survive cryopreservation in liquid nitrogen.Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(32):13041-13046.
[32] BEMANI M, IZADI H, MANDIAN K, KHANI A, SAMIH M A.Study on the physiology of diapause, cold hardiness and supercooling point of overwintering pupae of the pistachio fruit hull borer,Arimania comaroffi.Journal of Insect Physiology, 2012, 58(7):897-902.
[33] WATANABE M, TANAKA K. Seasonal change of the thermal response in relation tomyo-inositol metabolism in adults ofAulacophora nigripennis(Coleoptera Chrysomelidae).Journal of Insect Physiology,1999, 45(2): 167-172.
[34] LI J, LI G. Transamination of 3-hydroxykynurenine to produce xanthurenic acid: a major branch pathway of tryptophan metabolism in the mosquito,Aedes aegypti, during larval development.Insect Biochemistry and Molecular Biology, 1997, 27(10): 859-867.
[35] MACKENZIE S M, HOWELLS A J, COX G B, EWART G D.Sub-cellular localisation of the White/Scarlet ABC transporter to pigment granule membranes within the compound eye ofDrosophila melanogaster.Genetica, 2000, 108(3): 239-252.
[36] CALDOVIC L, TUCHMAN M.N-acetylglutamate and its changing role through evolution.TheBiochemical Journal, 2003, 372(2):279-290.
