水稻广谱抗稻瘟病基因PigmR功能标记的开发及应用
2019-04-03王芳权陈智慧许扬王军李文奇范方军陈丽琴陶亚军仲维功杨杰
王芳权,陈智慧,许扬,王军,李文奇,范方军,陈丽琴,陶亚军,仲维功,杨杰
(1江苏省农业科学院粮食作物研究所/国家水稻改良中心南京分中心/江苏省优质水稻工程技术研究中心,南京 210014;2扬州大学/江苏省粮食作物现代产业技术协同创新中心,江苏扬州 225009)
0 引言
【研究意义】水稻是全球重要的粮食作物之一,保证水稻高产稳产具有重要的生产和社会意义。稻瘟病是危害水稻稳产、优质和安全生产的主要因素之一,严重时可导致水稻减产40%—50%,甚至颗粒无收[1]。近几年,江淮稻区稻瘟病频发,给国家造成大量经济损失[2]。培育与利用抗病品种是解决稻瘟病危害最经济有效的方式[3],而这离不开抗病基因的挖掘与利用。【前人研究进展】目前,已经定位得到了100多个水稻稻瘟病抗性相关基因,其中30多个基因被成功克隆,包括Pib[4]、Pi-ta[5]、Pi54[6]、pi21[7]、bsr-d1[8]、Piz-t[9]、Pi9[10]、Pi50[11-12]、Pigm[13-14]、Ptr[15]等。PigmR是一个广谱抗稻瘟病基因,来源于谷梅 4号的Pigm/Pi2-Pi9基因簇[13-14]。Pigm/Pi2-Pi9基因簇在不同品种或资源材料中的R基因拷贝数不同,例如,日本晴含有7个R基因(R1、R2、R3、R9、R10、R12和R13),9311含有5个R基因(R1、R2、R3、R11和R12),谷梅4号含有 13个R基因(R1—R13)[14]。在谷梅 4号的Pigm/Pi2-Pi9基因簇中,R4、R6和R8能形成完整的转录产物。R6为抗病基因,是具有功能的Pigm,称为PigmR,在日本晴、9311等大多数品种或种质中不存在等位基因;R4与PigmR在蛋白质水平上存在 4个氨基酸的差异,不具有功能,称为Pigm-R4;R8为感病基因,称为PigmS。研究发现,PigmR对来源于世界各地的50个稻瘟病供试菌株表现抗性[14,16],具有抗谱广、抗性强的特点,有很好的应用前景。传统的水稻抗稻瘟病遗传育种是通过对植株进行稻瘟病自然诱发或人工接种的方式进行表型鉴定,人力物力投入大,且受外界因素影响大,鉴定结果往往存在较大误差。分子标记辅助选择是提高抗稻瘟病水稻育种效率的有效途径[17-18]。【本研究切入点】目前,已报道的针对抗病基因PigmR的标记大多基于Pigm/Pi2-Pi9基因簇开发,如 Indel587、Pigm-4、G1408、Pigm-SM等[19-22],与PigmR存在一定的分离概率,在分子标记辅助选择育种过程中,可能存在连锁累赘或丢失目标基因的问题[20]。功能标记是基于基因内突变位点开发的,与基因完全共分离,能有效解决连锁标记的问题。【拟解决的关键问题】本研究根据抗病基因PigmR的序列特点,设计并优化功能标记。利用功能标记进行分子标记辅助选择,以获得穗颈瘟抗性显著改善的水稻新材料,加快该基因在抗稻瘟病水稻育种中的应用。
1 材料与方法
1.1 试验材料
水稻材料包括PigmR供体材料谷梅4号在内的水稻亲本材料 229份,丽江新团黑谷单基因系材料 29份,2017—2018年江苏省迟熟中粳预备试验材料216份和早熟晚粳区域试验(早熟组)材料24份。遗传群体为南粳53045/谷梅4号的BC1F2和BC1F3群体。29份丽江新团黑谷单基因系材料由国际水稻研究所提供,其他试验材料均由江苏省农业科学院收集和保存。水稻材料均种植于试验田,以常规方法栽培。
1.2 PCR扩增与电泳检测
采用 CTAB法提取水稻样品的基因组DNA。应用Oligo 7软件设计分子标记引物(由Invitrogen公司合成),进行 PCR扩增。PCR反应的体系为基因组DNA 2 µL、10×PCR buffer 2 µL、MgCl2(5 mmol·L-1)2 µL、dNTP(2 mmol·L-1)2 µL、上游引物(2 µmol·L-1)2 µL、下游引物(2 µmol·L-1)2 µL、Taq 酶 0.2 µL 和ddH2O 7.8 µL。扩增条件为 94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 30 s,35 个循环;72℃ 10 min。扩增产物经琼脂糖凝胶电泳分离,用凝胶成像仪拍照,并记录结果。
1.3 序列分析
谷梅4号Pigm/Pi2-Pi9基因簇参考序列的GenBank登录号为KU904633[14]。采用Snapgene 2.3.2软件进行核酸序列分析。
1.4 表型鉴定
在江苏省农业科学院试验田进行稻瘟病表型鉴定。稻瘟病的供试菌株为江苏省农业科学院植物保护研究所分离得到的江苏省稻瘟病代表菌株(2018-4、2018-65、2018-102、2018-222和2018-241)的混合菌。将供试菌株移植RCA(玉米粉40 g、稻秆50 g和琼脂20 g)培养基上,25℃培养7 d,用黑光灯照射72 h,待稻瘟病菌产生孢子后,再用无菌水洗下,配成10×10倍显微镜下每视野30—40个孢子的悬浮液。采用人工注射接种法进行水稻穗颈瘟的抗性鉴定,于水稻抽穗前3—4 d注射混合菌株,每穗注射1 mL菌液,做好标记。在水稻灌浆成熟后进行抗性调查,参照国际水稻研究所分级标准调查穗颈瘟抗性级别[23]。
2 结果
2.1 PigmR序列分析及功能标记的设计
Pigm基因簇中,PigmR与Pigm-R4、PigmS高度同源且紧密连锁,PigmR为有功能的Pigm,Pigm-R4不具有功能,PigmS为感病基因。通过序列比对发现,PigmR与PigmS的编码区存在82个碱基差异,PigmR与Pigm-R4的编码区存在6个碱基差异,其中第2 557、2 572、2 579、2 881位为PigmR与PigmS、Pigm-R4均存在差异的碱基(图1)。
为了开发PigmR特异的功能标记,根据PigmR与PigmS、Pigm-R4均存在的差异位点,设计了8对基因特异检测引物(表1),其中GMR-1、GMR-2、GMR-3和 GMR-4用于特异检测PigmR,GMS-1、GMS-2、GMS-3和GMS-4用于特异检测PigmS。部分引物中引入了碱基错配,GMR-2F、GMS-2F、GMR-4F和GMS-4F 引物 5′-3′的倒 3位碱基由 A 错配为 C,GMR-4R和GMS-4R引物5′-3′的倒3位碱基由G错配为C。PigmR在很多品种中不存在,因此,还设计了2对特异检测内参基因Actin1的分子标记(表1),以排除样品、试验操作等过程中引起的假阴性。

图1 PigmR与部分同源基因在变异位点的序列比对Fig. 1 Sequence alignment of the variation sites between PigmR and parts of its homologous genes

表1 分子标记引物Table 1 The primers of molecular marker
2.2 功能标记的检测及优化
以谷梅4号、日本晴和黄华占的基因组为模板,对设计的分子标记进行PCR筛选(图2)。结果发现,GMR-1、GMR-2和GMR-4 3个标记对谷梅4号、日本晴和黄华占3个品种均无条带;GMS-1、GMS-2和GMS-3 3个标记能在谷梅 4号和日本晴中扩增出条带;GMR-3和GMS-4仅能在谷梅4号中扩增出条带。根据设计,GMR-3特异检测的是抗病基因PigmR,GMS-4特异检测的是感病基因PigmS,因此,选取GMR-3进行条件优化。
为进一步分析 GMR-3对PigmR的特异性,将PigmR与Pi9、Pi2和Piz-t进行比较,发现GMR-3上下游引物能特异匹配PigmR(图1)。
PigmR在很多品种或材料中不存在,因此还设计了特异检测内参基因Actin1的分子标记(表1),以排除样品、试验操作等过程中引起的假阴性。检测结果发现,Actin1-1和Actin1-2均能对谷梅4号、日本晴和黄华占扩增出特异明亮条带(图 3)。为优化引物的浓度配比,选取GMR-3和Actin1-1引物,设计12个不同浓度试验(图4)。结果发现,0.4 µmol·L-1GMR-3与 0.1 µmol·L-1Actin1-1组合浓度扩增出PigmR和Actin1特征条带的效率相当,效果最优(图4)。将 0.4 µmol·L-1GMR-3 和 0.1 µmol·L-1Actin1-1引物混合组成的分子标记命名为GMRA。携带PigmR的样品能被GMRA同时扩增出146和98 bp条带,不携带PigmR的样品仅能被GMRA扩增出146 bp条带。
2.3 GMRA标记检测水稻材料
利用GMRA标记检测229份水稻亲本材料,结果表明,只有谷梅4号能检测到PigmR条带,其他粳稻和籼稻品种均不能扩增出98 bp特征条带(图5和表2)。为进一步验证GMRA的特异性,还检测了29份丽江新团黑谷单基因系,发现这些材料均无PigmR特征条带,表明GMRA有很好的特异性,且能区分PigmR与Pi9、Piz、Piz-t等同源性高的基因(电子附图1和表3)。

图2 PigmR分子标记的扩增结果Fig. 2 The PCR amplification products of molecular maker for PigmR

图3 Actin1鉴定分子标记的扩增结果Fig. 3 PCR amplification products of molecular maker for Actin1
以上结果表明,针对抗病基因的特异序列设计的GMRA标记能特异检测谷梅4号携带的PigmR,可用于分子标记辅助选择育种。
为进一步明确PigmR在江苏粳稻育种中的利用情况,用GMRA标记检测了江苏省迟熟中粳预备试验中间材料216份、早熟晚粳区域试验(早熟组)中间材料24份,共鉴定到3份中间材料携带PigmR,表明PigmR在江苏粳稻育种中已经使用,但使用频率仍然很低。这些中间材料可以作为良好的供体材料,在粳稻育种中进一步利用。
2.4 GMRA标记在育种中的应用
利用GMRA标记对南粳53045/谷梅4号的BC1F2群体的320个单株进行检测,共检测到198个单株携带PigmR,部分单株检测结果见图6。保留携带PigmR的单株,待成熟后按单株收种。种植BC1F3代株系,在部分株系中各选取10个单株进行检测。若10个单株均表现为携带PigmR,根据分离比例,该株系为PigmR纯合系;若 10个单株中有部分单株不携带PigmR,表明该株系的PigmR分离。本研究共检测了19个株系的190个单株,6个系的PigmR纯合,13个系的PigmR分离(图7)。随机选取38个单株进行穗颈瘟接种发现,携带PigmR的单株均对穗颈瘟表现为抗或中抗;不携带PigmR的单株均表现为高感(图8和电子附表1)。以上结果表明,GMRA功能标记可以准确鉴定PigmR,具有很好的特异性,能有效用于分子标记辅助选育抗稻瘟病水稻新品种。

图4 PigmR鉴定引物的优化Fig. 4 Optimization of identification primers for PigmR
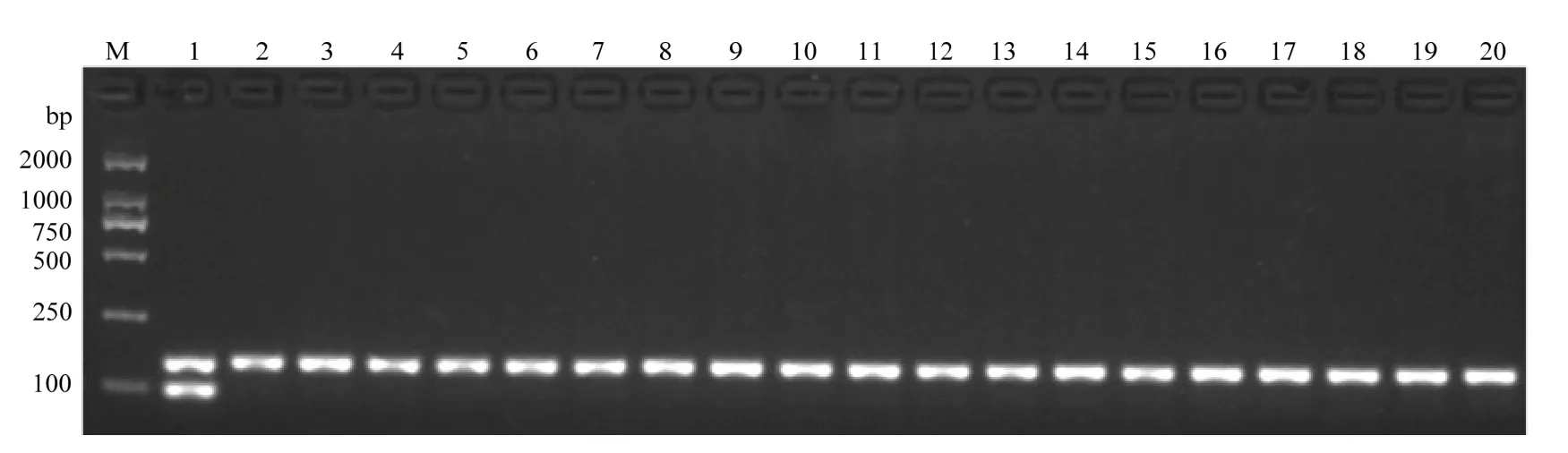
图5 GMRA标记检测水稻品种/品系Fig. 5 Molecular detection for partial varieties by GMRA

图6 GMRA标记检测南粳53045/谷梅4号的BC1F2群体单株Fig. 6 The molecular detection of BC1F2 of Nangeng53045/Gumei 4 by GMRA

表2 GMRA标记鉴定部分水稻材料Table 2 Identification of partial rice materials by GMRA
续表2 Continued table 2

续表2 Continued table 2

表3 GMRA标记鉴定部分丽江新团黑谷单基因系Table 3 Identification of partial monogenic lines of Lijiangxintuanheigu by GMRA

图7 GMRA标记检测南粳53045/谷梅4号的BC1F3群体部分单株Fig. 7 The molecular detection of BC1F3 of Nangeng53045/Gumei 4 by GMRA

图8 南粳53045/谷梅4号的BC1F3群体穗颈瘟鉴定结果Fig. 8 Infection of rice panicle blast in BC1F3 plants of Nangeng53045/Gumei 4
3 讨论
稻瘟病是世界上最严重的水稻病害之一,被称为水稻的“癌症”。稻瘟病菌的生理小种组成复杂,群体大,具有高度的多样性和较强的变异性[24-25]。目前,推广品种仅携带一些抗谱较窄的抗病基因,容易因病菌种群结构的演化及新小种的产生而丧失抗性[26]。例如,近几年,在长江中下游地区广泛利用且具有较好抗性的Pi-ta等基因已经有抗性减弱的趋势。因此,利用具有广谱持久抗性的基因对于水稻抗稻瘟病育种具有重要的生产实践意义。
Pigm是一个广谱持久抗稻瘟病基因(簇),对来源于全国不同地区稻瘟病的代表性小种抗性频率高达91.9%,在生产上具有广泛的应用前景[16,26-28]。然而,Pigm基因簇与品质相关基因Wx和ALK、生育期相关基因Hd1和Hd3等农艺性状相关基因连锁[29-31]。而且,在谷梅4号的Pigm基因簇中,含有13个R基因,同时含有抗病基因PigmR和感病基因PigmS,以及与PigmR高度同源但无功能的Pigm-R4[12]。Pigm-R4、PigmS和PigmR紧密连锁,使得PigmR的利用显得困难重重。利用PigmR改良水稻稻瘟病抗性的同时保留优异农艺性状,需要经过多代的回交筛选,而在此过程中选用的分子标记非常关键。
目前,已经报道的针对抗病基因PigmR的标记大多基于其基因簇开发,如Indel587、Pigm-4、G1408、Pigm-SM等[14,19-22],与PigmR存在一定的分离概率,在分子标记辅助选择育种过程中可能存在连锁累赘或丢失目标基因的问题[20]。利用Pigm基因簇内Pigm-R4、PigmS和PigmR的碱基差异,设计的分子标记GMR-3为功能标记,该标记能区分PigmR与Pi9、Piz、Piz-t等同源性较高的基因。GMR-3为显性标记,即能扩增出条带的样品携带PigmR,不能扩增出条带的样品不携带PigmR。在基因的分子检测过程中,往往会因为 DNA样品质量、试验试剂的差异、试验操作人员的失误等原因而导致PCR的扩增失败,而显性标记不能像等位基因特异PCR、CAPS标记一样区分等位基因而避免这种假阴性[32]。因此,通过设计内参基因的检测标记,与显性标记同时对样品进行检测,有利于避免这种假阴性。由于GMR-3和Actin1-1扩增产物差异较大,引物GMR-3F、GMR-3R、Actin1-1F和Actin1-1R可以在一个PCR中进行,携带PigmR的样品能被GMRA同时扩增出146和98 bp条带,不携带PigmR的样品仅能被GMRA扩增出146 bp条带。该方法可以简单可靠的对样品进行鉴定。通过对 229份育种材料检测发现,GMRA可以特异扩增来源于谷梅4号的PigmR,特异性显著。以优质粳稻品系南粳53045为背景,利用GMRA进行分子标记辅助选择,成功获得了穗颈瘟抗性显著提高的新株系,表明GMRA能用于分子标记辅助选择育种中。因此,本研究设计的功能标记GMRA可以有效改善对PigmR的鉴定效果及在育种的应用。
4 结论
根据PigmR与Pigm-R4、PigmS的碱基差异设计和优化的功能标记GMRA能有效区分PigmR与Pi9、Piz、Piz-t等同源性较高的基因,具有很强的特异性,且可以有效避免因 PCR扩增失败引起的假阴性。PigmR在江苏粳稻育种中已经使用,但使用频率仍然很低,筛选获得的材料可以作为PigmR资源应用于粳稻抗稻瘟病育种中。
[1] KHAN M A I, BHUIYAN M R, HOSSAIN M S, SEN P P, ARA A,SIDDIQUE M A, ALI M A. Neck blast disease influences grain yield and quality traits of aromatic rice.Comptes Rendus Biologies, 2014,337(11): 635-641.
[2] 朱凤, 田子华, 邰德良, 刘永锋. 从2014年稻瘟病重发谈今后防控对策的改进. 江苏农业科学, 2016, 44(8): 155-158.ZHU F, TIAN Z H, TAI D L, LIU Y F. Improvement of prevention and control measures from the outburst of rice blast in 2014.Jiangsu Agricultural Sciences, 2016, 44(8): 155-158. (in Chinese)
[3] SHARMA T R, RAI A K, GUPTA S K, VIJAYAN J, DEVANNA B N,RAY S. Rice blast management through host-plant resistance:Retrospect and prospects.Agricultural Research, 2012, 1(1): 37-52.
[4] ROYCHOWDHURY M, JIA Y, JIA M H, FJELLSTROM R,CARTWRIGHT R D. Identification of the rice blast resistance genePibin the national small grains collection.Phytopathology, 2012,155(2): 700-706.
[5] BRYAN G T, WU K S, FARRALL L, JIA Y, HERSHEY H P,MCADAMS S A, FAULK K N, DONALDSON G K, TARCHINI R,VALENT B. A single amino acid difference distinguishes resistant and susceptible alleles of the rice blast resistance genePi-ta.The Plant Cell, 2000, 12(11): 2033-2046.
[6] SHARMA T R, RAI A K, GUPTA S K, SINGH N K. Broad-spectrum blast resistance genePi-k(h)cloned from rice line Tetep designated asPi54.Journal of Plant Biochemistry and Biotechnology, 2010, 19(1):87-89.
[7] FUKUOKA S, SAKA N, KOGA H, ONO K, SHIMIZU T, EBANA K,HAYASHI N, TAKAHASHI A, HIROCHIKA H, OKUNO K, YANO M. Loss of function of a proline-containing protein confers durable disease resistance in rice.Science, 2009, 325(5943): 998-1001.
[8] LI W, ZHU Z, CHERN M, YIN J, YANG C, RAN L, CHENG M, HE M, WANG K, WANG J, ZHOU X, ZHU X, CHEN Z, WANG J,ZHAO W, MA B, QIN P, CHEN W, WANG Y, LIU J, WANG W, WU X, LI P, WANG J, ZHU L, LI S, CHEN X. A natural allele of a transcription factor in rice confers broad-spectrum blast resistance.Cell, 2017, 170(1): 114-126.
[9] ZHOU B, QU S H, LIU G F, DOLAN M, SAKAI H, LU G D,BELLIZZI M, WANG G L. The eight amino-acid differences within three leucine-rich repeats betweenPi2andPiz-tresistance proteins determine the resistance specificity toMagnaporthe grisea.Molecular Plant-Microbe Interactions, 2006, 19(11): 1216-1228.
[10] QU S, LIU G, ZHOU B, BELLIZZI M, ZENG L, DAI L, HAN B,WANG G L. The broad-spectrum blast resistance genePi9encodes a nucleotide-binding site-leucine-rich repeat protein and is a member of a multigene family in rice.Genetics, 2006, 172(3): 1901-1914.
[11] ZHU X, CHEN S, YANG J, ZHOU S, ZENG L, HAN J, SU J, WANG L, PAN, Q. The identification ofPi50(t), a new member of the rice blast resistancePi2/Pi9multigene family.Theoretical and Applied Genetics, 2012, 124(7): 1295-1304.
[12] SU J, WANG W, HAN J, CHEN S, WANG C, ZENG L, FENG A,YANG J, ZHOU B, ZHU X. Functional divergence of duplicated genes results in a novel blast resistance genePi50at thePi2/9locus.Theoretical and Applied Genetics, 2015, 128(11): 2213-2225.
[13] DENG Y, ZHU X, SHEN Y, HE Z. Genetic characterization and fine mapping of the blast resistance locusPigm(t)tightly linked toPi2andPi9in a broad-spectrum resistant Chinese variety.Theoretical and Applied Genetics, 2006, 113(4): 705-713.
[14] DENG Y, ZHAI K, XIE Z, YANG D, ZHU X, LIU J, WANG X, QIN P, YANG Y, ZHANG G, LI Q, ZHANG J, WU S, MILAZZO J, MAO B, WANG E, XIE H, THARREAU D, HE Z. Epigenetic regulation of antagonistic receptors confers rice blast resistance with yield balance.Science, 2017, 355(6328): 962-965.
[15] ZHAO H, WANG X, JIA Y, MINKENBERG B, WHEATLEY M,FAN J, JIA M H, FAMOSO A, EDWARDS J D, WAMISHE Y,VALENT B, WANG G L, YANG Y. The rice blast resistance genePtrencodes an atypical protein required for broad-spectrum disease resistance.Nature Communications, 2018, 9(1): 2039.
[16] WU Y, XIAO N, YU L, PAN C, LI Y, ZHANG X, LIU G, DAI Z, PAN X, LI A. Combination patterns of major R genes determine the level of resistance to theM. oryzaein rice (Oryza sativaL.).PLoS ONE, 2015,10(6): e0126130.
[17] 杨杰, 杨金欢, 王军, 范方军, 朱金燕, 曹卿, 田胜尼, 仲维功. 稻瘟病抗病基因Pita和Pib在中国水稻地方品种中的分布. 华北农学报, 2011, 26(3): 1-6.YANG J, YANG J H, WANG J, FAN F J, ZHU J Y, CAO Q, TIAN S N, ZHONG W G. Distribution of two blast resistant genesPitaandPibin landrace rice in China.Acta Agriculture Boreali-Sinica, 2011,26(3): 1-6. (in Chinese)
[18] 王军, 赵婕宇, 许扬, 范方军, 朱金燕, 李文奇, 王芳权, 费云燕,仲维功, 杨杰. 水稻稻瘟病抗性基因Bsr-d1功能标记的开发和利用. 作物学报, 2018, 44(11): 1612-1620.WANG J, ZHAO J Y, XU Y, FAN F J, ZHU J Y, LI W Q, WANG F Q,FEI Y Y, ZHONG W G, YANG J. Development and application of functional markers for rice blast resistance geneBsr-d1in rice.Acta Agronomica Sinica, 2018, 44(11): 1612-1620. (in Chinese)
[19] 曾生元, 李闯, 杜灿灿, 孙立亭, 景德道, 林添资, 余波, 钱华飞,姚维成, 周义文, 龚红兵.Pigm特异性选择标记的开发及其在粳稻穗颈瘟抗性育种中的利用. 中国水稻科学, 2018, 32(5): 453-461.ZENG S Y, LI C, DU C C, SUN L T, JING D D, LIN T Z, YU B,QIAN H F, YAO W C, ZHOU Y W, GONG H B. Development of specific markers forPigmin marker-assisted breeding of panicle blast resistantjaponicarice.Chinese Journal of Rice Science, 2018, 32(5):453-461. (in Chinese)
[20] 潘存红, 李爱宏, 戴正元, 朱俊凯, 余玲, 肖宁, 李育红, 张小祥,刘广青, 赵步洪, 王宝和, 黄年生, 周长海, 谭长乐, 季红娟, 刘晓静. 一种用于检测谷梅 4号抗稻瘟病基因Pigm(t)的分子标记InDel587. 中国, ZL201310428162.0, 2015-11-25.PAN C H, LI A H, DAI Z Y, ZHU J K, YU L, XIAO N, LI Y H,ZHANG X Y, LIU G Q, ZHAO B H, WANG B H, HUANG N S,ZHOU C H, TAN C L, JI H J, LIU X J. A molecular marker InDel587 for detecting the rice blast resistance genePigm(t)of Gumei 4. China,ZL201310428162.0, 2015-11-25. (in Chinese)
[21] 戴小军, 杨远柱, 陈良碧, 胡小淳, 秦鹏, 符辰建. 水稻抗稻瘟病基因Pigm的分子标记方法. 中国, ZL201210325874.5, 2014-11-05.DAI X J, YANG Y Z, CHEN L B, HU X C, QIN P, FU C J. Molecular marker for rice blast resistance genePigm. China, ZL201210325874.5,2014-11-05. (in Chinese)
[22] 田大刚, 王锋, 陈松彪, 陈子强, 林艳, 陈在杰, 杨立明, 胡昌泉.一种稻瘟病抗性基因Pigm功能特异性分子标记及其应用. 中国,ZL201810054317.1, 2018-05-04.TIAN D G, WANG F, CHEN S B, CHEN Z Q, LIN Y, CHEN Z J,YANG L M, HU C Q. A specific molecular marker for rice blast resistance genePigmand its application. China, ZL201810054317.1,2018-05-04. (in Chinese)
[23] International Rice Research Institute. Standard Evaluation System for Rice (SES). Manila: International Rice Research Institute, 2013.
[24] 刘海涛, 徐倩, 何炜, 魏林艳, 张建福, 谢华安. 水稻稻瘟病抗性变化及抗性基因克隆的研究进展. 福建农业学报, 2016, 31(5):545-552.LIU H T, XU Q, HE W, WEI L Y, ZHANG J F, XIE H A. Recent progress on the variation of blast resistance and cloning of the resistance genes in rice.Fujian Journal of Agricultural Sciences, 2016,31(5): 545-552. (in Chinese)
[25] 任世龙, 白辉, 王永芳, 全建章, 董志平, 李志勇, 邢继红. 谷瘟病菌无毒基因型鉴定及分析. 中国农业科学, 2018, 51(6): 1079-1088.REN S L, BAI H, WANG Y F, QUAN J Z, DONG Z P, LI Z Y, XING J H. Identification and analysis ofMagnaporthe oryzaeof foxtail millet avirulence genes.Scientia Agricultura Sinica, 2018, 51(6):1079-1088. (in Chinese)
[26] 袁熹, 李大勇, 宋凤鸣. 水稻对稻瘟病的广谱抗性: 分子机制及其育种应用. 植物生理学报, 2017, 53(8): 1348-1358.YUAN X, LI D Y, SONG F M. Broad-spectrum blast resistance in rice:Molecular mechanism and its breeding application.Plant Physiology Journal, 2017, 53(8): 1348-1358. (in Chinese)
[27] 于苗苗, 戴正元, 潘存红, 陈夕军, 余玲, 张晓祥, 李育红, 肖宁,龚红兵, 盛生兰, 潘学彪, 张洪熙, 李爱宏. 广谱稻瘟病抗性基因Pigm和Pi2的抗谱差异及与Pi1的互作效应. 作物学报, 2013,39(11): 1927-1934.YU M M, DAI Z Y, PAN C H, CHEN X J, YU L, ZHANG X X, LI Y H, XIAO N, GONG H B, SHENG S L, PAN X B, ZHANG H X, LI A H. Resistance spectrum difference between two broad-spectrum blast resistance genes,PigmandPi2, and their interaction effect onPi1.Acta Agronomica Sinica, 2013, 39(11): 1927-1934. (in Chinese)
[28] 梁毅, 杨婷婷, 谭令辞, 文婷, 吴俊, 江南, 李智强, 戴良英, 王国梁, 刘雄伦.水稻广谱抗瘟基因Pigm紧密连锁分子标记开发及其育种应用.杂交水稻, 2013, 28(4): 63-68.LIANG Y, YANG T T, TAN L C, WEN T, WU J, JIANG N, LI Z Q,DAI L Y, WANG G L, LIU X L. Development of the linked molecular marker for the broad-spectrum blast resistance genePigmin rice.Hybrid Rice, 2013, 28(4): 63-68. (in Chinese)
[29] ZHANG J, ZHOU X, YAN W, ZHANG Z, LU L, HAN Z, ZHAO H,LIU H, SONG P, HU Y, SHEN G, HE Q, GUO S, GAO G, WANG G,XING Y. Combinations of theGhd7,Ghd8andHd1genes largely define the ecogeographical adaptation and yield potential of cultivated rice.New Phytologist, 2015, 208(4): 1056-1066.
[30] LEE Y S, AN G. Regulation of flowering time in rice.Journal of Plant Biology, 2015, 58(6): 353-360.
[31] YE J, NIU X, YANG Y, WANG S, XU Q, YUAN X, YU H, WANG Y,WANG S, FENG Y, WEI X. DivergentHd1,Ghd7, andDTH7alleles control heading date and yield potential ofJaponicarice in northeast china.Frontiers in Plant Science, 2018, 9: 35.
[32] YANG J, WANG J, FAN F J, ZHU J Y, CHEN T, WANG C L,ZHENG T Q, ZHANG J, ZHONG W G, XU J L. Development of AS-PCR marker based on a key mutation confirmed by resequencing ofWx-mpin Milky Princess and its application injaponicasoft rice(Oryza sativaL.) breeding.Plant Breeding, 2013, 132(6): 595-603.
