不同红蓝配比的光质对棉花体细胞胚胎发生和植株再生的影响
2019-04-03魏喜王倩华葛晓阳陈艳丽丁颜朋赵明哲李付广
魏喜,王倩华,葛晓阳,陈艳丽,丁颜朋,赵明哲,李付广
(1沈阳农业大学农学院,沈阳 110866;2中国农业科学院棉花研究所/棉花生物学国家重点实验室,河南安阳 455000)
0 引言
【研究意义】棉花是全球最重要的油料作物和经济作物之一,其产量和纤维品质关系着国计民生[1]。世界上超过80多个国家种植棉花,中国是世界上最大的原棉生产国和消费国。但由于受到非生物胁迫、病虫害等不利因素的制约,严重影响棉花的产量和纤维品质[2]。因此,通过棉花基因工程导入相关基因,增强棉花抗逆性和抗病虫害,从而提高棉花产量和品质是必需的[3]。将转基因技术应用到棉花育种,弥补了传统育种方式周期长等不足[4]。然而体细胞胚胎发生是一个非常复杂的动态变化的过程,涉及到各种生物大分子的合成及运输、信号传导和能量变化等[5]。这种复杂性影响了体细胞胚胎发生因素的多样性,其中光照是影响体细胞胚胎发生的重要因素之一,对其生长和分化有重要影响[6]。体细胞胚胎发生基本上都是在日光灯下培养,然而随着科技的进步,不同发光颜色的LED灯应用到生产实践中,探究不同光质组合对体胚发生的影响,为提高棉花体胚发生能力和加快转基因进程奠定基础。然而针对环境可控棉花组织培养系统,红蓝光作为人工光源对体细胞胚胎发生的研究鲜有报道。【前人研究进展】研究表明,光合色素吸收红光和蓝光的能力比其他波长的能力强,红光影响茎的伸长、根冠比、叶绿素含量和光合作用[7-8],然而蓝光影响向光性、下胚轴伸长、叶片膨胀、气孔开放、酶合成、叶绿体运动和基因表达等[9-10]。虽然蓝光和红光有各自不同的功能,但是单独使用红光或蓝光不能满足植物生长发育的要求[11]。研究表明,与单色光相比,红蓝混合光能提高光合速率和茎的质量[12-13]。红蓝光作为人工光源的研究大多集中于不同光强和光质对植物生长和品质的影响:闻婧等[14]研究表明,红蓝配比为B﹕R=1﹕8的LED光源明显提高莴苣光合速率和品质以及降低耗电量;王君等[15]发现红蓝配比为 B﹕R=1﹕1,光强为 300 μmol·m-2·s-1处理组合提高生菜的光能、电能利用效率及干重累积量;合理光质组合和光照强度可促进烤烟幼苗根系与叶片的生长[16]。棉花体细胞胚胎发生和植株再生的过程包括愈伤诱导、胚性愈伤诱导、体细胞胚诱导和植株再生,其中,胚性愈伤分化阶段是非常重要的阶段,胚性愈伤分化的时间和状态,以及环境因素都可以影响这一过程。目前,棉花体细胞胚胎发生的研究主要集中在寻求合适的棉花组织培养体系,以及挖掘调控棉花体细胞胚胎发生能力的关键基因。例如,董合忠等[17]研究发现2,4-D和KT同时添加对愈伤诱导的效果明显高于单独添加激素的效果;于娅等[18]研究发现,激素由高到低的继代可明显提高胚性愈伤分化率,IAA/KT比例为1﹕1—1﹕6,胚性愈伤分化率最高为50.22%。ZHENG等[3]研究认为高分化率材料生长素运输基因PIN7和信号转导通路基因SHY2表达量比难分化或不分化的材料表达量要高。YANG等[19]研究发现棉花体细胞胚胎发生过程中生长素合成、运输、代谢、信号应答等相关基因表达均有不同程度的变化,进一步证实了棉花体细胞胚胎发生这一复杂性。XIAO等[20]在拟南芥中过表达棉花GhWUSs,结果发现过表达GhWUSs明显促进拟南芥芽再生能力,并且LEC1、FUS3、ABI3和CLV3的表达量明显上升。GE等[21]利用iTRAQ技术分离鉴定与棉花体细胞胚发育相关的关键通路,发现压力响应、激素合成和信号转导、糖和能量代谢、蛋白代谢、细胞壁代谢、细胞转运和脂类物质转运等通路在调控棉花体细胞胚发育方面发挥着重要的作用。【本研究切入点】目前,有关棉花体细胞胚胎发生的研究大多集中在寻找合理培养基配方和关键功能基因的挖掘,不同光质配比对棉花体细胞胚胎发生过程影响的研究很少,特别是不同红蓝配比的光质对棉花体细胞胚胎发生的影响更少。【拟解决的关键问题】本研究分别设置不同红蓝配比为 B﹕R=1﹕1、B﹕R=3﹕1、B﹕R= 1﹕3和DL的光质组合,探索其对棉花体细胞胚胎发生各个阶段的影响,为提高棉花体细胞胚胎发生能力和构建大量快速的获得棉花再生植株的工厂化生产实践体系奠定基础。
1 材料与方法
1.1 植物材料和生长条件
选用的棉花外植体材料是CCRI12,由中国农业科学院棉花研究所提供,试验于2016—2018年依托中棉所转基因课题组棉花规模化转基因技术平台开展。光源为光强和光质可精确调控的红蓝LED人工光源。
将难分化材料 CCRI12种子播种于中棉所试验田,收获时挑选成熟度良好的棉花种子,将 CCRI12种子消过毒后放在无菌苗培养基上[3],其中,基本培养基为MS和B5,这里简称MSB培养基[22],为了方便使用,首先将其配成母液 MSB培养基(大量元素MSⅠ:50 mL·L-1、微量元素 MSⅡ:5 mL·L-1、B5 维生素:5 mL·L-1和铁盐:5 mL·L-1),固体培养基每升再加5.5 g琼脂粉,121℃,灭菌14 min。在MSB基础培养基上配置一系列的培养基:无菌苗培养基(大量元素MSⅠ 50 mL、蔗糖28 g、琼脂粉5.5 g,用超纯水充分溶解后定容到1 L,pH自然)。棉花体细胞胚胎发生一般要经历4个过程:愈伤组织诱导培养基、胚性愈伤分化培养基、体细胞胚诱导培养基和再生苗培养基,分别简称为CIM、ECDM、EIM和RIM,4种培养基的主要成分如表1。
适宜的培养条件是成功获得再生棉花苗的必备条件。将配制好的培养基分装到100 mL三角瓶中,每瓶50 mL,高温高压灭菌后,将无菌苗CCRI12下胚轴切成数个长度为5—7 mm的大小。所有培养物均置于(28±2)℃。
1.2 试验设计
设置的不同红蓝配比光质分别是B﹕R=1﹕1、B﹕R=3﹕1、B﹕R=1﹕3和DL 4种组合,其中 B﹕R=1﹕1、B﹕R=3﹕1和B﹕R=1﹕3是不同的红蓝配比,DL光质处理是白光处理。红蓝光的波峰分别为 660和 460 nm。DL光质处理的光强设置在 30—50 μmol·m-2s-1。采用不同红蓝配比的LED光源,其设置依据是不同蓝红配比光源对植物的干重和鲜重[23],以及叶片的光合速率[24]产生不同的影响。每个处理分别设置3个重复。
1.3 仪器和测量方法
采用频谱分析仪(HR-350,台湾,高雄)测量光谱分布,LED光源板(XM-LEDX12T8D,中国,江苏,南京)上的红蓝光光强大小是通过调节供电电流和电灯泡的数量来确定的。
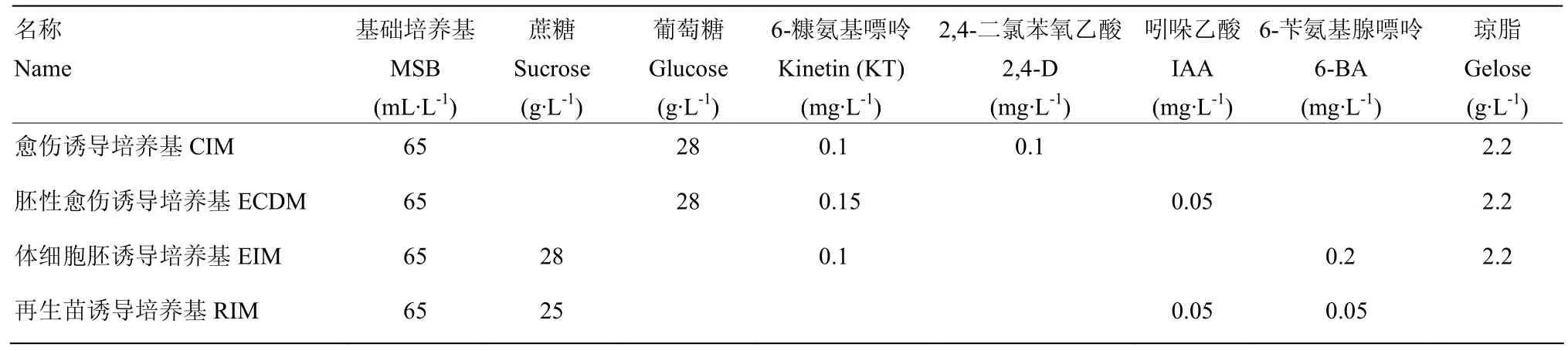
表1 棉花体细胞胚胎发生阶段各培养基成分Table 1 Compositions of culture medium at somatic embryogenesis stage of cotton
CPR = (W2-W1)/W1,其中,W1为外植体培养前的初始重量;W2为外植体培养一段时间后的重量;CPR(callus proliferation rate):指的是愈伤增殖率,即单位时间内外植体重量变化量除以外植体初始重量。
愈伤增殖量是指培养一段时间后愈伤增加的重量;胚性愈伤分化率是指由愈伤组织经过再分化成胚性愈伤组织的愈伤数量与再分化前愈伤块总数量的比值;体细胞胚数量是指胚性愈伤组织发育成不同状态的体细胞胚的总数,包括球形胚、心形胚、鱼雷胚和子叶胚等;生根率是指发育有根的下胚轴数量与下胚轴总数的比值。
叶绿素含量的测定:称取样品0.1—0.2 g(鲜重,FW),用8 mL 80%的丙酮作为提取液,4℃,黑暗条件下放置24 h,充分混匀,直到叶片褪色至白色为之。将混合物充分离心后采用分光光度计 UV-2550(Shimadzu, Kyoto, Japan)测定 646.6、663.6 和 450 nm的吸光度,根据吸光度的值计算叶绿素的浓度。叶绿素浓度的计算方法与前人研究一致[25]。
1.4 数据处理
采用Origin 8.5、SSPS20.0等软件进行数据处理和分析。采用最小显著差数法(the least significant difference,LSD)进行显著性检验(P<0.05)。
2 结果
2.1 棉花体细胞胚胎发生过程
在棉花组织培养过程中,棉花下胚轴被认为是作为棉花体细胞胚胎发生的理想外植体。不同光质处理棉花体细胞胚胎发生一般要经历4个阶段(图1-A)。分别为愈伤诱导阶段诱导出愈伤(callus formation)、胚性愈伤诱导阶段诱导出胚性愈伤组织(embryogenic callus,ECs)、体细胞胚阶段诱导出体细胞胚(somatic embryos maturation,SEs)和再生棉花苗阶段。7 d苗龄大小的CCRI12棉花下胚轴作为外植体,将下胚轴用无菌刀片切成 5—7 mm(图1-B),混合均匀后放在愈伤诱导培养基上诱导愈伤的形成,随着诱导天数的增加,愈伤的状态由早期愈伤(图 1-C)逐渐转变为后期愈伤状态(图 1-D),后期愈伤状态蓬松,含水量丰富。将愈伤转移到胚性愈伤组织分化培养基诱导胚性愈伤(ECs)的形成。培养一段时间后,会诱导出大量的 ECs(图 1-E)。接着将胚性愈伤转移到体细胞胚诱导培养基,诱导体细胞胚(SEs)的形成,根据体细胞胚发育状态的不同,将体细胞胚分为球形胚(图 1-F)、心形胚(图 1-G)、鱼雷胚(图1-H)和子叶胚(图1-I)。最后将这些体细胞胚再转移到再生植株诱导培养基上,继续培养,直到获得再生棉花植株(图1-J)。
2.2 不同光质组合影响愈伤的增殖
不同的光质组合对棉花愈伤组织的增殖有不同的影响。CPR这个参数被用来衡量愈伤的增殖情况。CCRI12下胚轴在CIM上培养30 d后(图2-A),B﹕R=1﹕1、B﹕R=3﹕1、B﹕R=1﹕3和DL 4种光组合诱导出的愈伤在颜色和质地上没有差异,但是愈伤块的大小有明显的差异,B﹕R=1﹕3处理后的愈伤块是最小的,B﹕R=1﹕1和 B﹕R=3﹕1处理后的愈伤块比较大。根据这种愈伤状态,分别统计4种光处理的愈伤增殖率(图2-B),发现B﹕R=1﹕1处理的CPR最大,显著高于B﹕R=3﹕1处理,极显著高于B﹕R=1﹕3和DL处理。B﹕R=3﹕1处理的CPR显著高于B﹕R=1﹕3和DL处理,B﹕R=1﹕3和DL光处理之间的 CPR不显著。综上说明 B﹕R=1﹕1和B﹕R=3﹕1光质组合促进愈伤的增殖,B﹕R=1﹕3处理对愈伤增殖贡献较小;不同光质组合在愈伤后期对愈伤的颜色和质地有显著影响。
2.3 不同光质组合对胚性愈伤阶段的影响
2.3.1 不同光质组合在胚性愈伤诱导阶段对未分化愈伤的影响 愈伤诱导阶段主要是诱导外植体的体细胞脱分化形成大量能再分化为胚性愈伤的细胞团。图3-A为不同光质组合在CIM上培养30 d后的愈伤转移到ECDM上继续培养45 d后的表型。B﹕R=1﹕1、B﹕R=3﹕1、B﹕R=1﹕3和 DL 4种光组合中,B﹕R=1﹕1、B﹕R=3﹕1和DL处理后未分化愈伤块的体积都明显大于B﹕R=1﹕3处理后的未分化愈伤块的体积。为了明确不同光质组合对未分化愈伤的影响,在ECDM上培养45 d后,统计未分化愈伤的增殖量(图 3-B)。B﹕R=1﹕1、B﹕R=3﹕1和 DL处理的光质组合的愈伤增殖量分别是 7.85、6.51和4.08 g,但是B﹕R=1﹕3处理的光质组合的愈伤增殖量只有 1.06 g。与 B﹕R=1﹕1和 B﹕R=3﹕1处理相比,B﹕R=1﹕3光质组合处理的未分化愈伤增殖量差异显著,但是与DL处理光质组合的愈伤增殖量相比差异不显著。因此,B﹕R=1﹕1和 B﹕R=3﹕1处理在胚性愈伤诱导阶段促进未分化愈伤的大量增殖,而B﹕R=1﹕3光质组合处理对未分化愈伤增殖的贡献较小。

图1 棉花体细胞胚胎发生过程Fig. 1 Cotton somatic embryogenesis
2.3.2 不同光质组合对棉花胚性愈伤组织诱导的影响 在不同光质组合诱导胚性愈伤阶段,除了上述增殖不分化的愈伤外,另一部分愈伤分化为胚性愈伤。图4-A是在胚性愈伤诱导阶段培养45 d时的状态,其中B﹕R=1﹕1和B﹕R=3﹕1处理的愈伤表现出大量增殖的表型,只有部分愈伤分化为胚性愈伤(ECs),胚性愈伤分化率分别是0.25和0.16。B﹕R=1﹕3处理和DL处理的光质组合能诱导大量胚性愈伤(图 4-A红色椭圆),胚性愈伤分化率分别是0.70和0.56。B﹕R=1﹕3处理的光质组合的胚性愈伤分化率极显著高于B﹕R=1﹕1和B﹕R=3﹕1处理的光质组合,显著高于DL处理。综上所述,与白光处理相比,B﹕R=1﹕3处理的光质组合显著促进愈伤分化成胚性愈伤,而B﹕R=1﹕1和B﹕R=3﹕1处理的光质组合抑制胚性愈伤组织的形成。
2.4 不同光质组合对棉花体细胞胚诱导阶段的影响
2.4.1 不同光质组合对棉花体细胞胚数量的影响B﹕R=1﹕1、B﹕R=3﹕1、B﹕R=1﹕3和 DL光质组合都能诱导出胚性愈伤,将黄绿色、颗粒状的胚性愈伤组织放置在体细胞胚诱导培养基上进一步诱导,胚性愈伤的颜色逐渐变绿,首先发育成原胚然后依次发育成球形胚、心形胚、鱼雷胚和子叶胚。每个处理各选50瓶,每隔一个月继代一次,直到体细胞胚的出现。图5-A为不同光质组合下诱导出的体细胞胚,统计球形胚,、心形胚、鱼雷胚和子叶胚总数量(图5-B)。3次重复的试验结果表明,B﹕R=1﹕3处理组合的体细胞胚总数显著高于B﹕R=1﹕1和B﹕R=3﹕1处理组合诱导体细胞胚的数量。虽然B﹕R=1﹕3处理组合的体细胞胚总数与 DL处理的体细胞胚总数相比差异不显著,但是B﹕R=1﹕3处理组合的体细胞胚总数也比DL处理的体细胞胚总数多出50个。综上所述,B﹕R=1﹕3处理组合对体细胞胚诱导具有促进作用,B﹕R=1﹕1和 B﹕R=3﹕1处理对体细胞胚诱导有抑制作用。
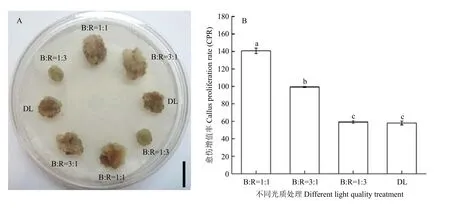
图2 不同光质处理对CPR的影响Fig. 2 Effect of different light quality treatments on CPR

图3 不同光质处理对未分化愈伤的影响Fig. 3 Effects of different light quality treatments on undifferentiated callus

图4 不同光质处理对棉花胚性愈伤组织诱导的影响Fig. 4 Effects of different light quality treatments on embryogenic callus induction in cotton
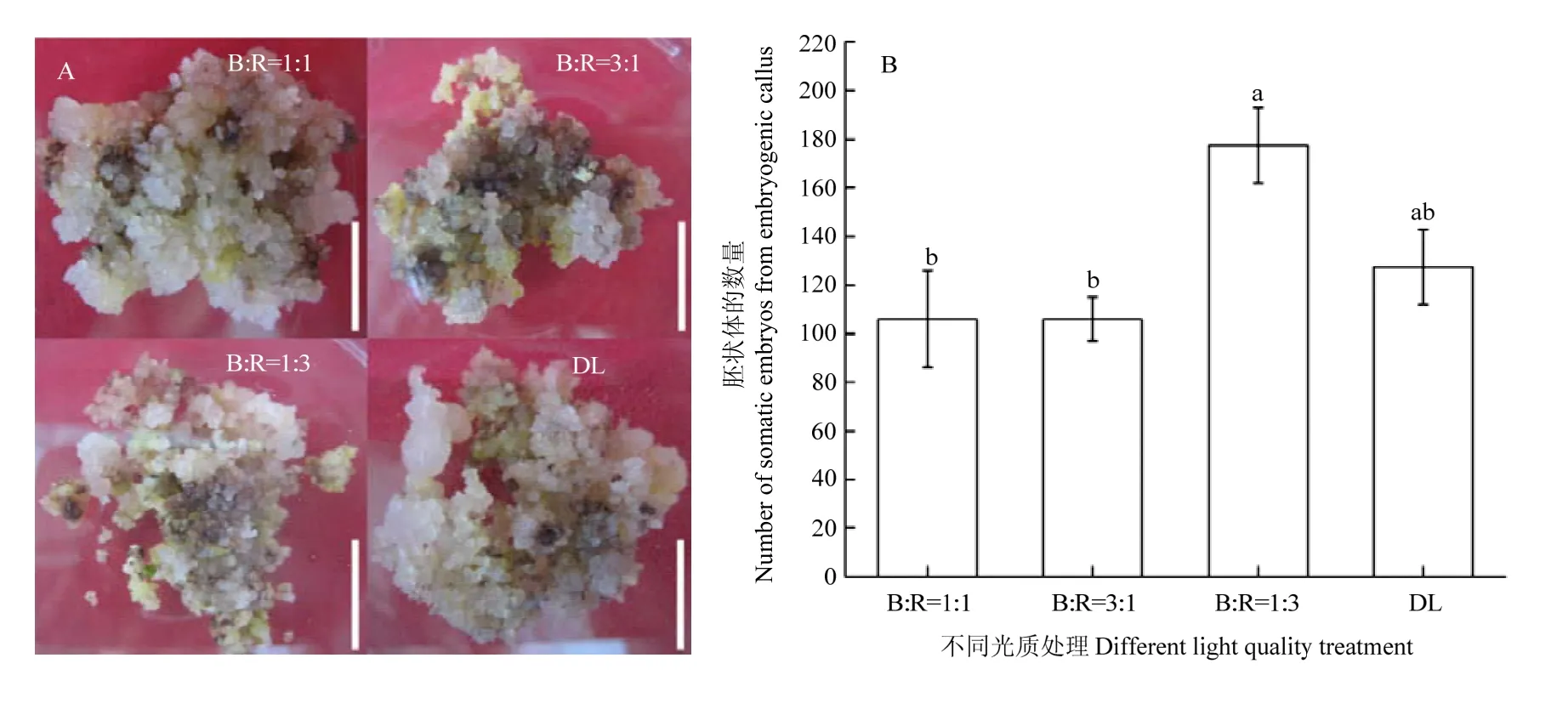
图5 不同光质处理对棉花体细胞胚诱导阶段的影响Fig. 5 Effects of different light quality treatments on the induction stage of cotton embryoids
2.4.2 不同光质组合对棉花体细胞胚形成下胚轴的影响 在体细胞胚诱导培养基上继代培养1—2次后,将体细胞胚转移到再生植株诱导培养基上培养直到长出棉花再生苗。分别在不同光质组合处理B﹕R=1﹕1、B﹕R=3﹕1、B﹕R=1﹕3和DL下继续培养,当培养15 d后体细胞胚就诱导出下胚轴(图6-A)。图6-B中可以看出B﹕R=1﹕3和DL的光质组合下诱导出下胚轴的数量明显多于B﹕R=1﹕1和B﹕R=3﹕1光质组合诱导出的下胚轴数量。B﹕R=1﹕3和DL光质组合处理之间的下胚轴数量没有显著差异,同样的B﹕R=1﹕1和B﹕R=3﹕1光质组合处理之间下胚轴的数量没有显著差异。总之,B﹕R=1﹕1和 B﹕R=3﹕1处理不利于体细胞胚形成下胚轴,而 B﹕R=1﹕3和DL的光质组合处理促进体细胞胚形成下胚轴。
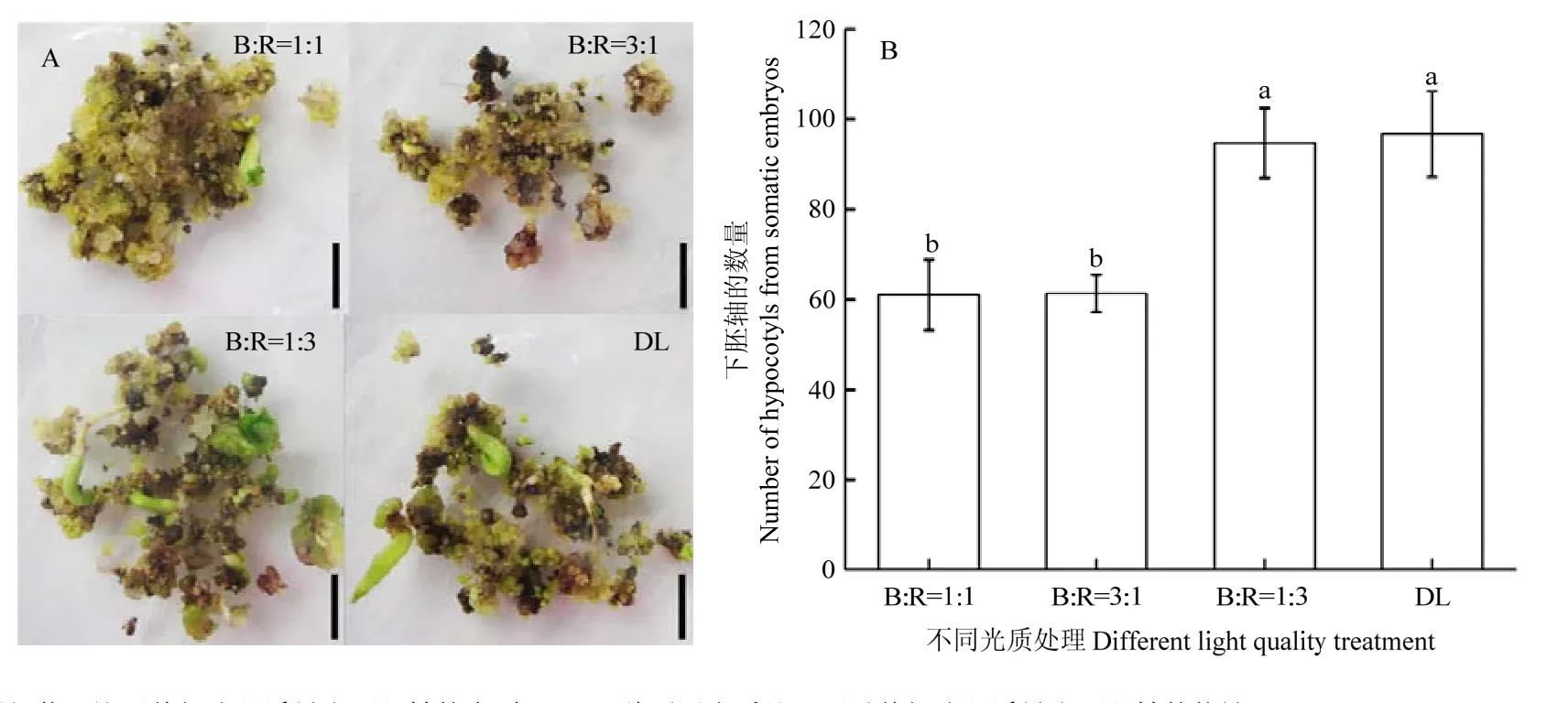
图6 不同光质处理对棉花体细胞胚长下胚轴的影响Fig. 6 Effects of different light quality treatments on the number of hypocotyls from SEs
2.5 不同光质组合对棉花再生苗诱导阶段的影响
2.5.1 不同光质组合对下胚轴生根的影响 将下胚轴在再生植株诱导培养基上继代1次后诱导不定根的发生(图 7-A),B﹕R=1﹕1、B﹕R=3﹕1、B﹕R=1﹕3和DL都能诱导出大量不定根。且4种不同光质组合对下胚轴长根的影响有明显差异(图7-B),B﹕R=1﹕1处理的下胚轴生根率明显高于B﹕R=3﹕1、B﹕R=1﹕3和DL不同光质组合处理,且差异显著;而B﹕R=3﹕1、B﹕R=1﹕3和DL处理之间的下胚轴生根率差异不显著。
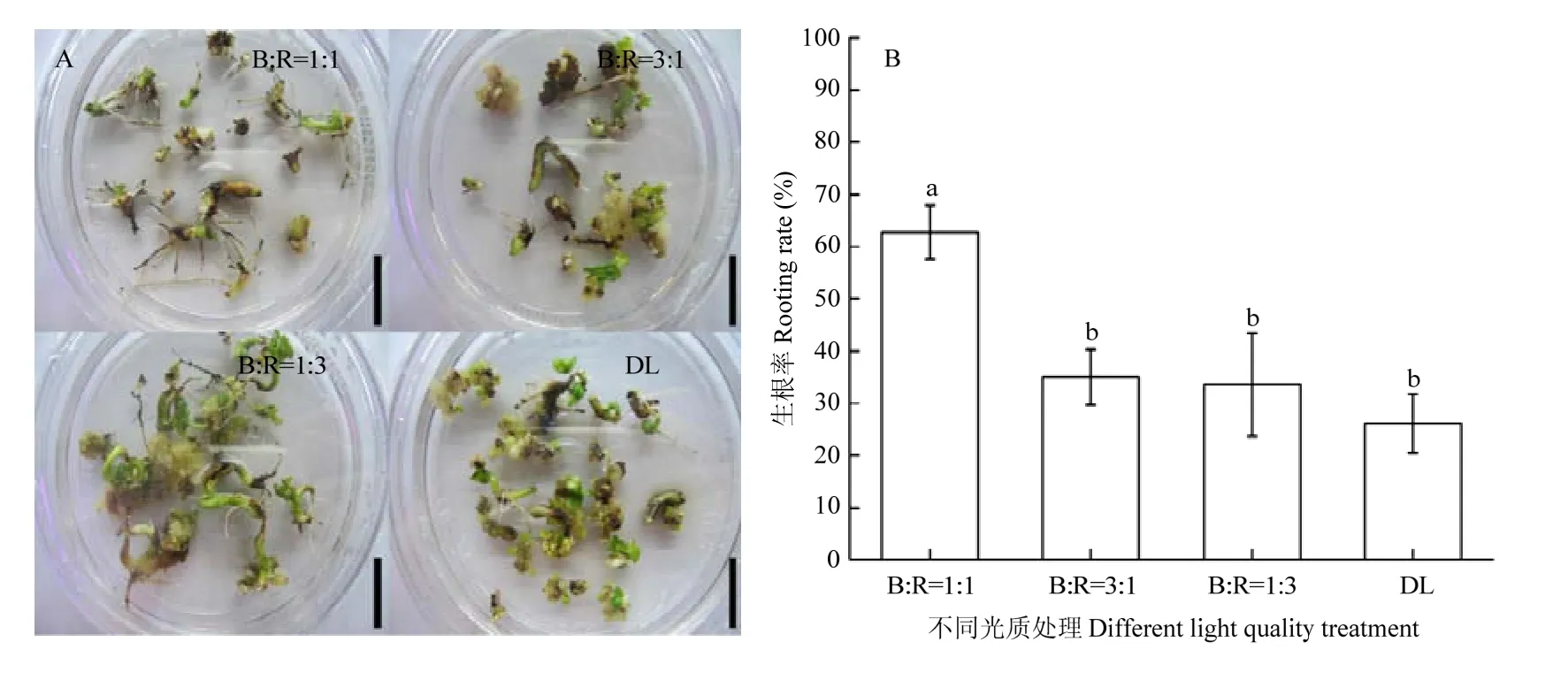
图7 不同光质处理对棉花下胚轴生根的影响Fig. 7 Effects of different light quality treatments on rooting of cotton hypocotyls
2.5.2 不同光质组合对棉花再生苗和植株高度的影响 图 8-A是不同光质组合处理下棉花再生苗的表型,在B﹕R=1﹕1和B﹕R=1﹕3不同光质组合处理的再生棉花苗植株高大,B﹕R=3﹕1和DL不同光质组合处理的棉花植株矮小。经统计成苗数量(图8-B),B﹕R=1﹕3光质组合下成苗数量明显高于B﹕R=3﹕1和DL处理下成苗数,且差异显著;B﹕R=1﹕3光质组合成苗数与B﹕R=1﹕1光质组合下的成苗数差异不显著。B﹕R=1﹕1光质组合诱导的成苗数量显著高于B﹕R=3﹕1处理后诱导的成苗数量,但是与DL光质处理诱导的成苗数量相比差异不显著。B﹕R=3﹕1光质组合处理与DL光质处理相比,对再生苗的诱导数量差异不显著。统计不同光质配比下棉花植株高度(图8-C),B﹕R=1﹕1和B﹕R=1﹕3光质组合下棉花植株的高度分别是14.58和13.93 cm,显著高于B﹕R=3﹕1与 DL,但二者之间差异不显著。B﹕R=3﹕1与DL光质配比下棉花植株高度分别是5.53和 5.95 cm,差异不显著。综上,B﹕R=1﹕1和 B﹕R=1﹕3的光质组合促进再生苗的产生和发育。

图8 不同光质组合对棉花再生苗和植株高度的影响Fig. 8 Effects of different light qualities on cotton seedling regeneration and plant height
2.5.3 不同光质组合对棉花再生苗叶绿素浓度的影响 图9-A是在不同光质组合处理下,棉花再生苗的叶片的表型,B﹕R=1﹕1和 B﹕R=1﹕3不同光质处理下,棉花叶片深绿,但是B﹕R=1﹕1和B﹕R=3﹕1不同光质处理下,棉花叶片嫩绿;整体上 B﹕R=1﹕3不同光质处理下棉花叶片体积大,颜色深。通过对诱导的棉花再生苗进行叶绿素含量的测定(图9-B)。B﹕R=1﹕3的光质组合下叶绿素浓度最高,与B﹕R=1﹕1光质组合相比,差异不显著,但是与B﹕R=3﹕1的光质组合处理相比,差异显著;与 DL光质组合相比,差异显著。综上,与DL光质处理相比,B﹕R=1﹕1、B﹕R=3﹕1和B﹕R=1﹕3处理组合都有利于叶绿素的合成,但是B﹕R=1﹕3处理组合促进叶绿素的合成效果最明显。

图9 不同光质组合对棉花再生苗叶绿素浓度的影响Fig. 9 Effects of different light qualities on chlorophyll concentration of cotton regenerated seedlings
3 讨论
体细胞胚胎的发生方式为直接发生和间接发生 2种途径。一些报道[26]认为陆地棉体细胞胚胎发生大多是通过间接发生途径完成,然而也有研究表明陆地棉的植株再生有可能通过体细胞胚胎直接发生,但是成功的概率非常[27-28]。下胚轴是作为体细胞胚胎发生的理想外植体,体细胞胚发生中愈伤起始的组织位置可能不完全一致,既有近表层愈伤组织内部的报道,也有内外同时起源的报道,可能与培养方式有关[29]。
3.1 不同红蓝配比的光质对愈伤组织形成和分化的影响
愈伤组织是由棉花下胚轴外植体经过脱分化形成的一类细胞团。B﹕R=1﹕1和 B﹕R=3﹕1红蓝光配比下愈伤表现出大量增殖的状态,但愈伤分化成胚性愈伤严重受阻;而B﹕R=1﹕3下愈伤增殖率最低,显著抑制愈伤的增殖,但胚性愈伤的分化率显著提高。B﹕R=1﹕1和 B﹕R=3﹕1光质组合的愈伤大量增殖而难分化,B﹕R=1﹕3光质组合表现出愈伤增殖较小,容易分化成胚性愈伤,说明愈伤适度增殖有利于分化成胚性愈伤,这与 XU[30]的研究一致。棉花通过体细胞胚胎发生获得再生棉花是一个非常困难的过程,周期长而且分化率非常低,基因型限制严重。大部分棉花品种都只能形成愈伤,不能分化成胚性愈伤,因此胚性愈伤的诱导在棉花体细胞胚胎发生过程中起着重要的作用。B﹕R=1﹕1和 B﹕R=3﹕1光质组合表现出大量增殖而难分化,B﹕R=1﹕3和DL的光质组合愈伤增殖率小而分化率比较高,说明不同光质组合对愈伤细胞多能性获得及分化成胚性愈伤的能力的影响不同,这与 ARACELI等[31]结论一致。从体细胞脱分化成愈伤组织,再分化成胚性愈伤组织的过程,使这些细胞转变成具有发育成体细胞胚潜力的细胞团,其间涉及到细胞生理变化、新陈代谢和基因的表达等[32]。NHUT等[33]研究表明 B﹕R=2﹕3的光质组合对油茶体细胞胚发生有利,促进油茶植物的再生;而D"ONOFRIO等[6]研究表明柑橘在红光条件下体细胞胚胎发生能力是最高的,在红蓝混合光和正常日光灯条件下体细胞胚胎发生能力是降低的。以上结果表明,不同植物对光的响应是不同的,导致不同光质组合对体细胞胚胎发生的调控能力有很大差异。
3.2 不同红蓝配比的光质对体细胞胚发育的影响
在胚性愈伤发育成体细胞胚的过程中,各种生理和化学因素发挥着重要的作用,包括光质、激素等。B﹕R=1﹕3光质组合能明显促进体细胞数量的增加,而B﹕R=1﹕1和B﹕R=3﹕1光质组合对诱导体细胞的产生有一定的抑制作用,导致体细胞数量的降低。B﹕R=1﹕3的光质组合可能精确调控了细胞内生长素、细胞分裂素、脱落酸和茉莉酸的变化,这些激素的变化诱导体细胞胚胎发生的Marker基因的表达,进而调控体细胞胚的发育。相似的研究指出,LEC1、LEC2、FUS3通过调控赤霉素和脱落酸的动态平衡来诱导和维持体细胞胚的发育[21]。HERINGER等[34]利用甘蔗的芽尖分生组织作为外植体研究不同红蓝光质组合对体细胞胚胎发生的影响,发现低比例的蓝光抑制甘蔗植株的转化,而蓝光和红光以及远红光相结合有利于叶片和根的伸长,增加叶片数和叶绿素的含量,对不同红蓝光质组合下甘蔗体细胞胚胎发生的蛋白组学分析发现,生长素、PIN的运输蛋白和DNA甲基化伴随着甘蔗的体细胞胚胎发生。
3.3 不同红蓝配比的光质对下胚轴的影响
B﹕R=1﹕1和 B﹕R=3﹕1光质组合下体细胞胚诱导出下胚轴的数量明显低于B﹕R=1﹕3和DL的处理组合;B﹕R=1﹕1和 B﹕R=1﹕3处理组合下诱导出的再生棉花的高度显著高于 B﹕R=3﹕1和 DL组合。再生棉花植株的数量很大程上取决于诱导出下胚轴的数量和质量。研究表明,蓝光激活油菜素内酯(BR)和赤霉素(GA)信号通路,进而诱导HBI1表达促进下胚轴伸长[35]。不同红蓝配比的光照下CRY的差异表达调控了HBI1的差异表达,影响体细胞胚下胚轴的发育。XU[36]研究表明在红光、蓝光、白光、远红光条件下,BBX21的差异表达直接影响拟南芥下胚轴的长度。B﹕R=1﹕1处理后生根率明显高于B﹕R=1﹕3、B﹕R=3﹕1和DL光质组合,可能的原因是B﹕R=1﹕1组合引起侧根发育相关的基因WOX5、WOX7、WOX11和WOX12的过量表达[37]。
3.4 不同红蓝配比的光质对叶绿素浓度的影响
B﹕R=1﹕3、B﹕R=3﹕1和 B﹕R=1﹕1处理后叶绿素浓度明显高于DL组合。研究表明LED 2种波峰和R/B对叶用莴苣叶绿素含量影响不同[38]。LEDA型(波峰为660 nm的红光LED与450 nm的蓝光LED组成)光源处理的叶绿素a、b和(a+b)含量显著高于LEDB型光源(波峰为630 nm的红光LED与460 nm的蓝光LED组成)处理[14]。YE等[39]研究表明蓝光增加金线莲叶绿素的含量与蓝光和红光以及CK相比。不同植物对不同红蓝配比光质的响应能力不同,组织培养过程中使用的红蓝光的光强度和红蓝光质配比不一致,这些因素可能导致了不同植物在红蓝光处理下的光合作用的能力不同,最终导致叶绿素含量不同。
4 结论
在棉花体细胞胚胎发生过程中,不同发育阶段对光的响应能力有差异,愈伤增殖阶段对蓝光的响应最敏感,但过度的愈伤增殖不利于胚性愈伤的产生;胚性愈伤、体细胞胚诱导和苗再生阶段对红光响应最敏感。采用B﹕R=1﹕3的光质组合有利于棉花体细胞胚胎的发生。
[1] ZHANG G Y, LIU L F, ZHI-YING M A. Study on heterosis utilization of insect-resistant transgenic Bt (Bacillus thuringiensis) cotton.Acta Gossypii Sinica,2001.
[2] SINGH D P, SINGH I P, TYAGI A P. Association analysis for yeild components in upland cotton.Madras Agricultural Journal,1981.
[3] ZHENG W, ZHANG X Y, YANG Z R, WU J, LI F L,DUAN L L, LIU C L, LU L L, ZHANG C J, LI F G. At wuschel promotes formation of the embryogenic callus inGossypium hirsutum.PLoS ONE,2014,9(1): e87502.
[4] 张天真. 棉花纤维品质分子育种的现状及展望. 棉花学报, 2000,12(6): 321-326.ZHANG T Z. Current status and prospects of molecular breeding of cotton fiber quality.Cotton Science, 2000, 12(6): 321-326. (in Chinese)
[5] ARNOLD S V, SABALA I, BOZHKOV P, DYACHOK J,FILONOVA L. Developmental pathways of somatic embryogenesis.Plant Cell Tissue & Organ Culture,2002, 69(3): 233-249.
[6] D"ONOFRIO C, MORINI S, BELLOCCHI G. Effect of light quality on somatic embryogenesis of quince leaves.Plant Cell Tissue and Organ Culture, 1998, 53(2): 91-98.
[7] APPELGREN, MAIGULL. Effects of light quality on stem elongation ofPelargonium in vitro.Scientia Horticulturae (Amsterdam),1991,45(3): 345-351.
[8] ARNE S, KREKLING T, APPELGREN M. Light quality affects photosynthesis and leaf anatomy of birch plantletsin vitro.Plant Cell Tissue & Organ Culture,1995, 41(2): 177-185.
[9] SHIN-ICHIRO I, TOSHINORI K, MASAKI M, NAKAYAMA K I,MICHIO D, KEN-ICHIRO S. Blue light-induced autophosphorylation of phototropin is a primary step for signaling.Proceedings of the National Academy of Sciences of the United States of America, 2008,105(14): 5626-5631.
[10] WANG H, GU M, CUI J X, SHI K, ZHOU Y H, YU J Q. Effects of light quality on CO2assimilation, chlorophyll-fluorescence quenching,expression of Calvin cycle genes and carbohydrate accumulation inCucumis sativus.Journal of Photochemistry & Photobiology B Biology,2009, 96(1): 30-37.
[11] WANG X Y, XU X M, CUI J. The importance of blue light for leaf area expansion, development of photosynthetic apparatus, and chloroplast ultrastructure of Cucumis sativus grown under weak light.Photosynthetica,2015, 53(2): 213-222.
[12] LI H, TANG C, XU Z. The effects of different light qualities on rapeseed (Brassica napusL.) plantlet growth and morphogenesisin vitro.Scientia Horticulturae,2013, 150(2): 117-124.
[13] HERNANDEZ R, KUBOTA C. Physiological responses of cucumber seedlings under different blue and red photon flux ratios using LEDs.Environmental & Experimental Botany,2016, 121(1): 66-74.
[14] 闻靖, 杨其长, 魏灵玲, 程瑞锋, 刘文科, 鲍顺淑, 周晚来. 不同红蓝 LED组合光源对叶用莴苣光合特性和品质的影响及节能评价.园艺学报,2011, 38(4): 761-769.WEN J, YANG Q C, WEI L L, CHENG R F, LIU W K, BAO S S,ZHOU W L. Effect of different red and blue LED combined light sources on photosynthetic characteristics and quality of leaf lettuce and energy saving evaluation.Acta Horticulturae Sinica, 2011, 38(4):761-769. (in Chinese)
[15] 王君, 杨其长, 仝宇欣. 红蓝光下光强对生菜电能、光能利用效率及品质的影响. 中国农业大学学报, 2016, 21(8): 59-66.WANG J, YANG Q C, TONG Y X. The effect of light intensity under red and blue light on the energy, light energy utilization efficiency and quality of lettuce.Journal of China Agricultural University, 2016,21(8): 59-66. (in Chinese)
[16] 肖春生, 陈颐, 钟越峰, 杨虹琦, 何命军, 李帆, 裴晓东. 不同比例红蓝光对烟苗生长及碳氮代谢的影响. 中国农学通报, 2013(22):160-166.XIAO C S, CHEN Y, ZHONG Y F, YANG H Q, HE M J, LI F, PEI X D. Effects of different ratios of red and blue light on growth and carbon and nitrogen metabolism of tobacco seedlings.Chinese Agricultural Science Bulletin, 2013(22): 160-166. (in Chinese)
[17] 董合忠, 焦改丽, 陈志贤. 2,4-D、KT对棉花愈伤组织的诱导和体细胞胚胎发生的影响. 华北农学报, 1993, 8(3): 87-91.DONG H Z, JIAO G L, CHEN Z X. The effect of 2,4-D and KT on callus initiation and somatic embryogenesis in cotton culture.Acta Agriculturae Boreali-Sinica, 1993, 8(3): 87-91. (in Chinese)
[18] 于娅, 刘传亮, 马峙英, 李付广, 李凤莲, 王玉芬, 武芝霞, 张朝军.陆地棉中棉所24胚性愈伤组织的诱导及植株再生. 西北植物学报,2004, 24(2): 306-310.YU Y, LIU C L, MA Z Y, LI F G, LI F L, WANG Y F, WU Z X,ZHANG C J. Induction and plant regeneration of embryogenic callus from upland cotton CCRI24.Acta Botanica Boreali-Occidentalia Sinica, 2004, 24(2): 306-310. (in Chinese)
[19] YANG X Y, ZHANG X L, YUAN D J, JIN F Y, ZHANG Y C, XU J.Transcript profiling reveals complex auxin signalling pathway and transcription regulation involved in dedifferentiation and redifferentiation during somatic embryogenesis in cotton.BMC Plant Biology,2012,12(1): 110.
[20] XIAO Y Q, CHEN Y L, DING Y P, WU J, WANG P, YU Y, WEI X,WANG Y, ZHANG C J, LI F G, GE X Y. Effects of GhWUS from upland cotton (Gossypium hirsutumL.) on somatic embryogenesis and shoot regeneration.Plant Science,2018, 270: 157-165.
[21] GE X Y, ZHANG C J, WANG Q H, YANG Z R, WANG Y, ZHANG X Y, WU Z X, HOU Y X, WU J H, LI F G. iTRAQ protein profile differential analysis between somatic globular and cotyledonary embryos reveals stress, hormone, and respiration involved in increasing plantlet regeneration ofGossypium hirsutumL..Journal of Proteome Research,2015, 14(1): 268-278.
[22] 张朝军. 棉花叶柄高效再生体系的建立与遗传分析[D]. 北京: 中国农业科学院, 2008.ZHANG C J. Establishment and genetic analysis of efficient regeneration system of cotton petiole[D]. Beijing: Chinese Academy of Agricultural Sciences, 2008. (in Chinese)
[23] KIM S J, HAHN E J, HEO J W, PAEK K Y. Effects of LEDs on net photosynthetic rate, growth and leaf stomata of chrysanthemum plantletsin vitro.Scientia Horticulturae, 2004, 101(1): 143-151.
[24] LEE S H, TEWARI R K, HAHN E J, PAEK K Y. Photon flux density and light quality induce changes in growth, stomatal development,photosynthesis and transpiration ofWithania somnifera(L.) Dunal.plantlets.Plant Cell Tissue & Organ Culture, 2007, 90(2): 141-151.
[25] PORRA R J, THOMPSON W A, KRIEDEMANN P E. Determination of accurate extinction coefficients and simultaneous equations for assaying chlorophylls a and b extracted with four different solvents:verification of the concentration of chlorophyll standards by atomic absorption spectroscopy.Biochimbiophysacta,1989, 975(3): 384-394.
[26] 李克勤, 王哲之. 陆地棉组织细胞培养的研究. 西北植物学报,1991(2): 144-153.LI K Q, WANG Z Z. Study on cell culture of upland cotton tissue.Acta Botanica Boreali-Occidentalia Sinica, 1991(2): 144-153. (in Chinese)
[27] NOBRE J, KEITH D J, DUNWELL J M. Morphogenesis and regeneration from stomatal guard cell complexes of cotton (Gossypium hirsutumL.).Plant Cell Reports,2001, 20(1): 8-15.
[28] 董合忠. 棉花体细胞胚发生和植株再生. 植物生理学通讯, 1990(2):8-12.DONG H Z. Somatic embrygenesis of cotton and its plant regeneration in vitro.Plant Physiology Communications, 1990(2):8-12. (in Chinese)
[29] 商海红, 刘传亮, 张朝军, 武芝霞, 李付广. 棉花体细胞胚发生机理的研究进展. 西北植物学报,2009, 29(3): 000637-000642.SHANG H H, LIU C L, ZHANG C J, WU Z X, LI F G. Advances in research on somatic embryogenesis mechanism of cotton.Acta Botanica Boreali-Occidentalia Sinica, 2009, 29(3): 000637-000642.(in Chinese)
[30] XU J, YANG X Y, LI B Q, CHEN L, MIN L, ZHANG X L.GhL1L1affects cell fate specification by regulating GhPIN1-mediated auxin distribution.Plant Biotechnology Journal,2019,17(1):63-74.
[31] ARACELI R S, GUSTAVO A H, JOSE M, RODIGUEZ D,BENJAMIN R G, JESUS C M, OSVALDO A, CASTELLANOS.Effect of light quality and culture medium on somatic embryogenesis ofAgave tequilanaWeber var. Azul.Plant Cell Tissue & Organ Culture,2011, 104(2): 271-275.
[32] FEHER A, PASTERNAK T P, DUDITS D. Transition of somatic plant cells to an embryogenic state.Plant Cell Tissue & Organ Culture,2003, 74(3): 201-228.
[33] NHUT D T, HUY N P, TAI N T, NAM N B, LUAN V Q, HIEN V T,TUNG H T, VINH B T, LUAN T C. Light-emitting diodes and their potential in callus growth, plantlet development and saponin accumulation during somatic embryogenesis of Panax vietnamensis Ha et Grushv.Biotechnology & Biotechnological Equipment,2015,29(2): 299-308.
[34] HERINGER A S, REIS R S, PASSAMANI L Z, SANTA -CATARINA C, SILVEIRA V. Comparative proteomics analysis of the effect of combined red and blue lights on sugarcane somatic embryogenesis.Acta Physiologiae Plantarum,2017, 39(2): 52.
[35] WANG S, LI L, XU P B, LIAN H L, WANG W X, XU F, MAO Z L,ZHANG T, YANG H Q. CRY1 interacts directly with HBI1 to regulate its transcriptional activity and photomorphogenesis inArabidopsis.Journal of Experimental Botany,2018, 69(16): 3867-3881.
[36] XU D Q, JIANG Y, LI J G, LIN F, HOLM M, DENG X W. BBX21,anArabidopsisB-box protein, directly activatesHY5and is targeted by COP1 for 26S proteasome-mediated degradation.Proceedings of the National Academy of Sciences of the United States of America,2016, 113(27): 7655.
[37] HU X M, XU L. Transcription factors WOX11/12 directly activate WOX5/7 to promote root primordia initiation and organogenesis.Plant Physiology,2016, 172(4): 2363.
[38] 李雯琳, 郁继华, 张国斌, 杨其长. LED光源不同光质对叶用莴苣幼苗叶片气体参数和叶绿素荧光参数的影响. 甘肃农业大学学报,2010, 45(1): 47-51.LI W L, YU J H, ZHANG G B, YANG Q C. Effects of different light quality of LED light sources on leaf gas parameters and chlorophyll fluorescence parameters of leaf lettuce seedlings.Journal of Gansu Agricultural University, 2010, 45(1): 47-51. (in Chinese)
[39] YE S Y, SHAO Q S, XU M J, LI S L, WU M, TAN X, SU L Y. Effects of light quality on morphology, enzyme activities, and bioactive compound contents in anoectochilus roxburghii.Frontiers in Plant Science,2017, 8: 857.
