黄芪多糖联合Smac shRNA对高糖诱导的血管内皮细胞凋亡的影响
2019-04-03司文,郭壮,周华
司 文,郭 壮,周 华
1)胜利油田中心医院内分泌科 山东东营 257034 2)胜利油田中心医院消化内科 山东东营 257034 3)山东大学附属省立医院血管外科 济南250021
高糖诱导的心血管系统疾病是人类致残、致死的重要原因[1];高糖诱导的血管内皮细胞损伤是糖尿病心脑血管疾病发生的基础[1-2]。黄芪多糖由中药黄芩中提取,具有提高机体免疫力、抑制衰老等药理学作用,在心血管系统疾病中发挥保护作用;黄芪多糖可以减轻血管内皮细胞损伤,促进血管内皮功能恢复[3-4]。Smac是一种强促凋亡因子,在细胞的凋亡、分化等过程中扮演重要角色,并参与糖尿病、肿瘤等疾病的发生[5-6]。本研究探讨黄芪多糖联合Smac shRNA对高糖诱导的血管内皮细胞凋亡的影响,为减轻糖尿病血管内皮组织损伤提供参考。
1 材料与方法
1.1材料人脐静脉血管内皮细胞株EVC-304购自上海继和生物科技有限公司。Smac shRNA慢病毒和对照慢病毒由吉满生物科技(上海)有限公司构建。Real-time PCR试剂盒购自美国Promega公司,引物由苏州金唯智生物科技有限公司合成,黄芪多糖购自中国药品生物制品鉴定所,激活型Caspase-3(C-Caspase-3)、C-Caspase-9抗体购自美国Invitrogen公司,过氧化氢酶(catalase, CAT)活性检测试剂盒购自南京建成生物工程研究所,丙二醛(malonaldehyde,MDA)含量检测试剂盒购自北京索莱宝科技有限公司,超氧化物歧化酶(superoxide dismutase,SOD)活性检测试剂盒购自北京百奥莱博科技有限公司,Smac抗体购自美国Santa Cruz公司。
1.2慢病毒感染和干扰效果检测EVC-304细胞接种于24孔板,密度达40%时分别用Smac shRNA慢病毒和对照慢病毒感染,然后用嘌呤霉素筛选出稳定感染细胞,分别用Real-time PCR和Western blot法检测细胞中Smac mRNA和蛋白表达水平。
Real-time PCR:细胞经PBS洗涤后,提取总RNA,以紫外分光光度计法测定浓度、纯度,-70 ℃保存。取RNA反转录合成cDNA,并以Real-time PCR检测Smac mRNA水平。引物序列:Smac上游5’-GCAAGCTTCCACCATGGCGGCTCTGAAGAG-3’,下游5’-CAGGGATCCTCAATCCTCACGCAGGTAG GCCTC-3’。内参GAPDH上游5’-GAAGGTGAAG GTCGGAGTC-3’,下游5’-GAAGATGGTGATGG GATTTC-3’。 反应体系:0.5 μmol/L的上下游引物各1 μL、12.5 μL的SYBR Premix TaqTM、1 μL的cDNA模板、添加ddH2O补足至40 μL。反应程序:95 ℃ 3 min(预变性);95 ℃ 30 s(变性),55 ℃ 30 s(退火),72 ℃ 1 min(延伸),循环35次。用2-ΔΔCt法计算Smac mRNA的表达。实验重复3次,下同。
Western blot:细胞中添加三去污裂解液,置于冰上裂解30 min。将细胞裂解液转移到离心管内,4 ℃,12 000 ×g离心10 min。吸取上清,置于-80 ℃中保存。收集2 μL的蛋白,以BCA法定量。将1体积的蛋白样品与4倍体积的5×上样缓冲液在100 ℃煮沸10 min。配制蛋白凝胶(100 g/L的分离胶、50 g/L的浓缩胶)。每个泳道上样20 μg蛋白,电泳后将凝胶上的蛋白转移到硝酸纤维素膜,于体积分数5%牛血清白蛋白中,37 ℃摇床孵育2 h。加入按1∶800稀释的Smac抗体, 4 ℃孵育过夜,用TBST洗涤3次,加入1∶5 000稀释HRP标记的IgG,37 ℃孵育2 h。用ECL试剂发光以后,收集图像,以GAPDH为内参,分析Smac蛋白表达水平。
1.3细胞分组处理将EVC-304细胞分为4组,对照组未处理,黄芪多糖组给予300 mg/L黄芪多糖,干扰组感染Smac shRNA慢病毒,黄芪多糖+干扰组用300 mg/L黄芪多糖培养感染Smac shRNA慢病毒的EVC-304细胞,3 d后4组均用30 mmoL/L的葡萄糖培养液培养24 h。
1.4流式细胞术检测细胞凋亡收集各组细胞,离心,细胞沉淀中添加Binding Buffer 500 μL,混匀,再添加5 μL的Annexin V-FITC、5 μL的PI,放在避光环境中15 min后,用流式细胞仪测定细胞凋亡率。
1.5细胞培养液中SOD、CAT活性和MDA含量检测收集各组细胞培养液上清,分别用试剂盒检测SOD、CAT活性和MDA含量,步骤均参照试剂盒标准流程。
1.6细胞中C-Caspase-3、C-Caspase-9蛋白表达的检测收集各组细胞,用Western blot检测细胞中C-Caspase-3、C-Caspase-9蛋白表达水平(抗体稀释度均为1∶400),具体操作步骤同1.2。
1.7统计学处理用SPSS 21.0处理数据。采用两独立样本t检验比较感染Smac shRNA慢病毒和对照慢病毒的EVC-304细胞中Smac mRNA和蛋白表达的差异,采用2×2析因设计的方差分析探讨黄芪多糖和Smac shRNA干扰对高糖培养的EVC-304细胞凋亡及相关因子表达的影响,检验水准α=0.05。
2 结果
2.1SmacshRNA干扰效果感染Smac shRNA慢病毒的EVC-304细胞Smac mRNA和蛋白表达水平均低于感染对照慢病毒的细胞。见图1、表1。

1、2:分别为感染对照慢病毒及Smac shRNA慢病毒的细胞
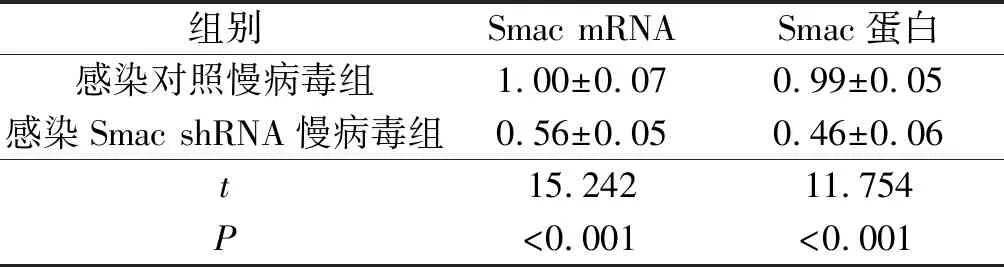
组别Smac mRNASmac蛋白感染对照慢病毒组1.00±0.070.99±0.05感染Smac shRNA慢病毒组0.56±0.050.46±0.06t15.24211.754P<0.001<0.001
2.2 4组细胞凋亡率比较Smac shRNA干扰和黄芪多糖均可抑制高糖诱导的细胞凋亡,二者联用有协同作用。见表2。
2.3 4组细胞培养液中CAT、SOD活性及MDA含量比较Smac shRNA干扰或黄芪多糖处理均可提高细胞培养液上清SOD和CAT活性,降低MDA含量,且二者联用有协同作用。见表2。
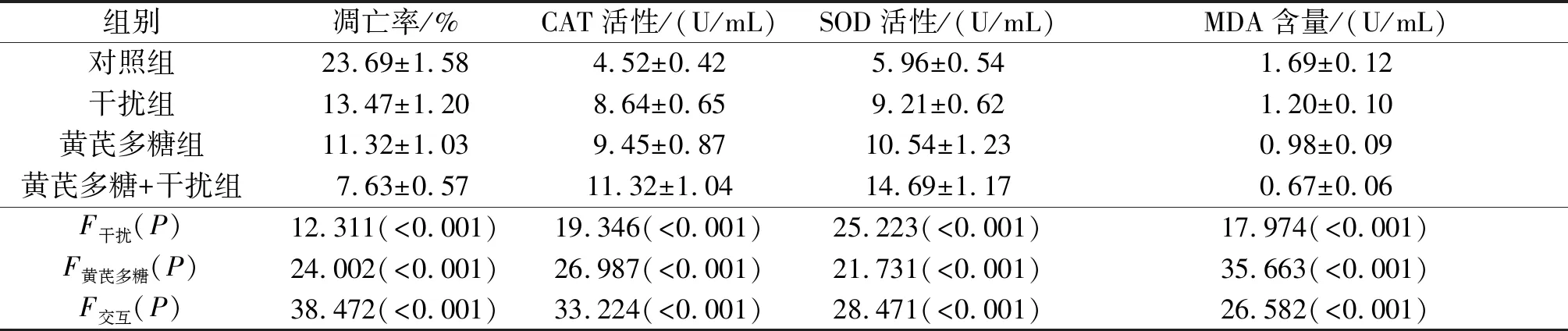
表2 4组细胞凋亡率及培养液中 CAT、SOD活性和MDA含量比较(n=3)
2.4 4组细胞中C-Caspase-3、C-Caspase-9蛋白表达的比较Smac shRNA干扰或黄芪多糖处理均可抑制高糖条件下EVC-304细胞中C-Caspase-3、C-Caspase-9蛋白的表达,二者联用有协同作用。见图2、表3。
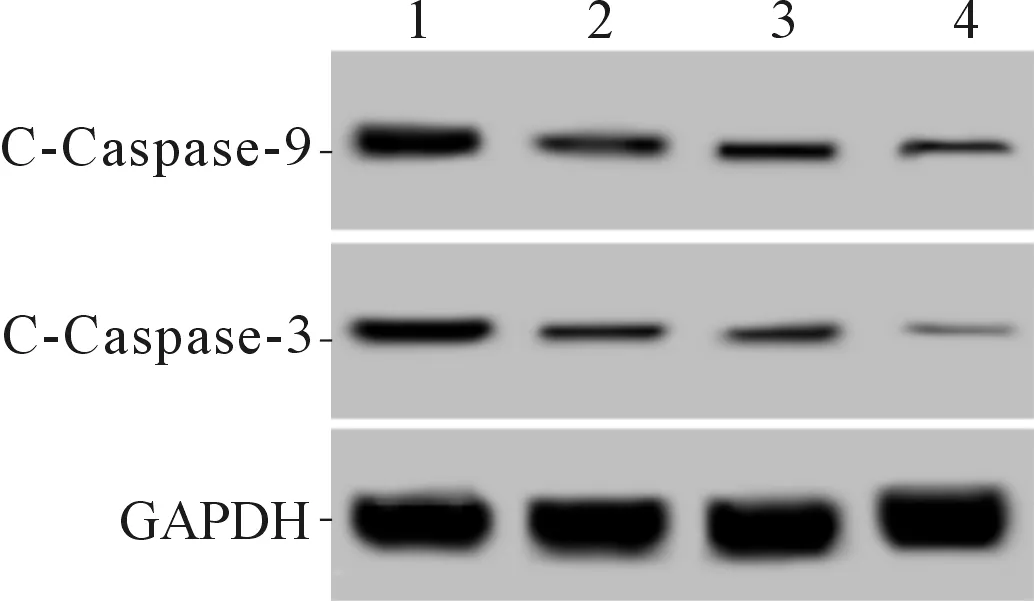
1~4:分别为对照组、干扰组、黄芪多糖和黄芪多糖+干扰组
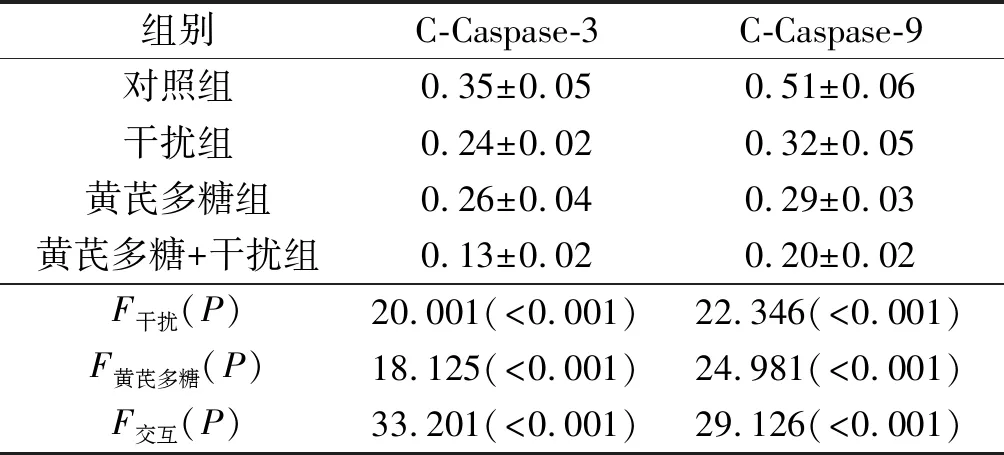
图2 4组细胞中C-Caspase-3、C-Caspase-9蛋白的表达
3 讨论
黄芪多糖具有多种药理学作用如抗氧化、提高免疫力等[3-4]。研究[4,7-11]表明,黄芪多糖具有保护血管内皮细胞免受损伤的作用,其可以抑制缺氧复氧、肿瘤坏死因子-α等诱导的血管内皮细胞凋亡。本实验结果表明,黄芪多糖可以减少高糖环境下血管内皮细胞凋亡,提示黄芪多糖具有抗糖尿病血管内皮细胞损伤的作用。
Smac基因由7个外显子组成,定位于12号染色体长臂上,Smac基因编码的蛋白含有239个氨基酸,相对分子质量为28 000,在其氨基末端含有一个由55个氨基酸组成的线粒体靶序列,在线粒体定位中发挥作用[12-13]。Smac是一个凋亡促进因子,Smac蛋白能够促进Caspase级联反应的激活,从而发挥促进凋亡的作用[14]。Smac在人体多种组织中均有表达,参与细胞内环境稳态的维持、胚胎发育等过程;另外,Smac参与糖尿病血管损伤的发生,干扰Smac可以抑制血管内皮细胞凋亡[15-16]。本实验结果表明,干扰Smac表达可以抑制高糖诱导的血管内皮细胞凋亡和细胞中Caspase-3、Caspase-9蛋白的活化,这与Smac促凋亡作用相符合,说明Smac可能是防治糖尿病血管内皮功能障碍的靶点之一。
糖尿病心血管系统疾病的发生与氧化应激密切相关,高糖环境下血管内皮细胞中的氧化平衡状态被打破,细胞过度凋亡,影响血管内皮功能[17]。正常情况下,细胞内存在抗氧化酶系统,抗氧化酶活性与细胞内氧自由基水平密切相关。细胞内氧自由基可以使存在于细胞膜上的脂质发生过氧化反应,导致膜损伤,使得存在于细胞内的抗氧化酶等物质进入细胞外。SOD和CAT是两个重要的氧自由基清除剂,其活性降低可直接导致细胞内氧自由基过度积累,而过量的氧自由基可以激活细胞内Caspase凋亡反应,促进细胞凋亡[18-19]。MDA是脂质过氧化产物,其含量的高低可以直接反映细胞氧化损伤程度[20]。本研究结果显示,干扰Smac或黄芪多糖均可提高高糖环境下血管内皮细胞SOD和CAT活性,降低MDA水平,且二者联合有协同作用,提示干扰Smac和黄芪多糖联合可以提高血管内皮细胞抗氧化能力,减少氧化损伤。
综上,黄芪多糖和Smac干扰均可抑制高糖诱导的血管内皮细胞凋亡,提高细胞抗氧化能力,减少氧化损伤,且二者联合有协同作用,但其具体的调控机制和靶向作用位点尚不明确。干扰Smac联合黄芪多糖可能是缓解糖尿病血管内皮损伤的途径之一。
