血管紧张素(1-7)通过上调自噬水平缓解肝细胞功能障碍
2019-04-02贺娟丁见王馨珂燕群赖秋华李爱民刘思德
贺娟,丁见,王馨珂,燕群,赖秋华,李爱民,刘思德
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)在全球及国内发病率均逐年上升[1-2],肝细胞内脂肪沉积是NAFLD形成的初始形式[3],并可进一步诱发肝细胞内氧化应激、炎症因子的活化,致使细胞内失衡及损伤[4-5]。肾素血管紧张素系统(renin-angiotensin system, RAS)在肝脏组织中也存在,并可参与NAFLD疾病进程[6-8]。RAS系统包含经典的血管紧张素转换酶-血管紧张素Ⅱ-血管紧张素Ⅱ 1型受体(ACE-AngⅡ-AT1-R)轴及新近发现的血管紧张素转换酶2-血管紧张素(1-7)-血管紧张素(1-7)受体(ACE2-Ang(1-7)-Mas轴),ACE2-Ang(1-7)-Mas轴被认为是ACE-AngⅡ-AT1-R轴的内在反馈调节轴。AngⅡ可加重肝细胞脂质沉积及细胞损伤[9],可促进NAFLD进展[10];Ang(1-7)对肝细胞的作用目前研究尚少[11]。本研究选用人正常肝细胞L-02细胞系,建立脂肪累积模型,研究Ang(1-7)对肝细胞脂质累积及损伤的影响。
1 材料与方法
1.1 材料
人正常肝细胞L-02细胞系购自ATCC; DMEM细胞培养基、血清购自Gibco;棕榈酸、油酸 、Ang(1-7)、DCFH-DA探针购自Sigma-Aldrich;DHE探针购自碧云天;LC3B抗体购自Cell Signaling Technology;GAPDH抗体购自Proteintech;自噬双标腺病毒(mRFP- GFP-virus)购自汉恒生物。
1.2 方法
1.2.1 细胞培养
细胞以10% FBS完全培养基置于37 ℃,5% CO2细胞培养箱中培养。定期进行换液,培养至所需细胞浓度进行相应药物处理。
1.2.2 药物配置
游离脂肪酸(free fatty acid, FFA)以棕榈酸∶油酸=1∶2浓度配置。步骤如下:①10.1 mg 油酸钠, 4.6 mg棕榈酸钠加入6 mL双蒸水,70 ℃水浴15~20 min;②1.1 g脱脂BSA 加入5 mL 双蒸水,37 ℃水浴溶解;③将脂肪酸溶液与39 mL DMEM混匀,再加入BSA溶液。即50 mL 1 mmol/L的FFA溶液,过滤后用于细胞。作用于细胞时配置成0.5 mmol/L FFA溶液。
1.2.3 分组及处理
分组:①正常对照组(Control): 以正常培养基进行培养;②FFA组:0.5 mmol/L游离脂肪酸干预24 h;③ FFA+Ang(1-7)10-9mol/L组:0.5 mmol/L游离脂肪酸与10-9mol/L Ang(1-7)共同干预24 h; ④FFA+Ang(1-7)10-7mol/L组:0.5 mmol/L游离脂肪酸与10-7mol/L Ang(1-7)共同干预24 h;⑤FFA+Ang(1-7)10-5mol/L组:0.5 mmol/L游离脂肪酸与10-9mol/L Ang(1-7)共同干预24 h;将细胞接种到6孔板(1×106个/孔),待细胞贴壁后按照分组依次进行相应刺激,并进行后续处理。
1.2.4 油红染色
将细胞接种到24孔板,爬片上予以药物刺激;将爬片放于配好的油红O染液中,静置30 min后用自来水清洗。爬片放于苏木素染液中,静置40 s后用自来水清洗,返蓝1 min。甘油明胶封片,正置显微镜下观察并拍照。
1.2.5 细胞氧化应激ROS测定
将细胞种植于96孔板中,设置复孔,予药物刺激后,弃上清,以PBS清洗3次;预先用DMEM 以1∶1 000稀释DCFH-DA及DHE探针,以每孔200 μL加入相应探针,37 ℃孵育 30 min;弃去探针,PBS清洗3次,荧光显微镜下拍照观察。
1.2.6 自噬双标病毒转染及荧光染色
将细胞接种在24孔板爬片上,细胞密度为 40%~50%时更换为无血清培养基,转染mRFP-GFP-LC3病毒(MOI=50),2 h后更换完全培养基,并加入药物刺激,多聚甲醛固定10 min后封片,荧光显微镜下拍照观察,拍照计数并统计。
1.3 统计学分析
结果以Mean±SEM表示,采用Graphpad Prism 5进行方差分析,组间比较采用非配对T检验进行差异分析,并将P<0.05作为有统计学意义的指标。
2 结果
2.1 Ang(1-7)可缓解FFA诱导的肝细胞脂质沉积
0.5 mmol/L FFA可明显增加人正常肝细胞L-02内脂质沉积水平,且在L-02细胞中脂滴更为明显。以三个不同浓度Ang(1-7)与FFA共同作用于肝细胞,结果提示Ang(1-7)能明显缓解FFA诱导的肝细胞内脂质沉积水平,且随着Ang(1-7)浓度的增加缓解脂质水平的能力增强。10-7mmol/L及10-5mmol/L可大幅缓解脂质沉积,其中10-5mmol/L基本可以逆转FFA所致的脂肪累积至正常肝细胞内脂质水平,见图1。
2.2 Ang(1-7)可缓解FFA诱导的肝细胞内的氧化应激
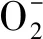
2.3 Ang(1-7)可上调肝细胞内自噬水平,调节脂类代谢
本研究采用自噬双标腺病毒mRFP-GFP-virus转染L-02细胞后观察自噬小体及自噬溶酶体形成的自噬流,结果显示:FFA诱导的脂质沉积的肝细胞内自噬水平相较正常肝细胞内略有上升(自噬溶酶体(红)P=0.047 4, 自噬小体(黄)P=0.013 2)。而相较FFA组,Ang(1-7)则可明显激活上调肝细胞内自噬小体及自噬溶酶体水平。其中,10-9mol/L Ang(1-7)即可轻度上调自噬小体(P=0.000 6),并显著上调溶酶体水平(P=0.024 1),10-7mol/L Ang(1-7)与10-5mol/L Ang(1-7)可显著上调自噬小体(10-7mol/L,P<0.000 1;10-5mol/L,P<0.000 1),及自噬溶酶体(10-7mol/L,P=0.007 5;10-5mol/L,P=0.002 9),见图4。
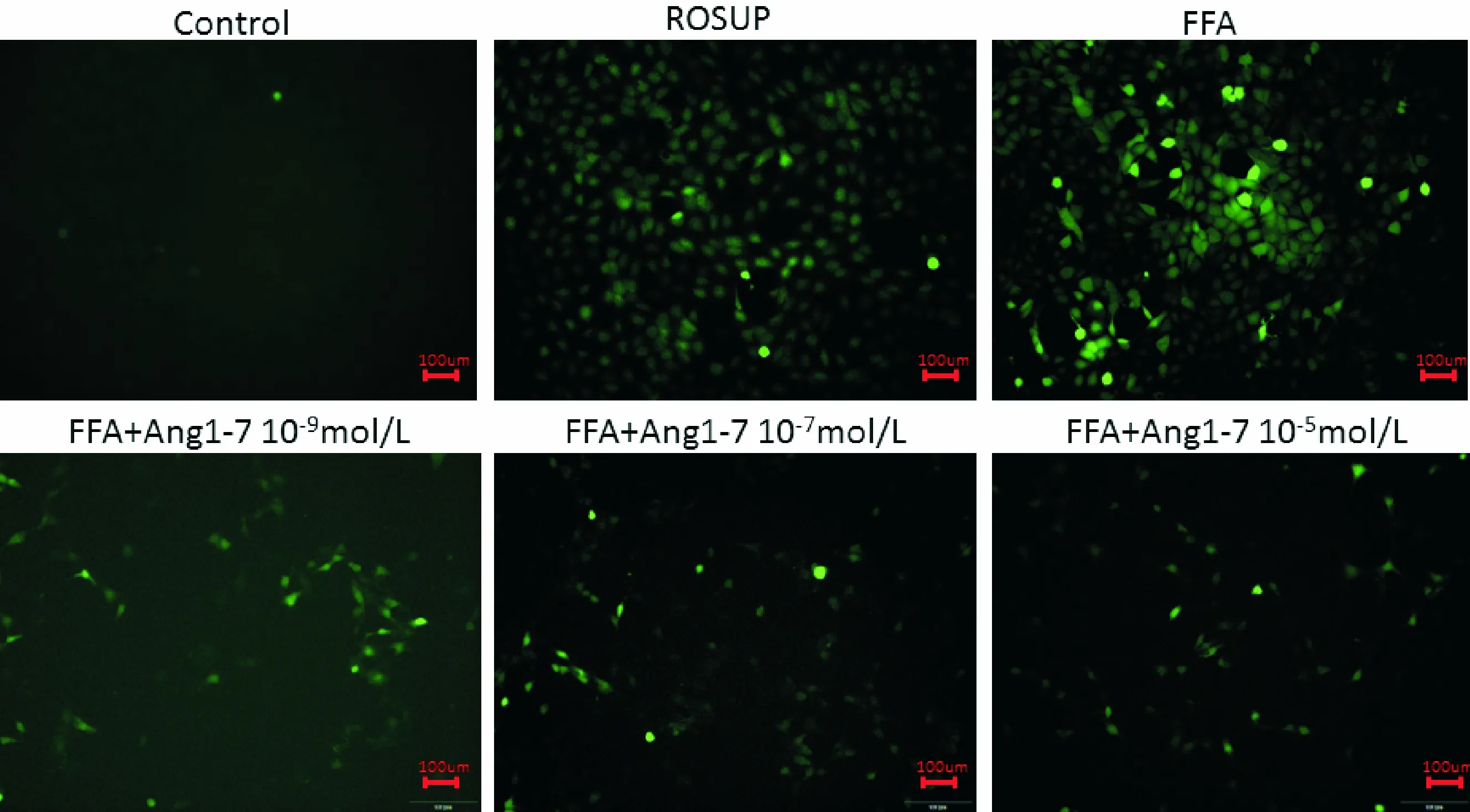
图2 Ang(1-7)对FFA诱导的肝细胞内ROS的影响。DCFH-DA探针染色肝细胞,并于荧光显微镜下拍照观察,×200倍
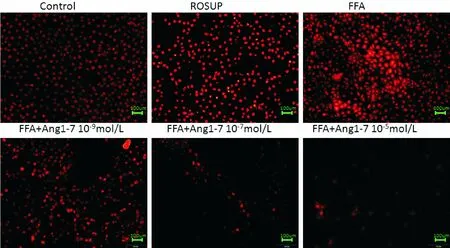
图3 Ang(1-7)对FFA诱导的肝细胞内水平的影响。DHE探针染色肝细胞,并于荧光显微镜下拍照观察,×200倍
A为自噬小体及自噬溶酶体荧光图,红色为自噬溶酶体,黄色为自噬小体。B、C为细胞内自噬小体及自噬溶酶体数目统计分析。*:P<0.05,**:P<0.01,***:P<0.001
3 讨论
NAFLD病理学表现为细胞内脂质沉积,肝细胞是NAFLD进展过程中最关键也是受损最严重的细胞[12]。肝细胞内大量脂质沉积诱发氧化应激,后者可致使肝细胞损伤甚至坏死[13]。ACE2-Ang(1-7)-Mas轴是对ACE-AngⅡ-AT1-R内在反馈机制,Ang(1-7)是其主要活性成分,由ACE2水解AngⅡ及AngI生成,可结合特异性受体Mas,拮抗AngⅡ作用[8]。本课题组前期实验证实AngⅡ可加重肝细胞的脂质沉积及细胞内氧化应激水平,因此本研究进一步研究Ang(1-7)对FFA诱导的肝细胞损伤的影响,借此进一步完善RAS系统在肝脏脂质代谢的作用。本研究结果表明,游离脂肪酸作用于肝细胞可诱导L-02细胞脂质明显沉积,胞内氧化应激反应上调,ROS水平明显增强。Ang(1-7)可缓解FFA诱导的肝细胞脂质沉积,同时可降低细胞内ROS水平,减轻FFA导致的肝细胞功能失调。
细胞自噬(autophagy)是细胞内的一种自食(self-eating)现象,依赖溶酶体途径对胞质蛋白和细胞器进行吞噬、包被、融合的过程,以实现细胞稳态[14-15],与多种疾病相关[16]。自噬可调节细胞内脂质水平[17],缓解细胞脂质累积;细胞内自噬被激活以吞噬脂滴[18],进而降低脂类对细胞所造成的损伤[19];但过量脂质累积可抑制自噬。自噬也可调节细胞内氧化应激,降低ROS水平[20]。自噬在NAFLD疾病起调控作用[21],而关于Ang(1-7)调节肝脏细胞内自噬水平以实现其对细胞功能调节的研究较少。本课题组前期实验表明AngⅡ可加强FFA所致肝细胞脂质沉积,而过量脂质沉积后肝细胞自噬下降。本研究结果证实Ang(1-7)可上调FFA诱导的脂质沉积的肝细胞内自噬水平,促进自噬调节脂质代谢,从而缓解细胞内脂质累积。脂质的累积可导致细胞内氧化应激水平上调,Ang(1-7)可通过促进自噬反馈降低细胞内氧化应激水平。
综上所述,Ang(1-7)可在细胞水平上调肝细胞内自噬水平,进而降低脂质累积及氧化应激水平,缓解FFA所致的肝细胞功能损伤及内环境稳态失调,可以保护肝细胞,由NAFLD状态逆转为基本正常状态,这可能为Ang(1-7)介导的肝细胞内自噬作为防治NAFLD进展提供新的防治思路及理论依据。
