米格列奈及其3个异构体杂质的反相液相色谱分离及质谱碎裂分析
2019-04-02刘海涛侯金凤王成刚李文东车宝泉
李 珉, 刘海涛, 侯金凤, 王成刚, 李文东, 车宝泉
(北京市药品检验所, 中药成分分析与生物评价北京市重点实验室, 北京 102206)
米格列奈(mitiglinide),化学名为2-(S)-苄基-4-氧代-4-(顺-全氢异吲哚-2-基)丁酸,是一种新型的苯甲酸衍生物类降糖药物,2004年由日本Kissei制药公司在日本首次上市[1,2],其化学结构式如图1所示。近年来,国内外的相关文献主要为基于反相色谱的米格列奈有关物质的分析,以及基于高效液相色谱-质谱联用(LC-MS)或超高效液相色谱-质谱联用(UPLC-MS)的米格列奈含量测定方法[3-11],然而这些方法均未实现米格列奈异构体的分离,且均未对米格列奈的质谱裂解机理有任何报道。对米格列奈异构体的分离,大多采用基于手性色谱的方法对光学异构体进行分离[12,13]。而对米格列奈进行结构分析发现,其可能存在多种非光学异构体,这些异构体往往没有药效活性,因此实现对其非光学异构体的分离具有重要意义。近年来,药物的非光学异构体杂质引起越来越多的关注,各种药物的异构体分离方法常有报道[14-20]。2014年,Sastry等[21]报道了多种米格列奈可能的异构体杂质,其中仅包含一种非光学异构体杂质,且研究表明其并无药效活性。同年,周晓兰[22]建立了可以实现该位置异构体与米格列奈分离的反相液相色谱方法。本文在此基础上,建立了成功分离米格列奈与3种异构体的反相超高效液相色谱方法,并结合质谱数据,对米格列奈及其异构体可能的裂解机理进行了推断。

图 1 米格列奈钙的化学结构式Fig. 1 Chemical structure of mitiglinide calcium
1 实验部分
1.1 仪器、试剂与材料
Dionex Ultimate 3000高效液相色谱-Q Exactive四极杆/静电场轨道阱高分辨质谱联用系统(美国Thermo Fisher Scientific公司),配有ESI源;XA205型电子天平(d=0.01 mg,瑞士Mettler Toledo公司); Milli-Q超纯水器(美国Millipore公司)。
米格列奈钙(批号为20160501-D,纯度99.95%)和米格列奈钙消旋体对照品(批号为2016070401,纯度98.7%)均由德州博诚制药有限公司提供。甲酸、乙腈(色谱纯)购自美国Merck公司,正戊醇(色谱纯)购自上海麦克林生化科技有限公司。
米格列奈钙原料样品(批号分别为0320160401、01616015、150801、MG-161101和170401Y)分别由德州博诚制药有限公司、连云港润众制药有限公司、浙江国邦药业有限公司、江苏豪森药业集团有限公司和烟台正方制药有限公司提供。
1.2 溶液的配制
米格列奈钙标准溶液 精密称取米格列奈钙对照品适量,用水-乙腈(2∶1, v/v)溶解、定容,配制成质量浓度为1 g/L的对照品储备液,于4 ℃保存(有效期10天)。每次使用前,用水-乙腈(2∶1, v/v)逐级稀释,配制成米格列奈质量浓度分别为2、5、10、20、50、100、200、500、1 000、2 000、5 000和10 000 μg/L的系列标准工作溶液。
系统适用性溶液 精密称取米格列奈钙对照品10.41 mg,置于100 mL容量瓶中,加适量水-乙腈(2∶1, v/v)溶解,100 ℃水浴破坏1 h,放冷至室温,定容;精密量取1 mL,置100 mL量瓶中,用水-乙腈(2∶1, v/v)定容。
消旋体对照溶液 精密称取米格列奈钙消旋体对照品10.67 mg,置于100 mL容量瓶中,加适量水-乙腈(2∶1, v/v)溶解,定容。精密量取1 mL,置100 mL量瓶中,用水-乙腈(2∶1, v/v)定容,配制成质量浓度约为1 000 μg/L的溶液。
供试品溶液 精密称取米格列奈钙原料样品适量,用水-乙腈(2∶1, v/v)溶解、定容,配制成质量浓度为1 g/L的溶液。
1.3 破坏试验操作过程
取米格列奈钙原料约10 mg,精密称定,置10 mL量瓶中,加溶剂(水-乙腈(2∶1, v/v))5 mL,超声并时时振荡使溶解,将上述溶液平行配制6份,记作溶液A,分别按下述条件进行破坏试验。
酸破坏:在溶液A中加入1 mol/L盐酸溶液1 mL,于室温下放置4 h,加1 mol/L氢氧化钠溶液1 mL,再加溶剂稀释至刻度,摇匀,即得。
碱破坏:在溶液A中加入1 mol/L氢氧化钠溶液1 mL,于室温下放置4 h,加1 mol/L盐酸溶液1 mL,再加溶剂稀释至刻度,摇匀,即得。
氧化破坏:在溶液A中加入6%(v/v)过氧化氢溶液1 mL,于室温下放置4 h,加溶剂稀释至刻度,摇匀,即得。
高温破坏:在溶液A中加溶剂稀释至刻度,摇匀,于100 ℃水浴破坏4 h,放冷至室温,用溶剂稀释至刻度,摇匀,即得。
强光照破坏:在溶液A中加溶剂稀释至刻度,摇匀,于4 500 lx光照条件下放置约4 h,取出,即得。
紫外光照破坏:在溶液A中加溶剂稀释至刻度,摇匀,于紫外光照条件下放置约4 h,取出,即得。
1.4 仪器分析条件
1.4.1色谱条件
色谱柱:ACQUITY UPLC®HSS T3(100 mm×2.1 mm, 1.8 μm);流动相:水-乙腈-正戊醇(75∶25∶1, v/v/v),用甲酸调节pH至1.8;流速:0.4 mL/min;柱温:40 ℃;进样量:10 μL。
1.4.2质谱条件
离子源:ESI;扫描模式:正离子;检测模式:单离子监测模式二级扫描(SIM/dd MS2);一级离子扫描范围(m/z): 314.190 7~318.190 7;二级离子扫描范围(m/z): 50~350;一级分辨率:70 000 FWHM;二级分辨率:17 500 FWHM;喷雾电压:3.5 kV;离子传输管温度:325 ℃;汽化温度:350 ℃;鞘气压(N2): 40 arb;辅助气压(N2): 10 arb; S-Lens: 55 V; HCD碰撞气:氮气;碰撞电压:35 eV。

表 1 米格列奈及其3个异构体杂质的母离子及各碎片离子的精确质量数Table 1 Accurate masses of parent ion and each fragment ions of mitiglinide and its three isomer impurities
2 结果与讨论
2.1 方法分离情况
将1.2节中系统适用性溶液按1.4节中条件进行测定,结果见图2a。
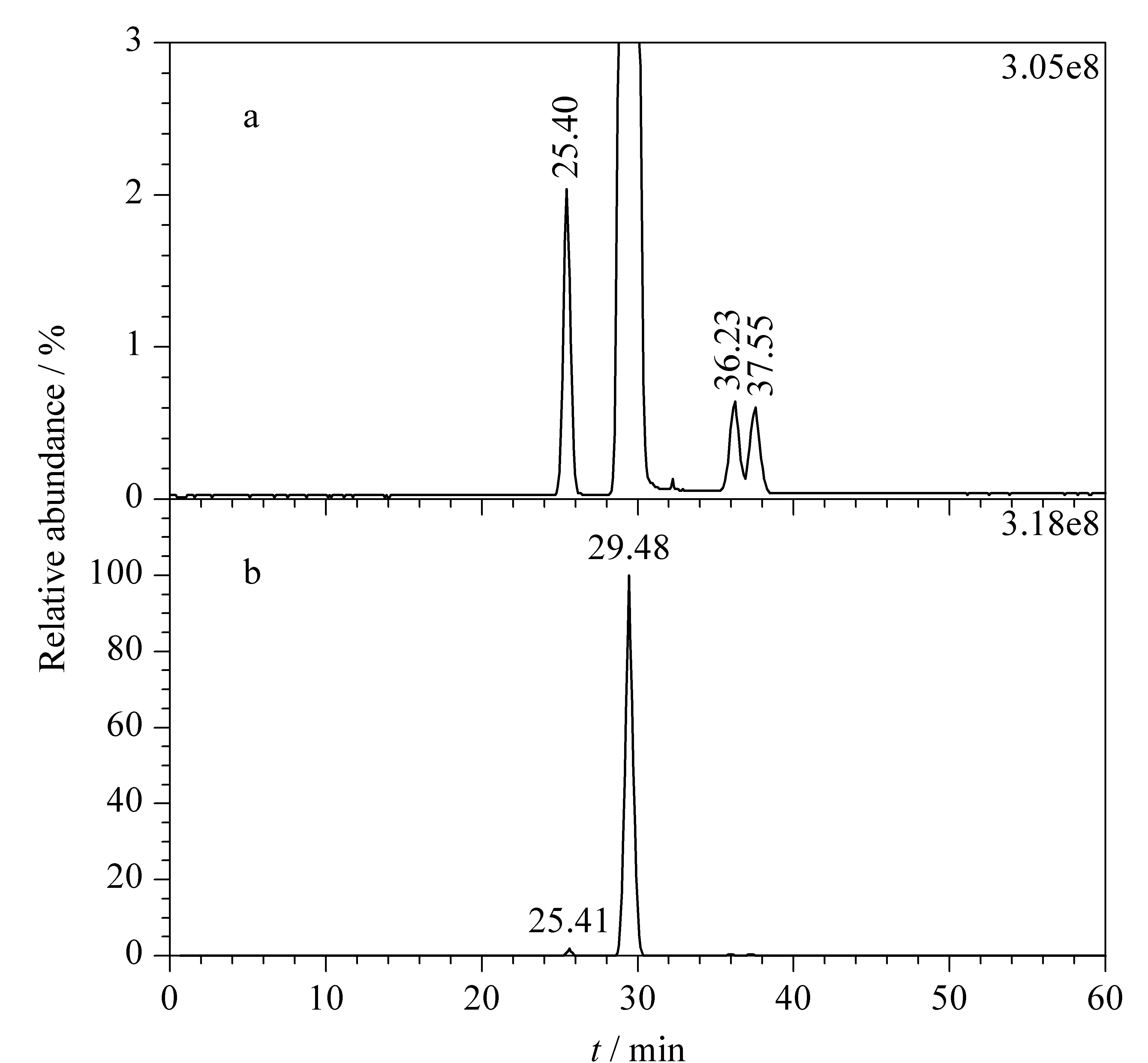
图 2 米格列奈(a)系统适用性溶液与(b)消旋体对照 溶液的提取离子流色谱图Fig. 2 Extracted ion chromatograms of (a)mitiglinide system suitability solution and (b) mitiglinide racemic solution
从图2a可以看出,在单离子监测模式(SIM)下,米格列奈的[M+H]+(m/z=316.190 72)的提取离子流色谱图(EIC)可得到4个不同的色谱峰。对4个色谱峰的质谱图进行比较,结果见表1,各峰的精确质量数与米格列奈[M+H]+的精确质量数316.190 72相比,偏差均在2×10-6以内,可断定4个色谱峰为4个不同的同分异构体,其中含量最高的2号峰为米格列奈主成分,其余3个峰为米格列奈异构体杂质。因此,建立的反相液相色谱方法可以实现米格列奈主成分与3种异构体杂质的分离。
将1.2节中消旋体对照溶液按1.4节中条件进行测定,结果见图2b。可以看出,消旋体在本次建立的液相色谱方法中未能实现分离,因此3种异构体杂质均排除了光学异构体的可能性。
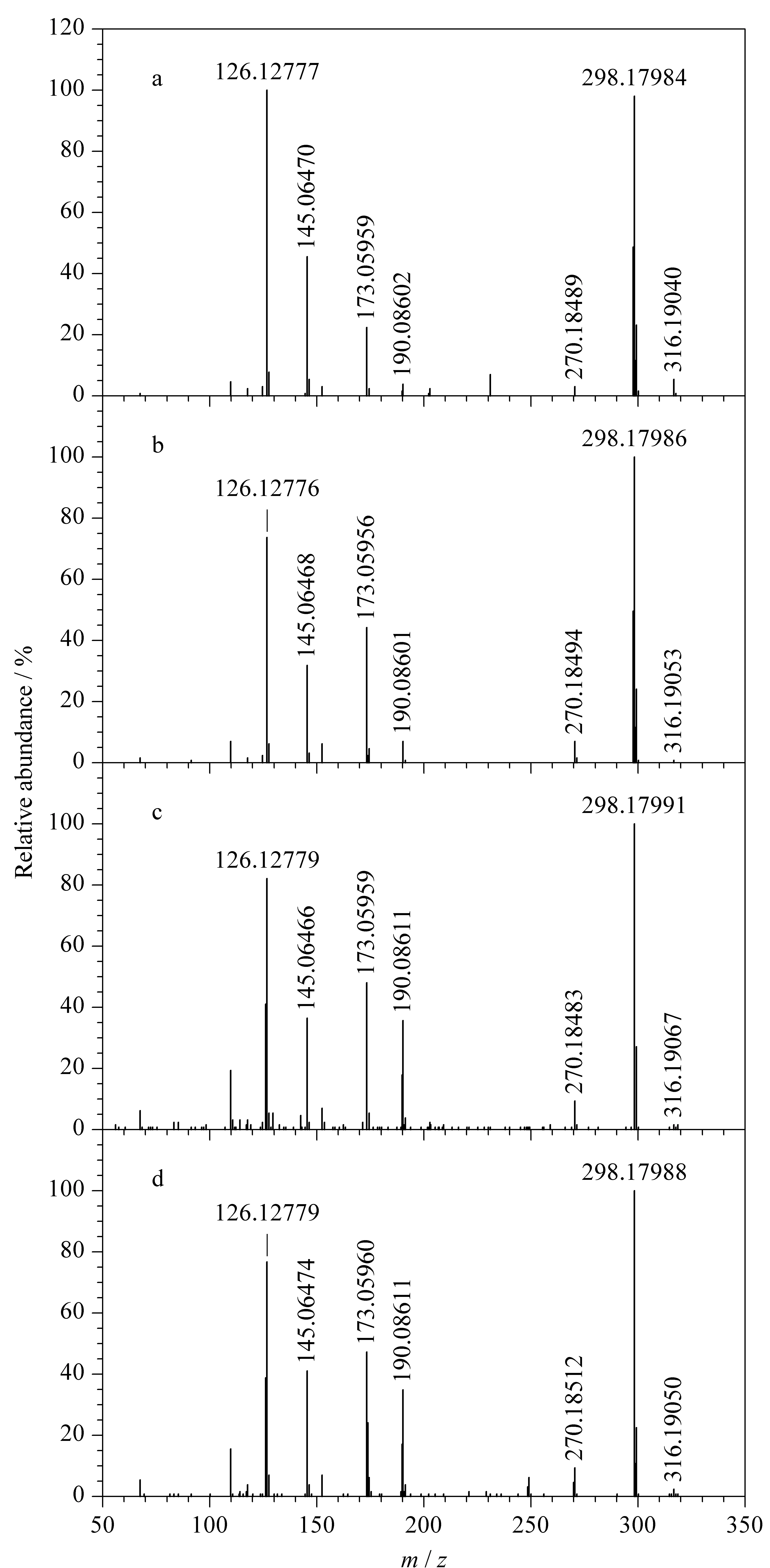
图 3 米格列奈及其3个异构体的二级质谱图Fig. 3 MS/MS spectra of mitiglinide and its three isomers a. mitiglinide; b. isomer impurity 1; c. isomer impurity 2; d. isomer impurity 3.
2.2 米格列奈及其异构体杂质的质谱碎裂情况及裂解机理分析
米格列奈及其3个异构体杂质的二级质谱图见图3。米格列奈及其3个异构体杂质的母离子及各碎片离子的精确质量数见表1。
由表1可见,米格列奈及其3个异构体杂质的母离子及质荷比(m/z)超过120的各碎片离子的质量数偏差均在2 10-6以内。可见米格列奈及其3个异构体杂质的碎片离子的质荷比基本相同。但由图3可见,m/z分别为145、173和190的碎片离子的相对丰度存在明显差异。其中米格列奈的3个碎片离子相对丰度约为5∶6∶1,异构体杂质1的3个碎片离子相对丰度约为10∶5∶1,异构体杂质2和异构体杂质3的3个碎片离子相对丰度约为1.2∶1.3∶1。根据母离子的精确质量数以及各子离子的精确质量数,推断米格列奈的质谱裂解机理(见图4)。与文献[22]对比,米格列奈异构体1的色谱相对保留情况及各子离子丰度与米格列奈已知的一种位置异构体基本一致,因此推测米格列奈异构体1为米格列奈的位置异构体,根据该已知结构以及二级质谱数据,推断米格列奈异构体杂质1的质谱裂解机理(见图4)。异构体杂质2和异构体杂质3之前未见文献报道,且二者的一级质谱图及二级质谱图均无明显差异,因此本研究中未能确认其结构及质谱裂解机理。根据其m/z为190的碎片离子丰度明显高于米格列奈主成分及异构体杂质1这一现象,推测其可能的结构及裂解机理(见图4)。
2.3 方法的检出限、定量限、重复性和线性范围
将1.2节中的标准工作溶液逐级稀释,分别按1.4节中条件进行测定,以信噪比(S/N)大于3时的质量浓度为检出限,信噪比(S/N)大于10时的质量浓度为定量限,最终测得检出限为1 μg/L,定量限为2 μg/L。
将米格列奈质量浓度为100 μg/L的标准工作溶液连续进样6次,保留时间的相对标准偏差(RSD)为0.2%,峰面积的RSD为2.0%,可以满足分析要求。
将1.2节中的系列标准工作溶液分别按1.4节中的条件进行测定,以质量浓度为横坐标,以峰面积为纵坐标,进行线性回归,得到的线性回归方程为:Y=5.03×105X+1.09×107,相关系数(r2)为0.999 7,线性良好。然而对该线性拟合进行F检验,发现由于线性范围超过4个数量级,不同数量级对线性的贡献差异较大,导致低浓度存在失拟的情况,结果偏差较大。因此,采用分别将质量浓度与峰面积取对数的方法进行线性回归,得到的线性回归方程为:Y=0.977 2X+5.787 3,相关系数r2为0.999 9,线性良好。该取对数线性拟合F检验结果良好,在各浓度条件下结果偏差均较小,因此后续定量实验均采用取对数拟合线性方程进行计算。
2.4 异构体杂质来源的分析
将1.3节中的各破坏试验溶液,分别按1.4节中条件进行测定,采用主成分自身对照法,用2.3节中取对数得到的线性回归方程进行计算,从而得出3种异构体杂质的溶液浓度,以测定破坏试验所得3种异构体杂质含量,结果见表2。
由表2可见,除异构体杂质1在加热条件下含量明显增加外,其他条件下均未有异构体杂质含量显著变化的情况。说明异构体杂质1可由米格列奈加热降解得到,而异构体杂质2与异构体杂质3则在各破坏试验条件下稳定,因此考虑其为合成工艺杂质。此外,异构体杂质1的降解情况与文献[22]中米格列奈已知位置异构体的降解情况一致,结合2.2节内容可基本确认异构体杂质1为米格列奈位置异构体。
2.5 实际样品的测定
将各企业提供的米格列奈钙原料按1.2节配制成供试品溶液,并按1.4节中条件进行测定。采用主成分自身对照法,用2.3节中取对数得到的线性回归方程进行计算,得到各企业提供的米格列奈钙原料样品中3种异构体杂质的含量(见表3)。可以看出,各企业间异构体杂质1的含量存在明显差异,个别企业可达到0.1%;而各企业异构体杂质2和异构体杂质3的含量相差不大,且含量较低,均低于0.01%。

表 2 各破坏试验样品中3种异构体杂质的含量Table 2 Percentages of the three isomer impurities in the samples of different degradation tests

表 3 各企业米格列奈钙原料样品中3种异构体杂质的含量Table 3 Percentages of the three isomer impurities in the samples of the mitiglinide calcium raw material
3 结论
本文建立了可以实现米格列奈及其3种异构体分离的RPLC-MS方法,该方法线性良好,灵敏度高,可满足分析需求。同时利用高分辨质谱的精确质量数及碎裂情况对米格列奈及其异构体进行了分析,发现其碎片离子丰度存在明显差异,从而确认异构体杂质2和异构体杂质3为首次发现的异构体杂质,并对米格列奈及各异构体杂质可能的质谱裂解机理进行了推断。在此基础上,对异构体杂质来源进行了分析,发现异构体杂质1可在高温下降解产生,而异构体杂质2和异构体杂质3在各破坏试验中稳定,因此考虑其为合成杂质。对各企业原料进行测定,发现各企业异构体杂质含量存在一定差异。因此,在今后的工作中,对新发现的两种合成产生的异构体杂质进行进一步研究,可能对各企业改善其米格列奈原料合成工艺提供新的思路和方向。
