循环肿瘤细胞捕获方法的研究进展
2019-04-02刘路宽杨开广张丽华张玉奎
刘路宽, 杨开广, 梁 振, 张丽华*, 张玉奎
(1. 中国科学院大连化学物理研究所, 中国科学院分离分析化学重点实验室, 辽宁 大连 116023; 2. 中国科学院大学, 北京 100049; 3. 大连理工大学, 精细化工国家重点实验室, 辽宁 大连 116024)
循环肿瘤细胞(CTCs)是从原发肿瘤组织脱落并侵袭进入血液循环系统中的肿瘤细胞。CTCs能够通过血液循环系统转移至其他组织上并发展为转移灶,这是导致肿瘤转移的主要途径之一[1]。研究表明,血液中CTCs的数量与肿瘤的发生、发展和转移密切相关,因此在临床中可用于肿瘤的早期诊断,以及监测患者的疗效和复发情况[2]。同时,由于CTCs携带原发灶和转移灶信息,因此深入分析CTCs中的蛋白质、核酸等信息可以指导肿瘤患者用药,检测抗药性,以及调整治疗方案等[3]。因此,实现对血液中CTCs的捕获与检测具有十分重要的生物学和临床意义。然而,CTCs不仅在血液中含量极少,而且受血细胞等干扰极其严重,因此实现对CTCs的高选择性捕获极具挑战[4,5]。
为了有效捕获血液中的CTCs,现有方法从原理上可以分为3类:基于CTCs和血细胞尺寸、密度等差异的生物物理方法;依靠抗体与CTCs细胞表面抗原特异性亲和的生物亲和方法;模拟抗体-抗原原理的人工抗体方法。本文对上述方法进行了综述,并从捕获效率、捕获纯度和释放活性保持等方面进行了讨论。此外,还对CTCs捕获方法的发展趋势进行了展望。
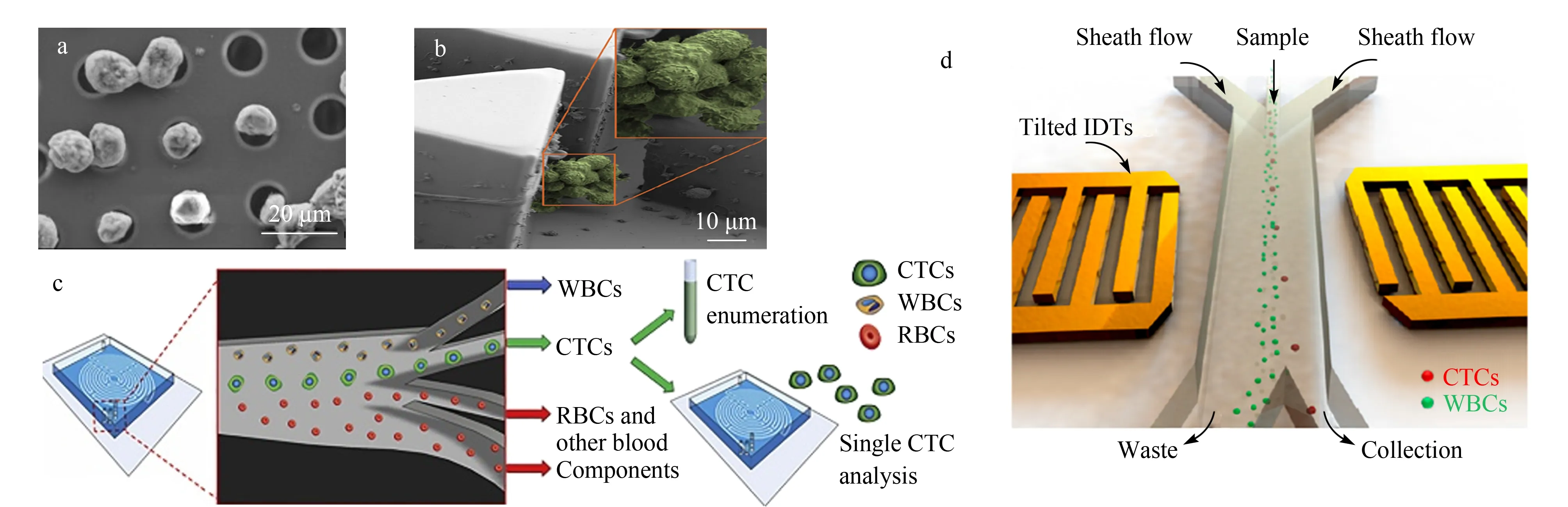
图 1 (a)微滤膜、(b)微滤芯片、(c)基于惯性聚焦技术的具有迷宫结构的微流控芯片和 (d)基于声波技术的微通道用于捕获CTCs的示意图[7,8,12,21]Fig. 1 Schematic diagrams of (a) microfiltration membrane, (b) microfiltration chip, (c) microfluidic chip with labyrinth structure based on inertial focusing technology and (d) microchannels based on acoustic technology for capturing (circulating tumor cells) CTCs[7,8,12,21] WBCs: white blood cells; RBCs: red blood cells; IDTs: interdigital transducer electrodes.
1 基于生物物理原理的CTCs捕获方法
基于生物物理原理的捕获方法是指利用CTCs与其他细胞在大小、密度、质量、电极性和声感性等的差异,采用过滤、离心、电泳、惯性聚焦、声波等方式实现分离。由于该方法不依赖于细胞表面的特异性抗原,被称为“无标记”方法。根据不同的生物物理性质,常用的方法主要可以分为以下几种。
1.1 基于尺寸的捕获
CTCs捕获的最大干扰成分是红细胞和白细胞等血细胞。红细胞的直径约为7.0~8.5 μm;白细胞的直径约为5.2~13.2 μm。一般来讲,CTCs的尺寸比血细胞大,例如乳腺癌细胞的直径约为13.1 μm;结直肠癌和前列腺癌细胞的直径约为11 μm;黑素瘤细胞的直径约为9~19 μm[6]。因此,采用微过滤技术,通过精确设定滤膜的孔径,能够滤过血细胞,而将CTCs捕获。目前过滤膜的加工方式主要包括径迹刻蚀技术和光刻影印技术。径迹刻蚀技术是通过正电荷轰击或化学刻蚀在聚碳酸酯膜上获得直径约为8 μm的孔。然而,该方法获得的孔径尺寸大小和分布不均匀,会导致膜孔堵塞和样品损失。针对此问题,Zheng等[7]采用光刻影印技术研制了一种新型的过滤膜(见图1a)。该膜的孔径为10 μm,孔径大小和分布均匀,CTCs的捕获效率达到90%。被捕获的细胞可被无损释放,并用于后续基因组分析。此外,为了特异性捕获成簇出现的CTCs, Sarioglu等[8]近期发展了一种基于微流控技术的三维微过滤芯片。如图1b所示,单独的CTCs能够从2个三角形柱中间通过,而成簇的CTCs则被三角形柱截留。
虽然基于细胞尺寸大小的CTCs捕获方法操作方便,对细胞损伤小,有利于后续分析,但是CTCs和白细胞在尺寸上存在交叉,容易造成部分白细胞被截留,捕获纯度(<10%)有待提高[5]。
1.2 基于密度的捕获
血液中血浆的密度为1.03 g/mL,红细胞的密度为1.10~1.15 g/mL,白细胞的密度为1.07~1.09 g/mL, CTCs的密度为1.7 g/mL[9]。Rosenberg等[10]采用密度梯度离心方式成功获得CTCs。然而基于密度的捕获方法很难消除白细胞的干扰,获得的CTCs纯度常常不足1%[5]。因此,常常作为过滤或抗体亲和等其他捕获方法的初步富集方法。
1.3 基于动力学的捕获
CTCs和白细胞大小和密度不同,导致其在运动过程中具有不同的惯性,质量相近的细胞可以通过惯性作用发生聚焦。因此可以通过设计微流控通道的尺寸、形状,以及控制细胞流速等方式实现分离[11]。如图1c所示,细胞在运动中受到的剪切梯度升力将其引导至通道壁,而壁效应升力又使细胞远离通道壁。通过优化惯性升力与迪安流之间的平衡,细胞能够在具有弯曲通道的微流控装置的层流中迁移。该方法的通量可以达到2.5 mL/min,捕获效率达到90%。获得的细胞悬液中,干扰白细胞的浓度为600个/mL[12]。虽然该方法对细胞的影响较小,捕获效率和纯度较高,但是由于同一肿瘤患者CTCs的异质性和不同肿瘤患者CTCs之间的明显差异,需要对通道进行个性化设计。
1.4 基于电极性的捕获
细胞可被看成一种电中性但能被极化的电介质粒子[13]。不同表型、生理状态和形态的细胞在电场中产生大小和方向均不同的偶极矩。当CTCs和血细胞处于空间不均匀的电场中时,二者受到的电动力不同,通过电旋转或双向电泳等方式可实现CTCs的捕获[14]。该方法在整个捕获过程中无物理接触或摩擦,保持了细胞活性,得到的细胞可以后续培养和分析[15]。然而该系统对CTCs的回收率有待提高[16,17]。
1.5 基于声感性的捕获
最新研究表明,以超声成像时采用的超声波强度与频率分离获得的细胞,能够保持良好的活性、功能和基因表达信息[18]。因此,将超声波引入CTCs的捕获与分离极具潜力[19,20]。如图1d所示,当两股声波相遇时,二者之间会形成驻波。驻波维持在微通道内的固定位置,产生压力节点。CTCs和血细胞之间大小、密度等属性的差异使二者形成不同的移动距离。因此,通过优化通道和声波的强度及频率,可以实现CTCs和血细胞的分离[21]。结果表明,该方法对宫颈癌Hela细胞和乳腺癌MCF-7细胞的回收率在83%以上。利用声波分离细胞是一种相对温和的方法,能够最大程度保持CTCs的原始状态、表型和基因型,然而该方法受环境因素影响较大,且通量有待提高。
综上所述,基于生物物理性质的CTCs捕获方法不依赖其表面抗原,最大程度降低了对细胞的损伤,可以为后续分析提供活性样本。然而CTCs和白细胞等血细胞在生物物理性质上具有一定重叠度,因此获得的CTCs纯度有待进一步提高。
2 基于生物亲和原理的CTCs捕获方法
CTCs具有肿瘤细胞的特征和组织来源标志物,如上皮细胞黏附分子(EpCAM)、细胞角蛋白质(CK)、癌胚抗原(CEA)和前列腺抗原(PSA)等[22]。基于生物亲和原理的CTCs捕获方法是将上述标志物的抗体固载于基质材料表面,基于抗体与标志物之间的特异性结合,实现CTCs的分离与捕获。由于基质材料的表面为抗体与细胞的结合提供微环境,因此对CTCs的捕获具有一定影响。目前,基于生物亲和原理的基质材料主要包括磁珠、微流控芯片和具有微纳米结构的材料等[23]。
2.1 基于免疫磁珠的捕获
免疫磁珠法是目前使用最广泛且最成熟的CTCs捕获方法。通过将带有羧基、氨基、生物素等修饰的Anti-EpCAM抗体与相对应带有氨基、羧基、亲和素等修饰的磁球进行耦合反应,形成对CTCs具有特异性捕获能力的免疫磁珠。基于免疫磁珠的CellSearch®系统是第一个获得了临床验证的CTCs检测系统。该系统在外磁场存在时,通过免疫磁珠捕获细胞后,可以对CTCs进行免疫荧光鉴定并计数[24,25]。由于患者血液中的CTCs数量会随着病情和治疗情况发生变化,因此CellSearch®系统能够用于监测肿瘤患者病情,为其预后和确定治疗方案提供依据。但是,CellSearch®系统获得的CTCs难以无损释放。为解决该问题,研究人员开发了一种MagSweeper系统[26]。该系统利用磁性棒捕获CTCs与免疫磁珠的复合物,并利用磁性棒运动产生的切变力洗脱血细胞,最后通过去除电磁场得到CTCs与免疫磁珠的复合物。利用该技术,研究人员构建了能够收集前列腺癌患者血液中的CTCs,并进行外显子组测序和模块化分析的新技术平台。
2.2 基于免疫微流控芯片的捕获

图 2 (a)CTC-Chip、(b)HB-Chip、(c)CTC-iChip和(d)金纳米颗粒修饰的HB-Chip用于捕获CTCs的示意图[31,34,36,38]Fig. 2 Schematic diagrams of (a) CTC-Chip, (b) HB-Chip, (c) CTC-iChip and (d) gold nanoparticle-modified HB-Chip for capturing CTCs[31,34,36,38] PLTs: platelets; AuNPs: gold nanoparticles; PDMS: polydimethylsiloxane; NHS: N-hydroxysuccinimide; GSH: glutathione; EpCAM: epithelial cell adhesion molecule.
微流控芯片是通过微加工技术,在硅片、玻璃、聚二甲基硅氧烷等材料上制备得到的具有微米级结构和特定功能的小型化、自动化实验平台。微流控芯片尺寸和细胞尺寸匹配,因此近年来被成功用于捕获CTCs[27-30],其基本策略是在芯片内部的微通道或微结构上修饰能够与靶细胞特异性结合的抗体,当血液流经微通道时,CTCs会被抗体特异性结合在芯片内部通道或结构上。被捕获的CTCs可以直接在芯片内进行计数与检测,也可以洗脱后收集进行后续分析。主流的免疫微流控芯片技术大致可以分为3个发展阶段。2007年,Nagrath等[31]设计了第一代用于CTCs捕获的微流控装置(CTC-Chip)。如图2a所示,该芯片由78 000个表面经过抗体修饰的微柱组成。通过优化微柱的尺寸和排列以及液体的流速和流向,细胞与抗体微柱的接触概率与黏附能力增强,但是得到的CTCs的纯度仅为50%。为进一步降低白细胞的干扰,研究人员通过优化CTC-Chip芯片中微柱的几何组合,并引入流体动力学色谱方法,制备了几何增强差异型免疫捕获芯片[32]。通过尺寸筛选,进一步降低了白细胞的干扰;该芯片捕获到的同一临床样本中CTCs的数量是CellSearch®系统的2~400倍[33]。基于抗体修饰微柱的微流控芯片虽然提高了对CTCs的捕获效率,但是难以用于较大规模的临床研究。因此在CTC-Chip的基础上,Stott等[34]开发了第二代基于小室流动槽的微流控芯片(HB-Chip)。如图2b所示,该微流控芯片由人字形交叉沟槽结构组成。血液样本在流经芯片时会形成微漩涡,增加了细胞与芯片表面抗体的接触机会,提高了CTCs的捕获效率和样品处理通量。结果表明,HB-Chip对CTCs的捕获能力可以达到90%。Yu等[35]采用HB-Chip芯片对乳腺癌患者CTCs在上皮-间质转变过程中的特征进行了分析。近期,Karabacak等[36]将免疫磁珠和微流体分选技术整合于微流控芯片中,成为第三代免疫微流控芯片(CTC-iChip),其原理见图2c。首先利用鹅卵形微柱去除CTCs和白细胞之外的其他血液成分;其次利用正弦通道结构使细胞鱼贯通过,实现精确和快速的分选;最后,被免疫磁珠捕获的CTCs,通过磁场分选,实现了CTCs的捕获。该芯片的处理速度可以达到每秒一百万个细胞,对CTCs的回收率可以达到80%以上,因此临床应用性更强。Nanus等[37]采用CTC-iChip对前列腺癌患者的CTCs在单细胞水平上进行了基因表达谱分析。结果表明,只有1/6的CTCs会共表达一种以上的雄激素受体剪接变异体,颠覆了以往对CTCs同时表达多种变异体的认知。
虽然上述技术可以成功地捕获和检测CTCs,但细胞被捕获在芯片表面,难以释放。为了解决该问题,如图2d所示,Park等[38]将金纳米颗粒引入HB-Chip中,利用谷胱甘肽破坏巯基和金纳米颗粒之间的相互作用,实现了CTCs的释放。另外,由于在芯片中引入了纳米颗粒,芯片表面具有更大的比表面积,从而利于修饰更多的抗体,以提高捕获效率。

图 3 (a)具有微/纳米棒阵列的电子聚合物、(b)具有纳米森林的穿刺针、(c)三维氧化石墨烯水凝胶、(d)氧化石墨烯修饰花形 微流控芯片、(e)硅纳米柱修饰人字形通道微流控芯片和(f)温敏性修饰芯片用于CTCs捕获的示意图[42,43,45-48]Fig. 3 Schematic diagrams of (a) electronic polymer with micro/nano rod array, (b) puncture needle with nanopolymers, (c) three-dimensional graphene oxide hydrogel, (d) graphene oxide modified and flower-patterned microfluidic chip, (e) silicon nanonanopillar-modified herringbone microfluidic chip and (f) temperature sensitivity chip for capturing CTCs[42,43,45-48] NIR: near infrared; NSCLC: non-small cell lung cancer.
2.3 基于抗体修饰的具有微纳米结构材料的捕获
作为人工细胞外基质,微纳米结构能够促进细胞黏附、细胞组织形成、细胞与基质和细胞之间相互作用、细胞增殖分化以及天然细胞外基质的形成[39-41]。因此,结合生物亲和与微纳米结构既有利于提高抗体的接枝量,又有利于增加细胞与材料表面的接触概率,进而提高CTCs的捕获与分离能力。
如图3a所示,Hsiao等[42]在生物电子聚合物表面构建了微/纳米棒阵列;通过优化结构的尺寸和表面特性,并经进一步修饰抗体,成功应用于CTCs的捕获,捕获效率超过70%。为进一步提高捕获效率,研究人员在穿刺导线表面修饰大量纳米材料后,将Anti-EpCAM抗体修饰在材料表面(见图3b)。当含有穿刺导线的穿刺针插入患者体内后,利用人体的血液循环,在30 min内即可实现对CTCs的体内捕获[43]。该技术已被成功用于乳腺癌和非小细胞肺癌患者的CTCs检测[44]。
石墨烯材料由于具有高比表面积和良好的生物兼容性,在生物传感、药物载体等领域应用广泛。近年来,研究人员构建了多种石墨烯材料,并用于捕获CTCs。如图3c所示,Li等[45]将石墨烯掺杂在水凝胶中,制备了抗体修饰的三维氧化石墨烯聚合物水凝胶。不仅能够实现CTCs的捕获,而且还能够通过近红外激光的刺激使石墨烯吸收热量,进而实现CTCs的释放。
虽然具有微纳米结构的材料在CTCs捕获方面表现出了优异的性能,但上述方法一般采用静态孵育使CTCs与抗体结合。近期,研究人员进一步将该材料与微流控芯片结合起来。如图3d所示,Wang等[46]将硅纳米柱与人字形微流控芯片相结合,实现了对乳腺癌患者CTCs的捕获与分离。其中,硅纳米柱具有较大的比表面积与粗糙度,有利于提高抗体的固载量,并促进CTCs的黏附;人字形结构使血液在芯片内形成涡流,有利于提高CTCs与硅纳米柱表面抗体的接触概率,从而提高捕获效率。氧化石墨烯芯片也被开发出来用于CTCs的捕获。这种简化的表面捕获装置结构更适合大规模生产并可以在更高流速下使用。如图3e所示,氧化石墨烯芯片主要由58 957个花形图案的金表面及有Anti-EpCAM抗体修饰的氧化石墨烯纳米片组成。该图案化的金表面有利于促进CTCs捕获,而对非靶细胞的捕获效率小于10%[47]。利用该芯片,从转移性乳腺癌、胰腺癌和早期肺癌患者中成功分离出CTCs。为了进一步解决CTCs释放的问题,Ke等[48]和Rahong等[49]将抗体修饰的温敏性纳米纤维引入微流控芯片,通过控制温度变化实现捕获与释放CTCs。如图3f所示,在37 ℃时,血液通过芯片聚合物刷收缩,CTCs被黏附在纳米纤维表面,捕获效率介于40%~90%之间;当温度降至4 ℃时,聚合物刷舒展将被捕获的CTCs释放。该芯片有望用于监控肿瘤预后,指导肿瘤治疗。
综上所述,相较于基于生物物理原理的捕获技术,特异性靶向CTCs的生物亲和方法均能得到较高的捕获纯度,但是由于CTCs在血液中经历上皮细胞向间质细胞的转化过程,抗原性丢失,导致得到的CTCs样本出现假阴性。此外,由于抗体与细胞结合常数过高,会增加CTCs无损释放的难度。
3 基于人工抗体的CTCs捕获方法
人工抗体是通过模拟抗体-抗原相互作用机理,以分子识别为基础、能够与靶标分子特异性结合的人工合成材料,包括适配体、特异性多肽和分子印迹材料[50],其既具有与抗体相当的结合常数,又具有成本低、稳定性好、易化学合成和修饰等优势,已在小分子药物、环境污染物、多肽和蛋白质识别与分离中得到广泛应用。虽然人工抗体在CTCs捕获方面尚处于起步阶段,但是已经显示出良好的应用前景。
3.1 基于适配体的捕获
适配体是人工合成与筛选的能够与靶标分子高特异性和高亲和力结合的单链DNA或者RNA寡核苷酸。在CTCs捕获领域常使用的适配体包括两类。一类是基于细胞表面特异性表达的抗原筛选的适配体。主要针对表皮生长因子受体(EGFR)和EpCAM等常见的肿瘤标志物。如Wan等[51]将与EGFR结合的适配体引至微流控装置中。当CTCs细胞液流经通道时,可对其高特异性的捕获,再利用RNA互补链实现被捕获细胞的释放及下游分析。另一类是基于完整细胞筛选的适配体[52,53]。该类适配体不依赖细胞表面的某一种特定标志物,以整个细胞为靶标进行筛选,能够在一定程度上避免基于细胞表面标志物筛选到的适配体带来的假阴性鉴定结果,具有更为广泛的应用前景。
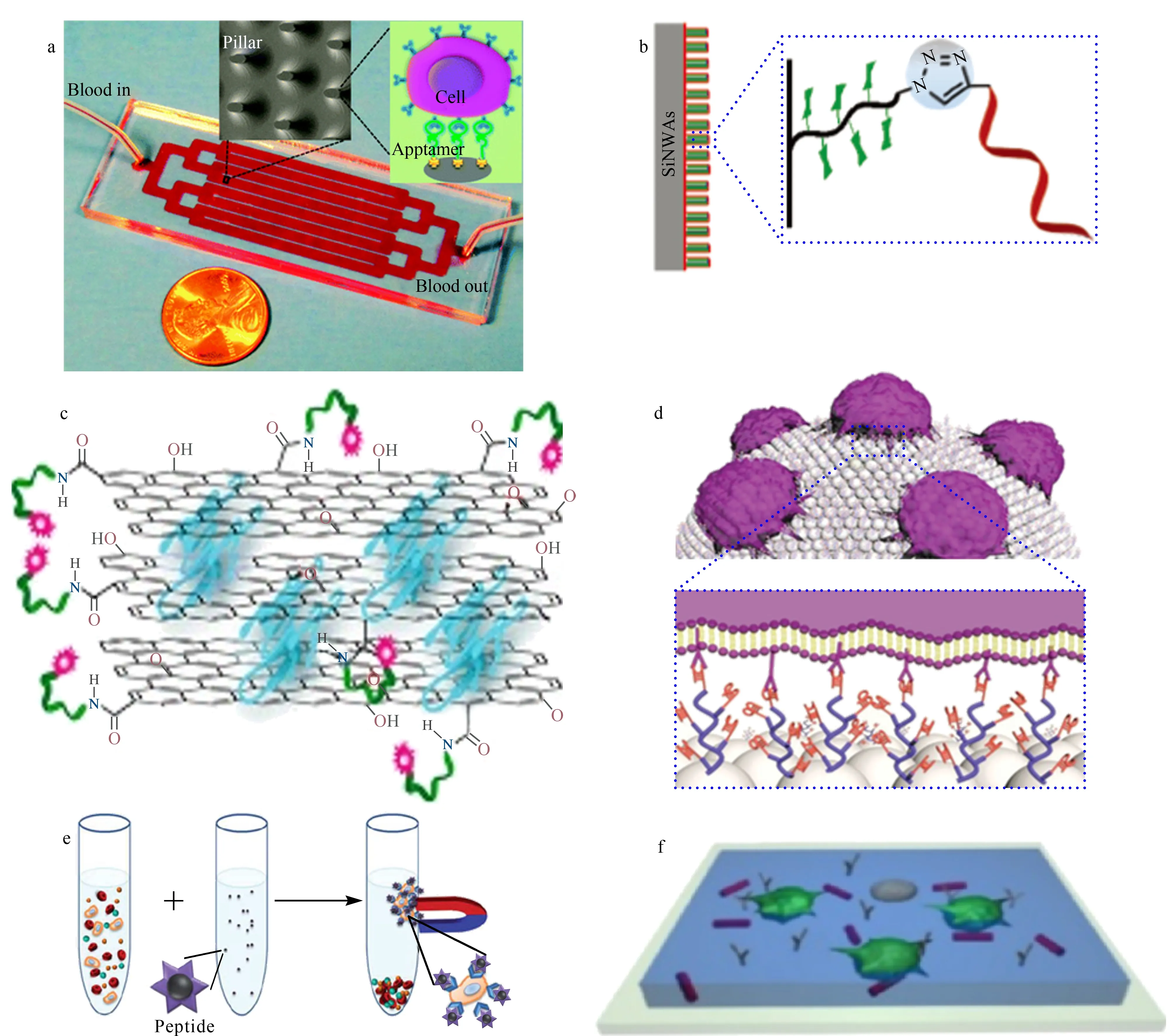
图 4 (a)适配体功能化微流控芯片、(b)TD05适配体修饰的硅纳米线、(c)多种适配体修饰的二维氧化石墨烯膜、(d)适配体修饰的 条码颗粒、(e)特异性多肽修饰的纳米磁球和(f)表面修饰有抗体的细胞印迹材料用于捕获CTCs的示意图[55-59,63]Fig. 4 Schematic diagrams of (a) aptamer-functionalized microfluidic chip, (b) TD05 aptamer modified silicon nanowire, (c) multiple aptamer modified two-dimensional graphene oxide film, (d) aptamer-modified barcode particles, (e) peptide-modified magnetic nanoparticles and (f) cell-imprinted material with antibody modification for capturing CTCs[55-59,63] SiNWAs: silicon nanowire arrays. TD05 aptamer: RAMOS cell-specific aptamer.
基于适配体的CTCs捕获方法主要将适配体固定在基质材料表面上,以实现CTCs的特异性分离。目前常用的基质材料为微流控芯片和具有微纳米结构的材料。Liu等[54]将人急性白血病T淋巴细胞的适配体Sgc8修饰在微流控芯片通道上,实现了靶细胞的高效捕获。Sheng等[55]对微流控芯片进行了优化设计,如图4a所示,成功实现了血液中CTCs的捕获,而且捕获到的靶细胞中93%仍具有活性,可以用于后续的分析与表征。相较于阵列型微纳米结构,纳米线或纳米纤维具有更高的比表面积和粗糙度。如图4b所示,Xue等[56]采用表面引发的单电子转移自由基聚合和点击化学方法,在硅纳米线表面修饰了N-丙烯酰基葡萄糖胺和对人B淋巴细胞瘤RAMOS细胞具有特异性亲和能力的TD05适配体,利用二者的协同作用,实现了CTCs的高效捕获。如图4c所示,Viraka Nellore等[57]采用旋转涂膜技术,制备了孔径在20~40 μm的多孔氧化石墨烯膜。将分别对人表皮生长因子受体-2(HER2)、前列腺特异膜抗原和癌胚抗原具有特异性亲和能力的S6、A9和YJ-1适配体修饰在氧化石墨烯表面,血细胞能够被过滤,而CTCs被适配体捕获于表面,捕获效率可以达到95%。为了同时实现多种类型CTCs的捕获与检测,Zheng等[58]开发了一种能够捕获、检测和释放多种类型CTCs的新型条码颗粒。如图4d所示,该颗粒由球形胶体晶体簇组成,其表面修饰有支化放大的适配体探针。该颗粒的编码区具有特异性的反射峰,能够同时实现CTCs的捕获与检测。但是该方法对靶细胞的捕获效率和选择性易受纳米颗粒非特异性吸附影响。
综上所述,结合适配体和微纳米结构的优势,开发新型的适配体功能化的微纳米材料在CTCs捕获中具有十分重要的应用前景。
3.2 基于特异性多肽的捕获
特异性多肽是人工筛选得到的对目标分子具有特异性结合能力的肽段。因为蛋白分子识别过程主要由接触界面处的多肽参与,所以特异性多肽在配体-受体和蛋白质-蛋白质相互作用中起关键作用。如图4e所示,Bai等[59]将对EpCAM具有特异性识别能力的多肽修饰在磁珠表面,成功实现了EpCAM阳性CTCs的捕获,捕获效率达到90%,捕获纯度超过93%。Peng等[60]采用相同的方法将对HER2具有特异性识别能力的多肽修饰在磁珠表面,成功实现了HER2阳性CTCs的捕获。目前,特异性多肽的结合力与抗体相比仍较低,结合常数约为抗体的10%,如能进一步提高多肽与CTCs的结合力,基于特异性多肽的CTCs捕获技术将会有更广阔的应用前景。
3.3 基于分子印迹的捕获
分子印迹技术是一项以目标分子为模板的人工抗体制备技术。该人工抗体具有能够与目标分子特异性结合的印迹位点,具有广泛的适用性和可定制性。分子印迹技术最初用于小分子分离,现已扩展至复杂体系中蛋白质的纯化、髙丰度蛋白质的去除,以及病毒和细菌的分离鉴定[61,62]。
由于CTCs较常见的小分子和蛋白质尺寸更大,结构更复杂,利用印迹技术对其进行捕获,需要考虑更多因素,例如细胞大小、形状、稳定性和活性等;靶标细胞表面的复杂度使特异性结合分子的筛选面临挑战;靶标细胞的脆弱性导致其温和释放较为困难。因此针对CTCs的细胞印迹技术研究鲜有报道。
如图4f所示,Lv等[63]制备了表面修饰有抗体的细胞印迹材料,成功实现了血液中CTCs的特异性捕获与检测,然而对CTCs的捕获效率仅不足40%。本课题组通过设计细胞印迹位点的形状与结构,得到了空间结构、形貌和化学性质与细胞表面更为匹配的细胞印迹材料,对CTCs的捕获效率提高至70%[64]。尽管细胞印迹材料在CTCs捕获中的应用较少,但是作为一种融合形状匹配和化学识别的亲和技术,分子印迹技术的通用性更强,在CTCs捕获的研究中具有十分重要的应用前景。
综上所述,近几十年来,研究人员开发了多种CTCs捕获方法(见表1),并成功实现了血液中CTCs的捕获和鉴定,发现CTCs的数量与肿瘤的发生、发展与预后密切相关。

表 1 常见的CTCs捕获方法Table 1 Common CTCs capture methods
+ The levels of each capture characteristic in different CTCs capture methods; -: no data.
4 结论与展望
作为肿瘤诊疗的有效途径之一,研究人员不断深入研究CTCs的分子特征、生物功能以及临床应用等,进而对CTCs捕获方法提出了更高的要求。因此,未来的CTCs捕获方法需同时满足更高的捕获效率、选择性和回收率,从而保证后续分析具有充足的样本;需保证被捕获细胞能够无损释放,从而用于后续细胞活性和药敏性评价;需具有通用性,从而降低临床应用的假阳性和假阴性结果。随着现代分离分析技术的发展和对CTCs认识的不断深入,CTCs分离和捕获的特异性将不断提高,特别是捕获、释放和检测分析一体化方法的建立,将有助于推动CTCs从基础研究到临床应用的进一步转化。
