溶菌酶分子印迹聚合物膜的制备及其吸附性能
2019-04-02李园园陈炜杰刘红阳孙立权罗爱芹
李园园, 张 鑫, 陈炜杰, 刘红阳, 孙立权, 罗爱芹
(北京理工大学, 北京 100081)
分子印迹技术(molecularly imprinting technique, MIT)起源于“抗原-抗体”学说,其识别机理与“锁钥原理”相似[1]。分子印迹聚合物(molecularly imprinted polymers, MIPs)的制备过程是,模板分子与功能单体先通过共价键、氢键、分子间作用力等作用力形成“模板-功能单体复合物”,再在交联剂的作用下聚合成空间三维结构,最后将模板分子去除,在聚合物内形成与模板分子形状、大小、官能团互补的印迹空穴[2-4]。制备得到的分子印迹聚合物具有较好的稳定性、便捷性,并且具有特异的识别能力[5]。因此,分子印迹技术已经广泛应用到分离、催化、生物医药等领域[6-8]。
膜分离技术是指借助膜的选择渗透作用,在能量或化学位差的推动下对混合物中溶质和溶剂进行分离、分级、提纯和富集[9]。分子印迹膜技术是将分子印迹技术和膜分离技术相结合,因此,分子印迹聚合物膜(molecularly imprinted polymers membranes, MIMs)兼具了二者易于分离、能耗低的优势,其制备方法与传统的印迹方法相比,可避免研磨、筛分等繁琐程序[10-14]。现已有大量文献报道了分子印迹膜在生物分离、分析方面的良好应用。例如,丘秀珍等[15]以多巴胺为模板,多孔阳极氧化铝膜为反应载体,合成了分子印迹聚合物膜,其吸附平衡时间为60 min,最大吸附容量为82.1 μmol/g,对模板分子的印迹因子为2.1,该方法简便、快速、选择性高,适用于检测人体尿液中的儿茶酚胺类药物的含量。吕春晖等[16]以恩诺沙星分子为模板制备了印迹聚合物膜,其高亲和位点的最大吸附量为12.98 μg/mL,吸附平衡时间为60 min,可分析检测恩诺沙星在食品中的残留。Jahanshahi等[17]以2,4-二氯苯氧乙酸为模板分子制备了分子印迹聚合物膜,对模板分子选择性因子为12.96,吸附平衡时间为60 min,吸附量为34.57 mg/g,可用于选择性识别和分离水溶液中的2,4-二氯苯氧乙酸。Kong等[18]以双酚A为模板分子制备了印迹聚合物膜,其吸附平衡时间为30 min,对模板分子具有特异识别能力,可用于双酚A的痕量检测。
目前分子印迹聚合物膜存在结合位点少、吸附平衡时间长、吸附量小等问题。本文结合分子印迹技术和膜分离技术,以溶菌酶为模板蛋白质,利用原位聚合法在硅烷化的基质玻片上成功制备了溶菌酶分子印迹聚合物膜,解决了印迹聚合物膜结合位点少的问题,制备的印迹聚合物膜对溶菌酶具有较快的吸附速率、较高的吸附效率、良好的识别能力。
1 实验部分
1.1 仪器、试剂与材料
紫外分光光度计(UV-1800,日本岛津公司,日本);台式恒温振荡器(TIIZ-D,太仓市实验设备厂);电热恒温鼓风干燥箱(DH101-1BS,天津市中环实验电炉有限公司);超声波清洗器(KQ5200,昆山市超声仪器有限公司)。
溶菌酶(Lyz,Mr1.44 kDa, pI 11.2,生物技术级)、卵清蛋白(OVA,Mr4.5 kDa, pI 4.7,纯度98%)、人血清白蛋白(HSA,Mr6.6 kDa, pI 4.6,纯度99.5%)均购自原叶生物有限公司;丙烯酰胺(AAm,分析纯)购自天津化学试剂研究所;N,N′-亚甲基双丙烯酰胺(MBA,分析纯)、过硫酸铵(APS,分析纯)均购自北京化学试剂公司;γ-甲基丙烯酰氧基丙基三甲氧基硅烷偶联剂(KH570,化学纯)购自曲阜晨光化工有限公司;四甲基乙二胺(TEMED,纯度>99%)购自北京梦怡美生物科技有限公司;十二烷基磺酸钠(SDS,化学纯)购自西陇化工股份有限公司;乙酸(AA,分析纯)购自北京市通广精细化工公司;十二水磷酸氢二钠(分析纯)、二水磷酸二氢钠(分析纯)、甲苯(分析纯)、三乙胺(分析纯)均购自北京化工厂;聚对苯二甲酸乙二酯板片(PET薄膜)购自广州钰新材料有限公司;鸡蛋购自北京理工大学菜市场。
1.2 溶菌酶印迹聚合物膜的制备
1.2.1基质材料的准备
基质材料处理过程如下:将载玻片制成1.0 cm×1.5 cm大小,用去离子水和无水乙醇反复清洗,氮气吹干;用浓硫酸-过氧化氢水溶液(85∶15, v/v)的混合溶液浸泡3 h后,用去离子水和无水乙醇反复清洗,氮气吹干;最后,将上述基质玻片浸入4 mL KH570、0.4 mL三乙胺和100 mL甲苯的混合溶液中反应12 h,获得的玻片用甲苯反复冲洗后氮气吹干,室温下密封保存备用。
1.2.2溶菌酶分子印迹聚合物膜的制备
溶菌酶分子印迹聚合物膜的制备过程如下:首先,精准称取10 mg Lyz、550 mg AAm于4 mL磷酸缓冲溶液(pH=6.0, 40 mmoL,下同)中,超声溶解后加入10 mg交联剂MBA,反应30 min,再加入4 mg APS、10 μL TEMED,完全溶解后得到预聚合溶液;其次,将60 μL的预聚合溶液小心滴加于硅烷化的基质玻片上,待到溶液均匀铺平后,用PET膜覆盖,在室温下聚合24 h后,去除PET膜片,获得溶菌酶印迹聚合物膜(MIP);最后,将MIP浸入体积分数为10%的AA与质量分数为1%的SDS混合水溶液中,振荡洗脱去除模板蛋白质,用去离子水振荡洗涤多次,直至洗涤水pH呈中性。为了进一步研究印迹过程对Lyz吸附的影响,实验还制备了非印迹聚合物膜(non-imprinted polymer, NIP)作为对照,NIP的制备除不加入模板蛋白质Lyz之外,其余步骤同上。
1.3 吸附动力学实验
在室温条件下,分别将MIP、NIP放入Lyz标准溶液中进行孵育,每隔一段时间测定溶液的紫外吸光度,记录并计算MIP、NIP在不同时间对Lyz的吸附量。
用磷酸缓冲溶液配制质量浓度为200 μg/mL的Lyz标准溶液,然后分别将MIP、NIP置于其中孵育,每隔一段时间测定溶液的紫外吸光度,记录并计算MIP、NIP在不同时间对Lyz的吸附量。
1.4 吸附等温线实验
用磷酸缓冲溶液分别配制质量浓度范围在0到700 μg/mL的Lyz标准溶液(0、50、100、200、300、400、500、600、700 μg/mL),然后分别将MIP、NIP置于溶液中孵育,使用紫外分光光度计记录不同溶液的紫外吸光值,计算在不同溶液中MIP对Lyz的最大吸附量。Lyz吸附量使用公式(1)计算:
Q=(A0-A)·V/(k·M)
(1)
式中,Q是聚合物对模板蛋白质的吸附容量(mg/g),A0是标准溶液初始吸光度,A是标准溶液用聚合物吸附后的吸光度,V是吸附溶液的体积(mL),k是模板蛋白质标准曲线的斜率(mL/μg),M是聚合物的质量(g)。
1.5 吸附选择性实验
用磷酸缓冲溶液分别配制一系列不同质量浓度的Lyz、HSA、OVA标准溶液。分别将MIP、NIP置入不同浓度的蛋白质标准溶液中孵育。利用紫外分光光度计测定溶液的紫外吸光度,计算MIP、NIP对Lyz、HSA、OVA的最大吸附量。采用印迹因子(IF)评价聚合物膜的识别特异性:
(2)
式中,QMIP和QNIP分别为MIP、NIP对蛋白质的吸附容量(mg/g)。
1.6 溶菌酶分子印迹聚合物膜的重复使用性测定
将MIP放入质量浓度为200 μg/mL的Lyz标准溶液中吸附5 min,使用紫外分光光度计检测Lyz吸光值。然后用1.2.2节中的洗脱方法将Lyz洗脱后再次进行吸附,重复此步骤5次。
1.7 聚合物膜用于实际样品
选用鸡蛋清作为蛋白质源来考察聚合物膜在实际样品中对目标蛋白质的吸附能力。首先取鸡蛋清上清液,稀释200倍,对其进行全波段扫描后,将MIP、NIP置于样品溶液中进行吸附实验。吸附平衡后,对样品溶液再次进行全波段扫描,观察样品溶液中Lyz特征吸收峰的变化,根据公式(1)计算吸附量。
2 结果与讨论
2.1 分子印迹聚合物膜的制备
MIP的制备过程如图1所示。具体如下:用浓硫酸和过氧化氢水溶液处理载玻片,既可除去杂质,又可使其表面羟基化;经KH570、三乙胺和甲苯的混合溶液反应后,羟基化的玻片表面进一步接枝双键,有利于聚合物膜固定以及模板蛋白的结合。在此基础上,以Lyz为模板蛋白质,AAm为功能单体,MBA为交联剂制备MIP。
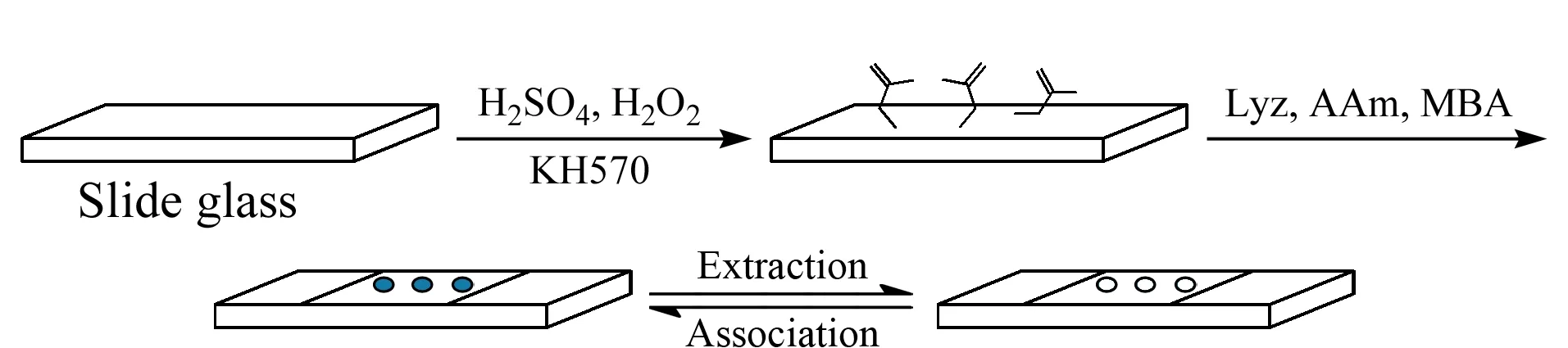
图 1 溶菌酶印迹聚合物膜的制备过程Fig. 1 Preparation of lysozyme-imprinted polymer membrane KH570: silane coupler; Lyz: lysozyme; AAm: acrylamide; MBA: N,N′-methylene bisacrylamide.
2.2 印迹体系的优化
2.2.1功能单体
功能单体的用量是影响印迹聚合物吸附性能的重要因素。本实验考察了AAm的用量对MIP吸附性能的影响,所得结果如图2所示:随着AAm用量的增加,制备的MIP对Lyz的吸附量增大,当AAm的用量为550 mg时,其吸附量最大,以后随着AAm的增加其吸附量反而有所降低,这表明功能单体AAm的最优用量为550 mg。
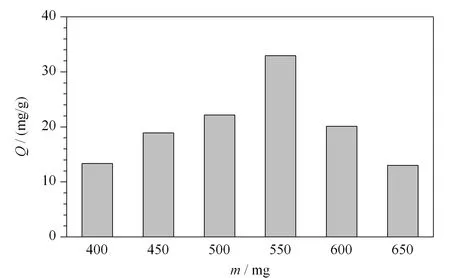
图 2 功能单体用量对溶菌酶印迹聚合物吸附量的影响Fig. 2 Effect of the amount of functional monomer on the adsorption capacity of lysozyme-imprinted polymer membrane

图 3 交联剂用量对溶菌酶印迹聚合物吸附量的影响Fig. 3 Effect of the amount of crosslinking agent on the adsorption capacity of lysozyme-imprinted polymer membrane
2.2.2交联剂
交联剂的基本作用是固定客体的键合点,使之处于牢固的三维结构中。在本实验中,固定AAm的用量为550 mg,考察了不同用量的交联剂对MIP吸附性能的影响。由图3可知,随着交联剂用量的增加,MIP对模板分子的吸附量呈现先增大后减小的趋势,当交联剂的用量为10 mg时,其吸附量达到最大值。这是因为当交联剂用量过少时,所形成的MIP过低,从而导致吸附量降低;但当交联剂用量过多时,形成的MIP过大,导致Lyz分子识别位点减少,MIP吸附效果较差。
2.3 吸附动力学曲线的测定
实验对制备的聚合物膜的吸附平衡时间进行了考察。如图4所示,在Lyz质量浓度为200 μg/mL时,MIP的吸附量随着时间增加,在起初的5 min内,吸附量快速增加,5 min之后,吸附达到平衡,吸附量为23 mg/g; NIP对模板蛋白质的吸附平衡时间较长,在11 min时达到吸附平衡,吸附量为8 mg/g,与MIP相差较大。相对NIP, MIP达到吸附平衡所用的时间更短,吸附速率更快。这主要是因为在MIP上具有能特异结合Lyz的印迹位点,所以结合速率更快,吸附量更大。

图 4 溶菌酶质量浓度为200 μg/mL时聚合物膜的吸附动力学Fig. 4 Absorption kinetic curve of polymer membrane at lysozyme concentration of 200 μg/mL
2.4 吸附等温线的测定
实验进一步考察MIP对Lyz的吸附能力。Lyz的质量浓度在0到700 μg/mL的范围内,测定了MIP、NIP的吸附等温线。一般来说,对吸附能力进行评价时,最常用的模型是Langmuir吸附方程和Freundlich吸附方程[19,20],将实验数据分别对两种方程进行拟合。结果表明,MIP更符合Langmuir吸附方程,公式如下:
(3)
式中,Q和Qmax分别是聚合物对模板蛋白质的实验吸附容量(mg/g)和最大理论吸附容量(mg/g),Ce为吸附平衡后溶液中蛋白质的质量浓度(mg/mL),K为聚合物对模板蛋白质吸附的Langmuir吸附平衡常数(mL/mg)。

图 5 溶菌酶印迹聚合物膜的吸附等温线Fig. 5 Adsorption isotherms of lysozyme-imprinted polymer membrane
以Q对Ce作图得到MIP的吸附等温线,如图5所示。采用Langmuir吸附模型进行数据拟合,得到的拟合曲线具有较好的拟合度(R2=0.9665)。由拟合结果可知,MIP对Lyz的理论最大吸附量是42.5 mg/g。
2.5 吸附选择性的考察
为了评价MIP对Lyz的特异性识别能力,选用HSA、OVA作为参照蛋白质,分别考察了MIP、NIP对3种蛋白质的吸附情况。由图6可知,MIP对Lyz最大吸附量是32.9 mg/g,远高于其对HSA(10 mg/g)、OVA(9 mg/g)的吸附量。NIP对Lyz、HSA、OVA的吸附量均不高。MIP对模板分子的印迹因子为3.0,明显高于对HSA、OVA的印迹因子,这是由于HSA、OVA与Lyz的结构、等电点不同,与MIP的印迹位点不匹配,所以MIP对这两种参照蛋白的结合量少,而对Lyz表现出了高选择性。而NIP不存在特异性空穴,所以对3种蛋白质的吸附量相差不大。
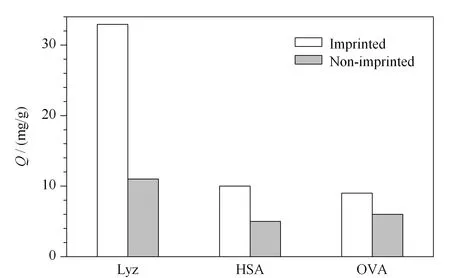
图 6 溶菌酶印迹聚合物膜的选择性吸附Fig. 6 Selective adsorption of lysozyme-imprinted polymer membraneHSA: human serum albumin; OVA: ovalbumin.

图 7 溶菌酶印迹聚合物膜的重复使用性Fig. 7 Reusability of the lysozyme-imprinted polymer membrane
2.6 重复性实验
为了考察MIP的重复使用能力,对其进行批次吸附实验,结果如图7所示。随着使用次数的增多,MIP对Lyz的吸附量略有降低,使用5次之后,吸附量由32.9 mg/g降到31.2 mg/g,下降了5%。这说明MIP表面具有均匀、稳定的刚性结构,其在反复振荡、洗脱过程中,吸附位点损失较少。总体看来,MIP具有良好的重复使用性。
2.7 聚合物膜用于分离实际样品中的模板蛋白质
实验选用鸡蛋清为样品,对制备的聚合物膜的实际应用能力进行了考察。由图8可观察到,用MIP、NIP对实际样品进行吸附实验后,Lyz的特征吸收峰峰值由0.618分别降低到0.595和0.609,根据公式(1)分别计算出MIP、NIP对Lyz的吸附量为30和12 mg/g。结果表明,相对NIP, MIP在实际样品中有良好的吸附效果,可用于实际样品中目标蛋白质的分离。

图 8 聚合物膜吸附鸡蛋清样品中溶菌酶的光谱图Fig. 8 Spectrum of lysozyme adsorption by polymer membrane from egg white a. the egg white before adsorption; b. the egg white after adsorption by non-imprinted polymer; c. the egg white after adsorption by imprinted polymer.
3 结论
本文以溶菌酶为模板蛋白质,丙烯酰胺为功能单体,N,N′-亚甲基双丙烯酰胺为交联剂,制备了溶菌酶分子印迹聚合物膜。结果表明,制备的印迹聚合物膜的吸附特征符合Langmuir吸附方程,实际最大吸附量为32.9 mg/g,吸附平衡时间为5 min,印迹因子为3.0。本实验采用的原位聚合法增强了聚合物的柔韧性及力学性能。因此,本实验制备的蛋白质分子印迹膜还可以进一步推广应用于生物样品中其他蛋白质的高效分离。
