维生素C抗氧化-同位素内标稀释-超高效液相色谱-串联质谱同时测定新生期大鼠海马体神经递质的含量
2019-04-02邝洪轩张海彬谭建华雒亦凡刘舒华庞启华李楚华范瑞芳
邝洪轩, 张海彬, 谭建华, 雒亦凡, 刘舒华, 庞启华,2, 李楚华, 范瑞芳*
(1. 华南师范大学生命科学学院, 广东省药食资源生物加工及综合利用工程技术研究中心, 广东 广州 510631; 2. 广东工业大学环境科学与工程系, 广州市环境催化与污染控制重点实验室, 广东 广州 510006; 3. 广州质量监督检测研究院, 广东 广州 511447)
神经递质(neurotransmitters)是一类由神经元合成并释放,通过突触传递完成神经元之间信号传递的化学物质。基于物质的结构和化学性质,神经递质可分为氨基酸类(如谷氨酸(glutamic acid, Glu)、γ-氨基丁酸(γ-amino butyric acid, GABA))、生物胺类(如5-羟色胺(serotonin, 5-HT)、多巴胺(dopamine, DA))以及胆碱类(如乙酰胆碱(acetylcholine, Ach))。机体中枢神经系统的神经递质参与多种生理活动,包括睡眠、学习、记忆、情绪反应、精神活动等。个体大脑中枢神经递质的变化直接影响生物体的行为和活动,进而诱导精神病学和神经病学疾病的发生[1]。因此简单、准确、快速检测生物体内神经递质的含量,对于准确解释神经生理活动机制具有重要的意义。
部分神经递质光敏感性强、极易被氧化(如多巴胺),且在生物样品中的含量很低,样品基质复杂[2],因此如何避免神经递质被氧化的样品前处理方法和高灵敏度的检测手段是神经递质含量测定研究的重点。高效液相色谱(HPLC)分离后用紫外(ultra violet)[3]、荧光(fluorescence)[4-6]、电化学(electrochemical detection)[7-9]和质谱(mass spectrometry)[1,2,10,11]方法检测,是目前神经递质测定较常用的方法。但前3种检测方法一般需要对神经递质进行衍生化处理,不仅衍生步骤繁琐,耗时耗力,而且存在有机体内源性类似物的干扰,生成非目标衍生物,衍生程度也难以保证。而超高效液相色谱-串联质谱(UPLC-MS/MS)法兼具分离能力和灵敏度高、特异性好等优势,已逐渐成为生物样品中痕量生物活性物质分析的强有力手段[12-14]。
本研究建立了同位素稀释-UPLC-MS/MS法同时测定大鼠海马体5种神经递质(Glu、GABA、Ach、DA和5-HT)的快速分析方法。该方法重现性好,灵敏度高,无需进行衍生化处理,且维生素C(vitamin C, VC)的加入有效地解决了DA和5-HT前处理和储存过程中的氧化问题,并成功应用于新生期双酚A(bisphenol A, BPA)暴露后大鼠海马体5种神经递质含量的定量分析,为以动物和细胞为对象的毒理研究提供了神经递质的检测方法。
1 实验部分
1.1 仪器与化学试剂
超高效液相色谱-串联质谱联用仪(UltiMateTM3 000标准四元系统液相色谱,TSQ Quantiva三重四极杆质谱仪,Thermo Fisher Scientific公司,美国);氮吹仪(DC-12,上海安谱科学仪器有限公司);低温离心机(3K15, Sigma公司,美国);超声仪(SB-1000,宁波新艺超声设备有限公司);分析天平(BSA224S,赛多利斯公司,德国)。
标准品:5-羟色胺、5-羟色胺-D4、谷氨酸-D5、乙酰胆碱、乙酰胆碱-D9、γ-氨基丁酸和γ-氨基丁酸-D6购自加拿大TRC公司;谷氨酸、多巴胺和维生素C购自美国Sigma公司;多巴胺-D4购自加拿大CDN同位素公司;乙酰胆碱的纯度为95%,其他标准品纯度均大于98%。其他实验用的试剂包括甲醇、乙腈、甲酸和乙酸等均为色谱纯,购自美国Sigma公司。
1.2 标准样品的制备
储备液的配制:分别准确称量各神经递质标准品,溶于2%(体积分数,下同)乙酸水-甲醇溶液(1∶1, v/v),配制成质量浓度范围为1~5 g/L的单标准品储备液。准确称取100 mg VC标准品,溶于2%乙酸水溶液中,配制成10 g/L的储备液,并充入足量氮气。所有储备液放置于-20 ℃冰箱储存备用。分别移取定量单标准储备液至容量瓶中,加入2%乙酸水-甲醇溶液(9∶1, v/v)定容,制成混合标准溶液;然后依次用不同体积的2%乙酸水-甲醇(1∶1, v/v)溶液稀释混合标准溶液,配成6个不同浓度的标准溶液样品混合液,用于制作标准曲线。
1.3 色谱与质谱条件
色谱条件:选择Ultimate AQ-C18(150 mm×4.6 mm, 3 μm,上海月旭公司)色谱柱作为分离柱;流动相由A相(0.1%甲酸水)和B相(甲醇)组成;流速:0.4 mL/min;柱温:28 ℃;进样量2 μL。梯度洗脱程序:0~1.00 min, 20%B; 1.00~2.00 min, 20%B~50%B; 2.00~2.50 min, 50%B~100%B; 2.50~6.00 min, 100%B; 6.01 min, 20%B; 6.01~10.00 min, 20%B。

表 1 质谱参数Table 1 Mass parameters
* Transitions used for quantification. CE: collision energy; RF: radio frequency; Ach: acetylcholine; 5-HT: serotonin; GABA:γ-amino butyric acid; DA: dopamine; VC: vitamin C.
质谱条件:电喷雾离子(ESI)源,负离子模式;喷雾电压:3 500 V;鞘气流速:30 Arb;辅助气流速:15 Arb;离子传递管温度:325 ℃;雾化器温度:350 ℃。优化了各分析物的碰撞能量和透镜电压,并选择合适的定量和定性离子对,用多反应监测(MRM)模式进行定量。具体参数见表1。
1.4 样品前处理
哺乳期大鼠BPA暴露14天后,将其颈椎脱臼处死,取全脑。在冰浴中小心剥离出海马体,准确称重后放入1.5 mL的塑料离心管中。加入250 μL 2%甲酸水和50 μL 10 g/L VC,匀浆2 min后继续超声提取15 min,然后在13 000 r/min的速度下离心40 min。取150 μL上清液至不含BPA的塑料离心管中。依次加入100 μL混合同位素内标和1 mL 2%甲酸乙腈溶液,充分涡旋振荡,使蛋白质沉淀。在13 000 r/min的速度下离心20 min,取625 μL上清液至干净的玻璃试管中,氮气吹干。加入1 mL 2%乙酸水-甲醇(9∶1, v/v)溶液复溶,在12 000 r/min的速度下离心5 min,取700 μL上清液于2 mL液相自动进样瓶中,充入氮气,于-20 ℃冷冻保存待测。
1.5 质控样品
按照标准曲线样品的配制方法,分别配制低、中和高水平的质控样品(Glu: 1 500、7 500和15 000 μg/L; GABA: 250、1 250和2 500 μg/L; Ach: 1.5、7.5和15 μg/L; 5-HT: 1、5和10 μg/L; DA: 1、5和10 μg/L)。此外,每一批次处理还包括两个空白样品,包括方法空白样品(前处理方法同实际样品,加入等量同位素内标)和溶剂空白样品(样品处理方法同空白样品,但是不加入同位素内标)分别用以监控处理过程中由于各种操作原因造成的污染和添加各种化学品引入的本底污染。所有标准曲线、质控样品的前处理方法与实际样品等同。
2 结果与讨论
2.1 色谱条件的优化
由于神经递质化合物极性较强,因此选择了3种不同型号的、具备一定极性保留能力的反相液相色谱柱优化分离目标化合物,分别为ACQUITY UPLC HSS T3柱(100 mm×2.1 mm, 1.8 μm, Waters公司,美国)、Ultimate AQ-C18柱(150 mm×4.6 mm, 3 μm,上海月旭公司)和ACE C18-PFP柱(150 mm×4.6 mm, 3 μm, ACT公司,英国)。由于Ach在ACQUITY UPLC HSS T3柱中峰形拖尾,而ACE C18-PFP柱对神经递质的保留较弱导致分离度不佳,最终选择Ultimate AQ-C18柱作为分离柱。该色谱柱是以B型超高纯全多孔球形硅胶为基质,碳载量高达12%,这使其不仅色谱峰形、分离效率、稳定性和重现性均极佳,且对亲水性和极性化合物具有更强的保留能力和选择性。
试验中发现,当用于溶解样品的溶液中甲醇比例较高时,色谱分离中无论如何调整流动相比例或更换其他型号的色谱柱,5-HT峰形分叉严重(见图1)。而当甲醇体积分数低于10%时,各类化合物均具有良好的峰形。因此,优化了氮气吹干后复溶目标化合物的甲醇比例。考虑到5-HT具有一定的疏水性以及稳定性,综合考虑后选用2%乙酸水-甲醇溶液(9∶1, v/v)作为样品溶解液而非2%乙酸水。

图 1 溶解样品溶液的甲醇体积分数对5-HT的色谱分离影响Fig. 1 Effects of the methanol volume percentages in re-dissolution solutions on the chromatogra-phic separation of 5-HT HAc: ethanoic acid; MeOH: methanol.
在梯度洗脱程序的优化过程中发现,Ach拖尾严重,这种现象均存在于上述3种色谱柱中,即使往流动相中添加乙酸铵也不能明显改善拖尾程度。多次调整流动相比例后发现,甲醇比例提高后,起始柱压升高可以显著改善Ach的拖尾现象。因此,梯度洗脱程序选择了20%甲醇作为起始流动相比例。部分神经递质(如Glu)在脑中的含量很高(大于1 mg/g)[12],为了防止化合物的进样残留对后一个样本定量分析准确性的影响,使用100%甲醇充分冲洗柱子达3.5 min。结果显示,5种神经递质的进样残留率(carry-over)为1.4%~5.2%,符合欧洲药品管理局(EMA)生物分析方法标准[15]的要求。
柱温对各化合物的色谱响应值虽无明显影响,但对5-HT的色谱保留时间有显著影响。5-HT的色谱保留时间随柱温的微小变化而变化,且温度越高,保留时间越长。由于部分神经递质不稳定,易于被氧化,所以色谱分离时间不宜太长。在确保良好分离度的前提下,分析时间愈短愈好,最终确定28 ℃为分析柱温。图2为优化色谱条件后的标准溶液色谱图和大鼠海马体样品色谱图,单个样品分析方法时间为10 min,其中目标化合物3 min内完全出峰。
2.2 灵敏度
连续测定6次连续稀释的标准样品,按照3倍信噪比(S/N)计算仪器检出限(LOD), Glu、GABA、Ach、DA和5-HT的LODs分别为0.25、0.15、0.05、0.20和0.20 μg/L。将日内精密度小于20%且其S/N大于10的最小标准品质量浓度定义为定量限(LOQ),则Glu、GABA、Ach、DA和5-HT的定量限分别为1.0、0.50、0.15、0.60和0.60 μg/L(见表2)。
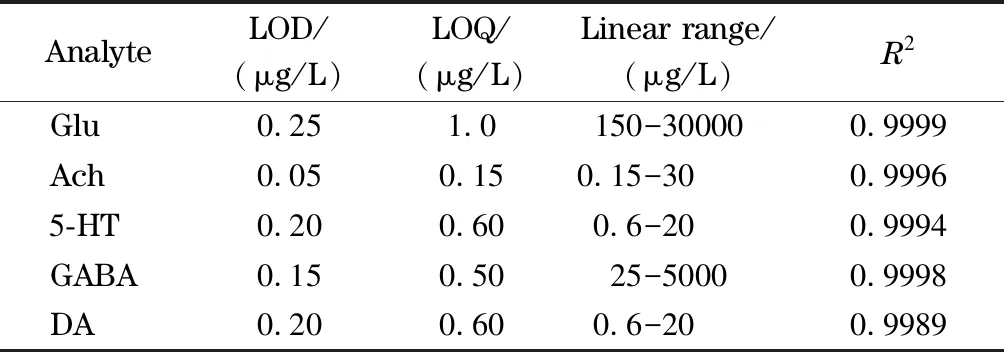
表 2 检出限、定量限、线性范围和相关系数Table 2 LODs, LOQs, linear ranges and correlation coefficients (R2)

图 2 (a)5种神经递质的混合标准溶液和(b)海马体样品的色谱图Fig. 2 Chromatograms of five neurotransmitters in (a) a mixed standard solution and (b) a rat hippocampus sample
2.3 稳定性

图 3 5种神经递质色谱峰面积比值的稳定性Fig. 3 Stabilities of the chromatographic peak area ratio for five neurotransmitters Snot VC: peak area of samples without VC; Sadd VC: peak area of samples with VC.
在标准品的连续进样中发现,DA和5-HT的标准样品色谱峰响应随时间变化明显。特别是DA,一天内连续进样后,其色谱响应下降明显,导致标准曲线不呈线性。查阅资料[2,12]发现,DA、5-HT都容易被氧化,从而不能与氧气共存,所以在前处理过程中应尽量避光,并简化前处理步骤、缩短实验时间。同位素内标的引入虽然在很大程度上解决了操作过程对定量结果产生的偏差问题,但仍无法解决由于DA、5-HT在样品处理和分析过程中的氧化而带来的无法准确定量问题。因此,本研究尝试往样品中加入强还原性的VC以拮抗氧化剂对DA、5-HT的氧化。含有VC和不含VC的质控样品经过前处理后,在室温条件下保存,并于第1、2、3和10天测定5种神经递质和VC的含量。结果显示,Glu、GABA和Ach的峰面积比值(不加入VC的样品响应值/加入VC的样品响应值)较为稳定,而DA和5-HT伴随时间的增加其峰面积比值下降明显。在第1天测定时,5-HT和DA的峰面积比值分别为79.2%和18.8%,说明在前处理过程中,不含VC的质控样品有约20% 5-HT和80% DA被氧化(见图3)。当缺乏VC时,第1天DA峰高已极显著降低,第2天已下降到检出限附近,而加入VC后,DA在第10天依然可以检测到明显的色谱峰(见图4)。与DA相比,5-HT在缺乏VC的情况下,在第10天虽能被检测到,但其峰高亦显著低于加入VC的样品。因此在样品前处理过程中,VC的加入可以扮演着“被优先氧化”的角色,从而间接保护其他还原剂(DA和5-HT)不被氧化,增加了神经递质前处理过程和仪器分析过程中样品的稳定性。因此在前处理以及标准溶液的配制过程中,应当加入足量(>0.5 g)的VC以抗氧化。

图 4 维生素C对多巴胺和5-羟色胺色谱峰面积稳定性的影响Fig. 4 Influence of VC on the determination stabilities of DA and 5-HT
2.4 方法精密度、加标回收率和质量控制
往稀释5倍的大脑海马体匀浆液中加入标准样品,配制成4个不同水平加标样品,每个水平设6个平行样,测定并计算日内加标回收率和精密度。连续6天重复配制并测定,计算日间加标回收率和精密度。5种神经递质的日内加标回收率为96.6%~118.0%,日间加标回收率为92.9%~119%,日内精密度(RSD)为0.39%~7.50%,日间精密度为1.33%~13.6%(见表3)。此外,由于实验用的玻璃器皿均经过浓硫酸/重铬酸钾配成的洗液处理,且实验用试剂均为色谱纯,因此在所有空白质控样品中均未检出分析物。
2.5 实际应用
新生期大鼠BPA暴露结束后,取不同性别的4个浓度组的大鼠海马体,按照1.4节前处理方法提取神经递质并进行含量测定,结果见表4。与对照组相比,BPA暴露后,各个神经递质的质量浓度变化呈现出性别差异和剂量依赖性。总的来讲,雄性和雌性大鼠5-HT、GABA的含量呈现下降趋势,但Ach、Glu的含量却呈现上升趋势,且DA的含量变化不大,这可能与不同的神经递质负担不同生理活动有关。有意思的是,低浓度BPA暴露后,雄性大鼠海马体5-HT含量显著减少,Ach、Glu含量极显著增加,而在雌性大鼠中仅引起了5-HT含量的显著减少;中浓度BPA暴露后并未引起雄性大鼠海马体5种神经递质的显著变化,而在雌性大鼠中却引起了5-HT、GABA含量的显著减少和Glu含量的显著增加。因此,不同浓度BPA暴露对大鼠海马体神经递质含量的影响表现出性别差异性,这和其他文献报道[16]的结论相一致。
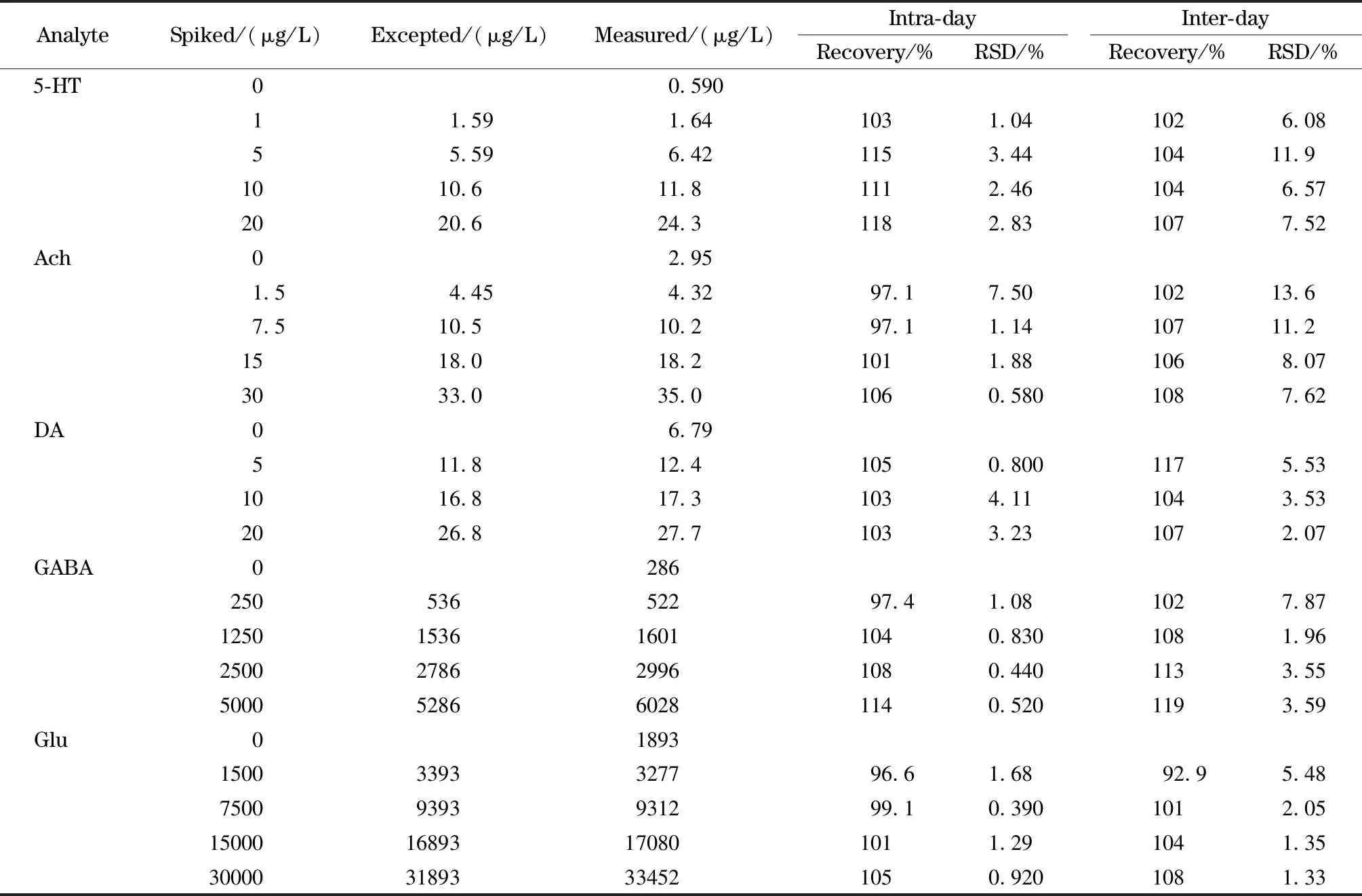
表 3 日内和日间加标回收率和精密度(n=6)Table 3 Intra- and inter-day spiked recoveries and precisions (n=6)
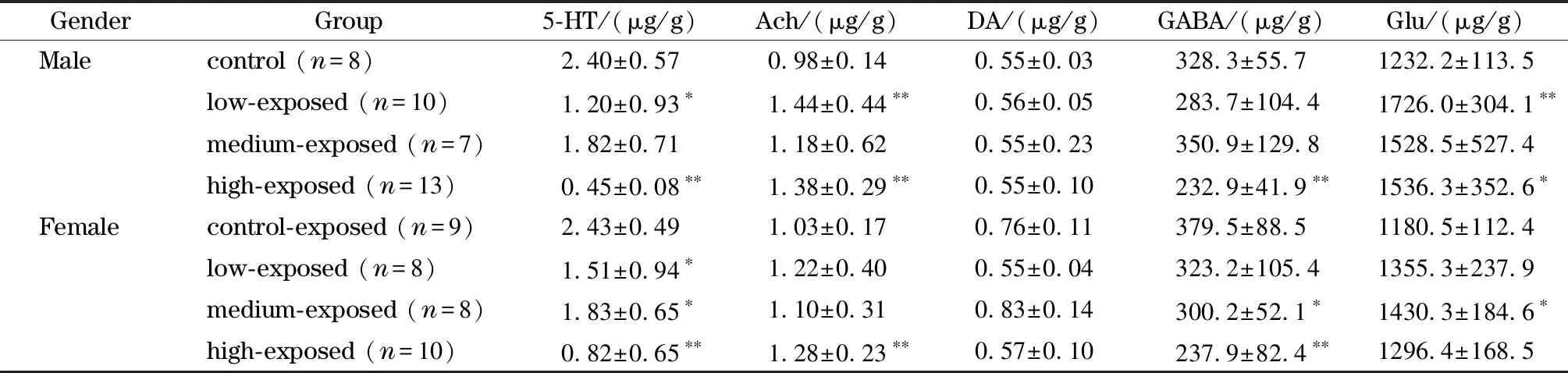
表 4 双酚A暴露后大鼠海马体中5种神经递质的含量Table 4 Five neurotransmitter levels in hippocampus of the rats exposed to bisphenol A
Mann-Whitney U test, *p<0.05; **p<0.01.
3 结论
建立了同位素内标稀释-UPLC-MS/MS同时测定大鼠海马体5种神经递质(Glu、GABA、Ach、DA、5-HT)的方法。该方法操作快捷、高效,无需衍生化处理,且检出限低,线性度、方法精密度和精确度良好,能在3 min内完成5种神经递质的同时分析。该方法已被成功应用于新生期BPA暴露后大鼠海马体5种神经递质含量的定量分析,为潜在的动物在体毒理研究提供了技术支撑。
