全氟甲基乙烯基醚脱氯釜残综合利用的研究
2019-04-01窦若岸陈彬彬罗生乔赖碧红甘立兵
窦若岸 陈彬彬 罗生乔 赖碧红 甘立兵 罗 凯
(中蓝晨光化工研究设计院有限公司,四川 成都 610041)
0 前言
全氟甲基乙烯基醚(PMVE),分子式CF3OCF=CF2,是重要的全氟烯醚特种单体,可用于全氟醚橡胶和低温氟醚橡胶的制备以及氟树脂的改性,此外,PMVE还是新型含氟农药和含氟医药的中间体,具有良好的经济效益和广阔的市场前景。在PMVE的生产中,在CFCl2CFCl2(F112)脱氯工段以及加成物CF3OCFClCF2Cl的脱氯工段会产生大量脱氯釜残。F112脱氯釜残主要由水、ZnCl2、N,N-二甲基甲酰胺(DMF)和少量未反应的锌粉组成,加成物脱氯釜残主要由DMF、ZnCl2和锌粉组成。如将这些废物交予环保公司处理需要很高的费用,且环保公司处理能力有限,常不能得到及时处理。将PMVE脱氯釜残进行综合利用,变废为宝,将解决PMVE生产中脱氯釜残的排放问题,同时可回收利用部分原料,实现资源的二次利用,具有巨大的经济效益和环保价值。
1 试验原理及工艺路线
F112脱氯和加成物脱氯反应式分别如下:



分别使用DMF/水和DMF作为反应溶剂,脱氯釜残是由水、DMF、ZnCl2和锌粉组成的固/液混合物。处理此类废物的方法:首先可采用过滤、蒸馏等方法实现固液分离,然后将溶剂和ZnCl2部分进行处理[1-2]。潮湿的锌粉化学性质活泼,在空气中易自行发热燃烧,因此,锌粉不适合直接过滤干燥。采用重力沉降后分离上层清液的方法,在溶剂的保护下将含锌粉及溶剂的下层一同回收,在保证安全的前提下,实现锌粉的回收利用。经过沉降分离回收锌粉后,收集的上层清液为ZnCl2的DMF/水溶液。处理含ZnCl2废水的主要方法有3种:1)制备无水ZnCl2;2)制备碱式碳酸锌;3)制备ZnO。
制备无水ZnCl2时,首先将ZnCl2溶液纯化去除Fe3+,然后加锌粉置换其他重金属,使用HCl调节pH=3,蒸发浓缩,最后在大于300 ℃条件下加热,得无水ZnCl2[3-4]。由于ZnCl2会与DMF生成络合物ZnCl2[HCON(CH3)2]2[5-6],分离DMF与ZnCl2需要较高温度,且ZnCl2水解使得水溶液呈酸性导致DMF分解[7],所以放弃这一工艺路线。
ZnCl2的DMF/水溶液无法直接分离出ZnCl2,制备ZnO也需要在制备碱式碳酸锌前驱体的基础上再煅烧处理,且需额外购置满足高温条件的煅烧设备,综合考虑选择制备碱式碳酸锌来处理含ZnCl2的废水[8-10]。制备碱式碳酸锌的反应式如下:
3ZnCl2+ 3K2CO3+ 2H2O =
ZnCO3·2Zn(OH)2·H2O↓ + 2CO2↑ + 6KCl
在溶液中ZnCl2会与碳酸盐发生复分解反应,生成碱式碳酸锌沉淀、二氧化碳气体和相应的氯盐,在经过洗涤、过滤和干燥后得到碱式碳酸锌产品[11]。碳酸盐沉淀剂可以是K2CO3、Na2CO3和NH4HCO3等。由于NH4HCO3中的NH4+也会与DMF形成络合物,故首先将其排除。Na2CO3价格较便宜,但其反应产物NaCl不易处理。K2CO3价格较贵,但反应产物KCl可以作为钾肥的原料进行再利用。经过复分解反应制备碱式碳酸锌后将物料过滤,滤液部分为KCl的DMF/水溶液,经蒸发结晶操作进行分离,得到固体KCl和液体DMF/水。
目前,处理含DMF废水的方法主要有物化法(精馏法、萃取法、吸附法)、化学法和生物法等[12],其中化学法和生物法适合于DMF质量分数小于3%的废水,吸附法适合于DMF质量分数小于10%的废水。在适合处理DMF含量较高废水的两种方法中,萃取法较为节能[13],但需要额外加入有机溶剂,可能引入新的杂质,有潜在的环保风险,且需要额外添加萃取设备。经过综合考虑,选择在工业上应用广泛的精馏法处理含DMF的废水[14]。脱氯釜残处理流程如图1所示。
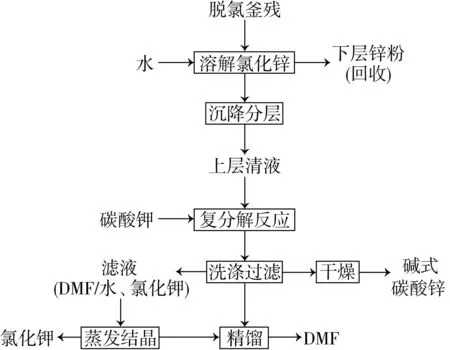
图1 脱氯釜残处理流程图
2 试验部分
2.1 试验原料与仪器
脱氯釜残来自PMVE生产中F112脱氯及加成物脱氯工段,各组分含量如表1所示。

表1 脱氯釜残组成
其他试剂:K2CO3,质量分数≥99%,天津博迪化工有限公司;盐酸,质量分数≥35%,西陇化工有限公司;F112,质量分数95%,常熟三爱富化工有限公司;DMF,质量分数≥99%,巴斯夫(中国)有限公司。
试验仪器:气相色谱仪,Agilent 7820A;恒温水浴锅;鼓风烘箱;马弗炉;离心过滤机;水循环真空泵;精馏装置及其他常规玻璃仪器。
2.2 分析方法
制备的碱式碳酸锌主要测试3个数据,即锌含量、含水率和灼烧热失重。在鼓风烘箱105 ℃干燥24 h测试水含量,马弗炉650 ℃煅烧4 h测试热失重,采用标准HG/T 2523—2016中所述EDTA滴定法测试锌含量,使用Agilent 7820A气相色谱仪测试DMF含量。
2.3 试验内容
2.3.1回收锌粉
将一定量的加成物脱氯釜残加入烧杯中,加入适量水溶解ZnCl2后静置过夜,锌粉沉降分层后吸取上层清液,将下层含锌粉液体回收。
使用回收锌粉进行F112脱氯试验,考察回收锌粉的反应活性,验证回收锌粉能否应用于生产。F112脱氯试验的物料配比为m(F112) ∶m(Zn) ∶m(DMF) ∶m(H2O)= 3.2 ∶1.4 ∶1.0 ∶1.4。
试验步骤:向250 mL三口烧瓶中加入溶剂和锌粉,反应温度设定值开始控制为50 ℃,向烧瓶内缓慢滴加F112,滴加完毕30 min后升温至60 ℃,30 min后升温至70 ℃,继续反应30 min后停止加热和搅拌,于冰水冷阱收料。
2.3.2制备碱式碳酸锌
称取一定量的K2CO3配制成质量浓度为25%~45%的溶液。取1 000 g脱氯釜残滤液加入5 L三口烧瓶中,水浴加热至设定温度后向烧瓶中滴加K2CO3溶液,此时体系生成碱式碳酸锌白色沉淀,并放出CO2气体,当反应体系pH接近7时不再有气泡产生,说明反应已经结束,继续搅拌1 h后停止加热和搅拌。将反应产物进行过滤,分别收集固体碱式碳酸锌和滤液,所得碱式碳酸锌加水洗涤过滤数次后,置于鼓风烘箱110 ℃干燥24 h。取样测试其锌含量、含水量和灼烧热失重数据。
2.3.3回收DMF
蒸发结晶试验:称取含KCl、DMF和水的碱式碳酸锌滤液,置于旋蒸瓶中,水浴温度50~95 ℃,使用水循环真空泵控制压力为5.3~10.6 kPa,最终在水浴95 ℃冷阱收料无增加时停止试验。将所得氯盐进行分析。
精馏试验:使用直径25 mm、高800 mm的填料精馏柱,将蒸发结晶得到的DMF水溶液加入塔釜三口瓶中,开启水循环真空泵控制压力为6.7~10.6 kPa进行减压精馏,逐步升高油浴锅温度,观察塔顶温度及回流情况,分段收集馏出液体,待塔顶温度升高或分析馏出液中含有较多DMF时即停止试验,收集存于塔釜的DMF。
使用回收DMF进行加成物脱氯试验,考察回收DMF的反应活性,验证回收DMF能否在生产中使用。加成物脱氯试验的物料配比为m(加成物) ∶m(DMF) ∶m(锌粉)=2.5 ∶2.5 ∶1.0。
试验步骤:向250 mL三口烧瓶中加入溶剂和锌粉,反应温度设定值开始控制为40 ℃,向烧瓶内缓慢滴加加成物,滴加完毕继续搅拌反应1 h。
3 结果与讨论
3.1 回收锌粉
测试了18 ℃、30 ℃时加成物脱氯釜残中ZnCl2溶解情况与加水量的关系,结果如表2所示。

表2 加水量和溶解试验结果
试验步骤:取100 g加成物釜残置于烧杯中,加入去离子水,搅拌后静置10 min,观察溶解情况。结果显示:在18 ℃时加入质量分数为30%(占釜残)的去离子水能将ZnCl2全部溶解,在30 ℃时加入质量分数为25%(占釜残)的去离子水能将氯化锌全部溶解。
3.1.2回收锌粉脱氯试验
加成物脱氯釜残静置过夜后,锌粉沉降于下层,吸去上层清液,将下层物料置于三口烧瓶中反应,釜残中所含锌粉质量分数以10%计。由于溶剂中ZnCl2接近饱和,反应前需补充适量去离子水以使反应最终ZnCl2的浓度不变。对比试验采用新购锌粉,回收锌粉F112脱氯试验结果如表3所示。

表3 回收锌粉F112脱氯试验结果
回收锌粉脱氯收率平均为85.61%,与对比试验相比收率略低。回收锌粉的反应活性良好,F112加入后立即有气体生成并伴有放热现象,反应现象与使用新购锌粉的试验相同。因此,回收锌粉可应用于F112脱氯反应。
3.2 制备碱式碳酸锌
3.2.1碳酸盐配比的影响
改变K2CO3与ZnCl2物质的量比从1.20 ∶1.00至1.05 ∶1.00,考察碳酸盐加入量对锌离子沉淀率的影响,结果如表4所示。
黄源深版:一般都认为女人应当平平静静,但女人跟男人有一样的感觉。她们需要发挥自己的才能,而且也像兄弟们一样需要有用武之地。她们对严厉的束缚,绝对的停滞,都跟男人一样感到痛苦,比她们更享有特权的同类们,只有心胸狭窄者才会说,女人们应当只做做布丁,织织长袜,弹弹钢琴,绣绣布包……
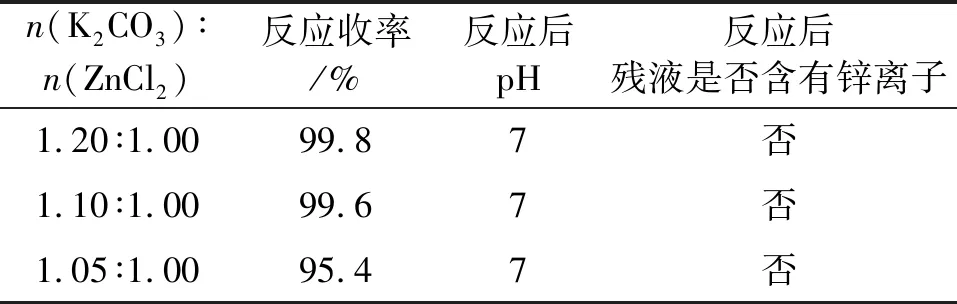
表4 碳酸钾与氯化锌比例对收率的影响
反应后釜残滤液中的锌离子沉淀完全,反应收率均接近100%,以下试验均采用K2CO3过量5%的配比。
3.2.2反应温度的影响
使用加成物脱氯釜残清液为原料,考察反应温度对碱式碳酸锌的影响,结果如表5所示。
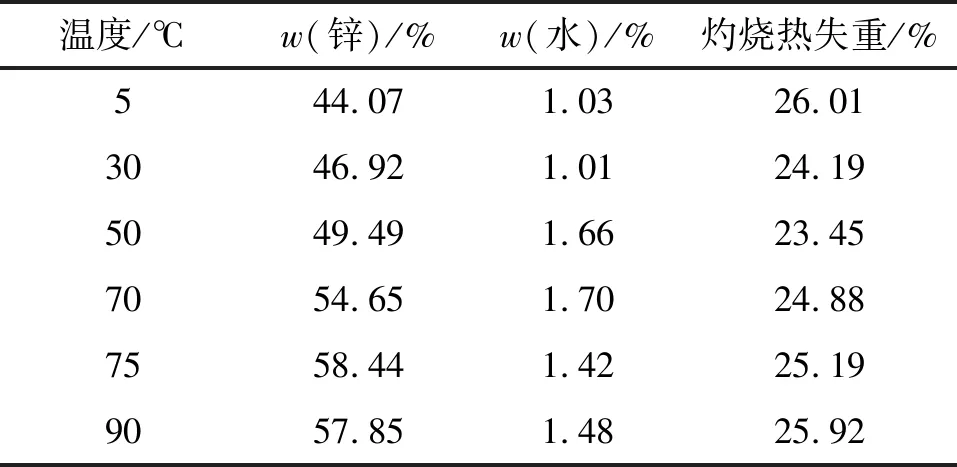
表5 反应温度对沉淀反应的影响
将反应所得的碱式碳酸锌进行锌含量、含水率和灼烧热失重测试,发现反应温度对碱式碳酸锌的锌含量和灼烧热失重的影响很大。沉淀产物中的锌含量随反应温度升高而逐渐上升,当反应温度低于70 ℃时,沉淀产物中的锌含量均小于标准中碱式碳酸锌合格品的要求,在反应温度为30 ℃和50 ℃时,灼烧热失重也未达到碱式碳酸锌标准中灼烧热失重≥25%的要求。确定75 ℃为较优的反应温度。
3.2.3碱式碳酸锌的结构推测
一般将碱式碳酸锌写作ZnCO3·2Zn(OH)2·H2O,X光衍射下碱式碳酸锌的结构有Zn4CO3(OH)6·H2O(简称Zn4)和Zn5(CO3)2(OH)6(简称Zn5)两种[15]。两种结构碱式碳酸锌合成反应式如下:
4ZnCl2+ 4K2CO3+ 4H2O =
Zn4CO3(OH)6·H2O↓ + 3CO2↑ + 8KCl
5ZnCl2+ 5K2CO3+ 3H2O =
Zn5(CO3)2(OH)6↓ + 3CO2↑ + 10KCl
由反应式可见,ZnCl2与K2CO3物质的量比均为1 ∶1,但生成的CO2量有所差异,前者每4 mol ZnCl2生成3 mol CO2,后者每5 mol ZnCl2生成3 mol CO2。因此,可以通过反应中生成CO2的量来推测碱式碳酸锌的结构。
75 ℃时由F112脱氯釜残制备的碱式碳酸锌的反应失重如表6所示。

表6 反应失重和生成两种结构碱式碳酸锌理论失重区别
反应失重是因为生成了CO2气体,失重数据与Zn5理论值相吻合,即反应生成的碱式碳酸锌结构为Zn5(CO3)2(OH)6。
3.2.4 K2CO3浓度的影响
分别使用F112脱氯釜残清液和加成物脱氯釜残清液,在75 ℃时与质量分数分别为25%、35%和45%的K2CO3溶液反应,对生成的碱式碳酸锌进行分析,结果如表7所示。
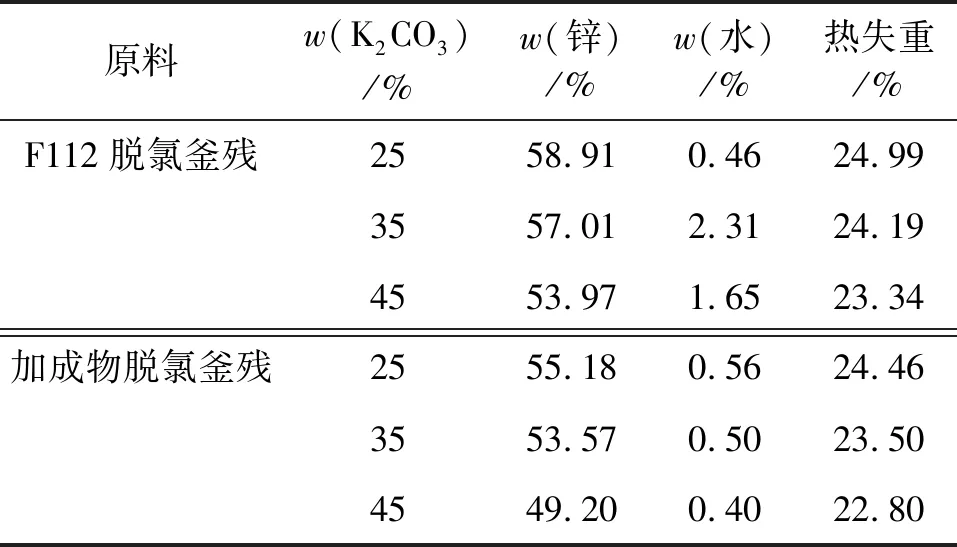
表7 K2CO3浓度对制备碱式碳酸锌的影响
随着K2CO3溶液浓度的增加,产物碱式碳酸锌中的锌含量随之下降,这是由于K2CO3浓度的增加,使得碱式碳酸锌结构中CO32-的组成增加所致。K2CO3浓度较大时,被碱式碳酸锌包裹共沉积也会造成锌含量下降。加成物釜残中由于含有其他杂质导致其锌含量较低,质量分数为25%的K2CO3溶液与F112脱氯釜残反应产出的碱式碳酸锌能达到国标要求。
3.2.5碱式碳酸锌的后处理
制备的碱式碳酸锌还需经过过滤、洗涤和干燥才能得到合格的产品。脱氯釜残制备的碱式碳酸锌与常规生产的碱式碳酸锌的不同之处在于其反应溶液中含有DMF,在洗涤之后需要收集洗液在后续的蒸发结晶和精馏工段回收DMF,洗涤用水量将直接影响到这两个工段的能耗,所以在得到合格碱式碳酸锌产品的基础上,尽量减少洗涤用水。
具体洗涤操作:每350 g碱式碳酸锌中加入1 000 g去离子水,搅拌均匀后过滤。洗涤条件对碱式碳酸锌的影响结果如表8所示。
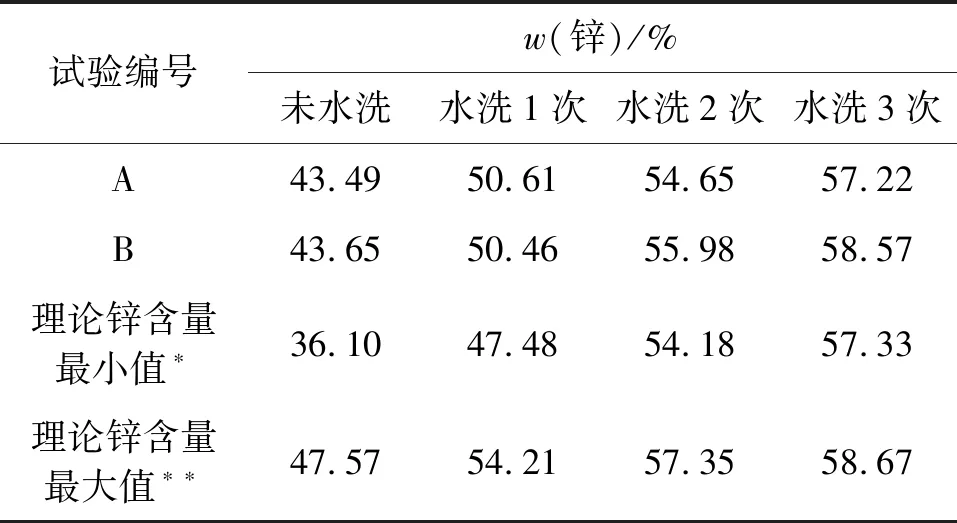
表8 碱式碳酸锌洗涤次数与锌含量的关系
注:*理论推算干燥后含DMF,**理论推算干燥后不含DMF
碱式碳酸锌干燥温度为110 ℃,沸点为151 ℃的DMF部分随水被蒸出,剩余部分与KCl附于固体之上,造成了未洗涤碱式碳酸锌的锌含量较低。计算了干燥后碱式碳酸锌含DMF和不含DMF两种极端情况下的锌含量,实际情况应该在这两者之间。试验结果得到了印证,按上述洗涤条件,脱氯釜残至少要水洗3次才能达到锌含量57.5%以上的优等品标准,用水量为碱式碳酸锌质量的8.6倍。
3.3 回收DMF
3.3.1蒸发结晶试验
碳酸锌滤液分别来自加成物脱氯釜残和F112脱氯釜残,调节pH至中性后,进行蒸发结晶试验。试验结果如表9所示。

表9 蒸发结晶回收KCl中杂质分析测试结果
蒸发结晶试验得到DMF质量分数为25%和14%的两种物料及KCl固体。工业氯化钾标准(GB/T 7118—2008)中钙镁离子总量要求<0.45(g/100 g),二级品氯化钾含量要求>88.0(g/100 g),两种脱氯釜残制备的KCl都满足这一要求,加成物脱氯釜残制备氯化钠中有含有钙,推测是加成物釜残中含有的杂质。
3.4 精馏试验
3.4.1精馏试验结果
使用DMF质量分数为14%的脱氯釜残为原料进行精馏试验。试验结果如表10所示。

表10 精馏试验结果
精馏物料中DMF质量分数为14.0%,DMF的质量为319.1 g,精馏釜中收集的DMF质量分数为98.4%,DMF的质量为273.6 g,DMF的回收率为85.7%。
回收率较低的原因有两个:一是在精馏中DMF出现部分分解现象,DMF与水发生水解反应,水解产物为甲酸与二甲基胺,只要DMF与水接触,在水为液态的稳定范围内都可以发生水解,温度越高水解速率越大,且在酸性或碱性条件下反应速率均会加快,要减少这一反应需保持较低的精馏温度以及精馏前调节pH为中性;二是使用气相色谱法分析DMF含量时,在DMF含量较低时存在误差。
精馏试验中发现塔顶馏出液的pH随着时间先慢慢降低而后又逐渐升高,推测原因是开始时原料中存在二甲胺随水一同馏出,含量随时间逐渐降低,但同时随加热时间及加热温度的增加又有部分DMF发生分解,在后期的精馏中馏出物pH又有所上升。
3.4.2回收DMF对加成物脱氯的影响
DMF回收后用于加成物脱氯试验,其结果如表11所示。
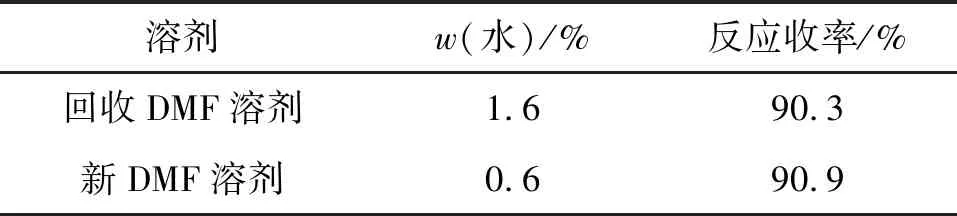
表11 回收DMF脱氯试验结果
使用回收溶剂与使用新DMF溶剂的反应现象及收率均没有区别。试验证明,回收DMF可应用于加成物脱氯反应。
4 结论
PMVE脱氯釜残经过综合处理,釜残中各组分均得到处理或回收利用。锌粉经沉降后回收应用于F112脱氯反应;含ZnCl2清液于75 ℃搅拌下滴加质量分数为25%的K2CO3反应制备碱式碳酸锌,加入K2CO3物质的量为ZnCl2的1.05倍,之后经过滤、洗涤和干燥得到合格的碱式碳酸锌工业品;加入盐酸将滤液pH调至中性后经蒸发结晶分离得到KCl,最后经过精馏得到DMF回收应用于加成物脱氯反应。釜残中所有的组分均得到综合利用。
