一株特异腐质霉纤维素酶高产突变株的鉴定分析
2019-04-01李金阳张宇宏张志伟徐欣欣
陈 媛, 李金阳, 张宇宏, 刘 波, 张志伟, 徐欣欣*, 张 伟
1.山西农业大学林学院, 山西 太谷 030801;2.中国农业科学院生物技术研究所, 北京 100081
特异腐质霉(Humicolainsolens)是一种无毒无害的丝状真菌,与其他丝状菌相比,它具有生长速度快、最适生长温度高(45℃)、培养时不易受其他杂菌污染等优点[1]。另外,特异腐质霉具有完善的纤维素酶和半纤维素酶系表达分泌能力,其中包括至少2种纤维二糖水解酶、7种内切葡聚糖酶、5种β-葡萄糖苷酶、5种木聚糖酶和3种木糖苷酶等[2~9]。
目前,特异腐质霉来源的多种纤维素分解酶已成功实现了异源表达和性质鉴定[2~4,10,11]。与木霉、曲霉和青霉属来源的酶不同,特异腐质霉的纤维素分解酶具有最适pH偏中性、良好的耐碱性和耐热性等特点[2,4]。这些优良的酶学性质使它们在纺织、洗涤和酿酒工业中具有重要的应用价值[12~14],其中多种纤维素酶已实现商品化,如内切葡聚糖酶EGV(Carezyme, Novozymes)是重要的洗涤用酶,β-葡聚糖酶制剂(Ultraflo L, Novozymes)在啤酒酿造过程中可以改善麦芽酿造性能和提高麦汁的过滤速度。
尽管对于特异腐质霉的分子生物学研究与应用已经展开,但由于原始菌株纤维素酶的表达水平过低,从而无法满足工业生产的需求。已有研究通过对特异腐质霉进行多重理化因子诱变,获得的纤维素酶高产菌株的滤纸酶活力、CMC-Na(羧甲基纤维素钠)酶活力和β-葡萄糖苷酶活力分别提高了60.15%、3.19%和59.78%[15]。中国科学院微生物研究所钱世均研究员利用紫外诱变及离子束诱变的方法对特异腐质霉菌株进行诱变以提高纤维素酶产量,筛选得到突变菌株的内切β-1,4葡聚糖酶活力、滤纸酶活力较原始菌株分别提高了78.57%和106.81%[16]。然而,迄今为止,关于特异腐质霉中纤维素酶高产机制的研究尚鲜有报道。
本实验室前期工作中,为了筛选特异腐质霉的纤维素酶高产菌株,成功建立了根瘤农杆菌介导的特异腐质霉高效转化体系,并使用T-DNA插入突变技术构建了随机突变体文库[17,18]。在此基础上,本研究筛选鉴定得到纤维素分解能力显著增强的突变体T53,并对其中的T-DNA插入位点进行了鉴定分析。有助于丰富对特异腐质霉中纤维素酶表达调控机制的认识,并对基因工程手段构建纤维素酶高产菌株具有重要的指导意义。
1 材料与方法
1.1 实验材料
1.1.1菌株、试剂 特异腐质霉H.insolensY1分离于河北省张家口市森林土壤,保存于中国普通微生物菌种保藏中心,保存号为CGMCC 4573[2]。大肠杆菌感受态细胞E.coliTrans1-T1和BL21 (DE3)及克隆载体pEASY-T3和pEASY-Blunt克隆载体购自北京全式金生物技术有限公司。TaqDNA聚合酶和T4 DNA连接酶购自Promega公司;微晶纤维素、CMC-Na、木聚糖、对硝基苯-葡萄糖苷(pNPG)和对硝基苯-纤维二糖苷(pNPC)购自Sigma公司;引物由上海生工生物工程技术服务有限公司合成;其他试剂均为进口或国产分析纯。
1.1.2培养基 CMC-Na培养基:10 g/L羧甲基纤维素钠,1 g/L蛋白胨,20 g/L酵母提取物,0.6 g/L MgSO4·7H2O,0.5 g/L脱氧胆酸钠,15 g/L琼脂粉,pH自然。
发酵培养基:20 g/L微晶纤维素,20 g/L酵母提取物,1 g/L蛋白胨,0.6 g/L MgSO4·7H2O,pH 6.8。
1.2 实验方法
1.2.1随机突变体的筛选 以PDA平板培养并收集不同突变菌株与野生型菌株H.insolensY1孢子,分别取约108个孢子接于CMC-Na培养基,42℃生长3天,然后于培养皿中加入刚果红染色30 min,并用NaCl溶液洗涤30 min[18]。观察不同突变菌株产生的透明圈大小,筛选比野生型透明圈大的突变株。
1.2.2摇瓶发酵实验及纤维素酶活的测定 PDA平板培养并收集突变株T53与野生型特异腐质霉菌株孢子,取约107个孢子分别接入盛有50 mL发酵培养基的250 mL三角瓶中,42℃ 220 r/min培养6 d。每天收集样品,并离心取上清进行发酵产物的纤维素酶活测定。滤纸酶活力(FPase)、内切β-1,4葡聚糖酶活力(CMCase)以及木聚糖酶(xylanase)活力测定使用3,5-二硝基水杨酸(DNS)方法[17];葡萄糖苷酶(pNPGase)活力、纤维二糖水解酶(pNPCase)活力使用以对硝基苯(pNP)为底物的方法进行测定[18]。滤纸酶活力计算公式:
FPase(U/mL)=(411.60×OD540+109.31)/180.16×(1/30)×(1/0.04)×稀释倍数
内切β-1,4葡聚糖酶活以及木聚糖酶活计算公式:
CMCase/xylanase (U/mL)=(411.60×OD540+109.31)/180.16×(1/10)×(1/0.1) ×稀释倍数
葡萄糖苷酶酶活、纤维二糖水解酶酶活计算公式:
pNPGase/pNPCase(U/mL)=(0.1149×OD405+0.0024)/10×(1/0.25)×稀释倍数
1.2.3蛋白电泳检测 取突变株T53与野生型菌株第3天至第6天发酵上清进行蛋白电泳。12%(w/V)聚丙烯酰胺凝胶进行十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)[19]。考马斯亮蓝G-250染色蛋白质。
1.2.4突变位点的鉴定 提取突变菌株T53的基因组DNA,参照Liu等[20]的方法进行TAIL-PCR,扩增T53菌株中T-DNA的侧翼片段。胶回收目的片段并连入克隆载体pEASY-Blunt,进行测序和BlastX比对分析。将克隆得到的侧翼序列与特异腐质霉基因组序列进行比对分析,从而确定突变子T53插入突变的靶位点。
2 结果与分析
2.1 纤维素酶高产突变菌株的快速筛选
为了快速鉴定纤维素酶高产菌株,我们将T-DNA随机插入突变株与野生型菌株分别接种于筛选培养基(CMC-Na培养基)平板,筛选得到透明圈较野生型菌株显著增大的突变株T53。野生型特异腐质霉和T53菌株在含有羧甲基纤维素钠(CMC-Na)的筛选平板上生长3天,刚果红溶液染色后,CMC-Na水解区域清晰可见。T53与野生型菌株相比,气生菌丝相对较多,并且T53所产生透明圈大小为0.8 cm,而野生型菌株透明圈大小为0.6 cm(图1)。
2.2 T53菌株的酶活鉴定
为了进一步鉴定特异腐质霉野生型和T53菌株的纤维素酶表达分泌能力,我们将野生型菌株和T53进行液体摇瓶发酵,并检测发酵2~6天后,发酵上清中的各种纤维素酶活力。在整个发酵周期中,突变株T53发酵上清中的滤纸酶、内切-β-1,4-葡聚糖酶、木聚糖酶、β-葡萄糖苷酶和纤维二糖水解酶活力较野生型菌株均有了明显提高,分别为野生型的1.4倍、1.6倍、1.9倍、1.1倍、1.6倍(图2)。
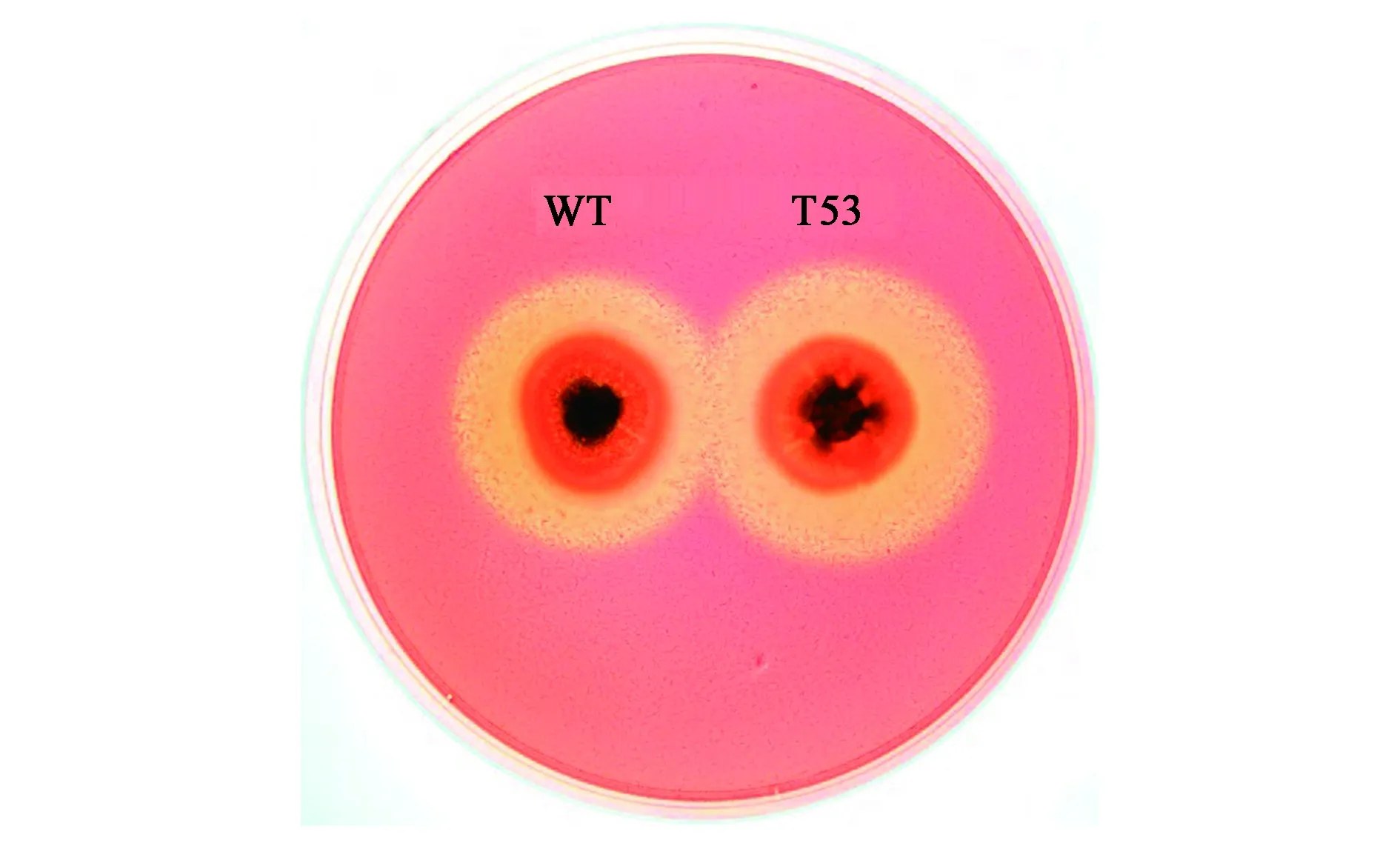
图1 T53和野生型(WT)特异腐质霉菌株Y1的平板透明圈大小测定Fig.1 Plate-clearing zone assay of wild type(WT) H. insolens Y1 and T53.
蛋白电泳检测发酵3~6天野生型菌株及T53发酵上清中的总分泌蛋白,结果显示, T53突变菌株的蛋白分泌量较野生型菌株显著提高,特别是40 kDa大小的蛋白表达量提高明显(图3)。
2.3 T53菌株中T-DNA插入位点的鉴定分析
为了揭示T53菌株中纤维素酶的高产分子机制,我们通过TAIL-PCR获得T53中T-DNA插入位点的侧翼序列。测序后与特异腐质霉的基因组序列进行比对分析,鉴定得到T53中的T-DNA插入位点。该位点位于一个功能未知基因(我们将其命名为HicelR1,GenBank Accession No.: MK468690)的上游启动子区域(ATG上游224 bp处,图4)。该基因含有一个1 536 bp大小的开放阅读框,其编码的氨基酸序列包含一个C2H2型锌指簇DNA结合结构域和一个真菌特异的转录因子结构域。我们推测该基因编码了一个可能的锌指蛋白类转录因子。BlastP同源比对结果显示,HicelR1与顶头孢霉(Acremoniumchrysogenum)的Krueppel-like 因子[21]、马杜拉足肿菌(Madurellamycetomatis)的金属硫蛋白表达激活剂[22]、尖孢镰刀菌(Fusariumoxysporum)的转录调节因子prz1[23]分别具有41%、49%、39%的序列一致性。
3 讨论
特异腐质霉可以产生丰富且性质优良的纤维素、半纤维素降解酶系[1~9],并且具有作为表达宿主大量生产外源蛋白的能力[24],因此是继木霉、青霉和曲霉之后最有潜力的纤维素降解菌和丝状真菌表达系统[25]。然而,迄今为止,关于特异腐质霉中纤维素酶表达调控的分子机理以及纤维素酶高产分子机制的研究甚少。
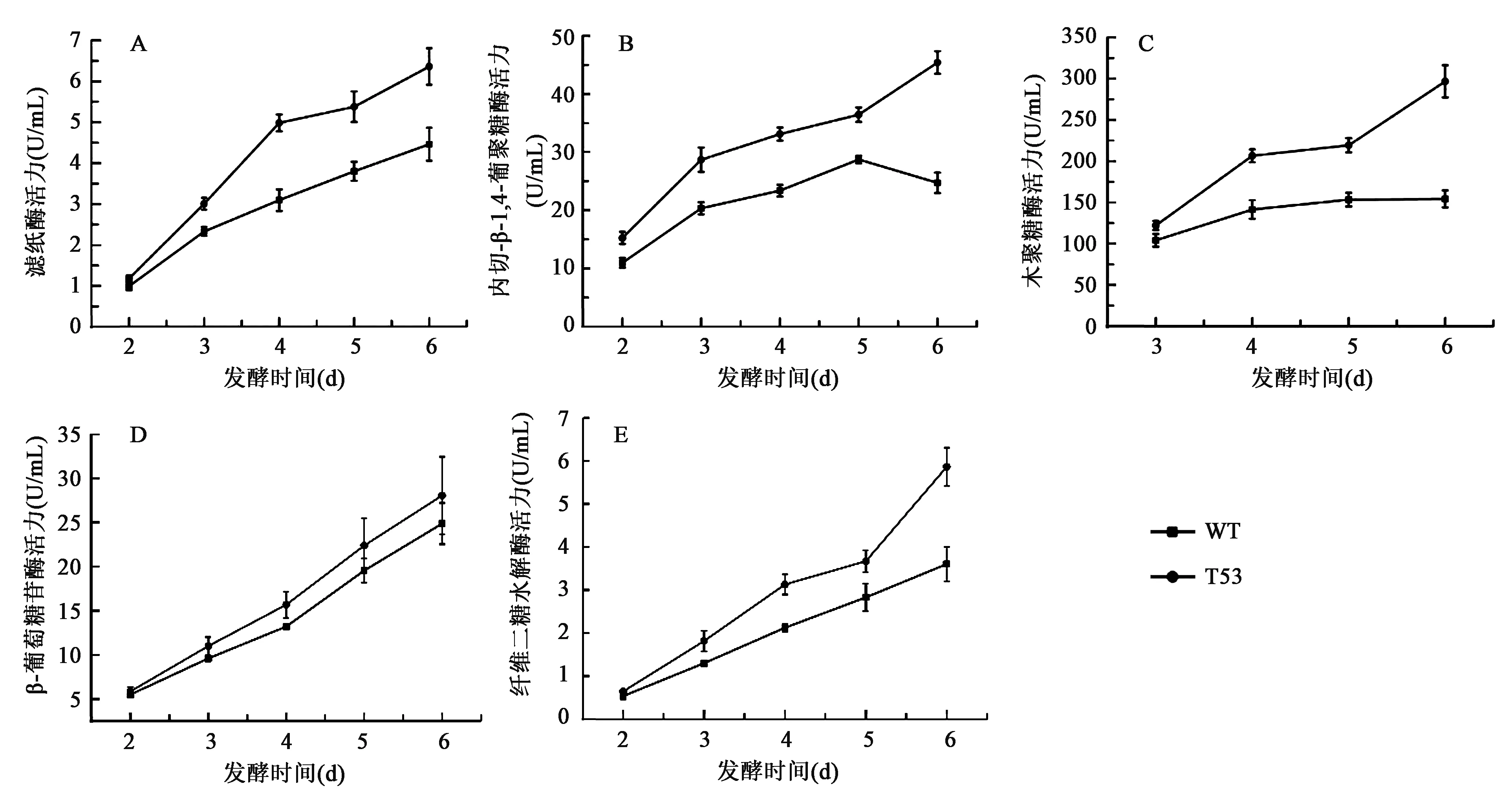
图2 T53与野生型特异腐质霉菌株Y1不同发酵时间点纤维素酶活力的比较Fig.2 Time course of cellulase activities of T53 and wild-type H. insolens Y1.

图3 T53与野生型(WT)特异腐质霉菌株Y1不同发酵时间点蛋白分泌量的比较Fig.3 SDS-PAGE analysis of proteins secreted by T53 and wild type (WT) H. insolens Y1.
基于随机插入诱变的遗传筛选方法已广泛应用于多种生物的功能基因组研究中[26]。 在这项工作中,我们从实验室前期工作构建的T-DNA随机插入突变体库中筛选得到一株纤维素降解能力

图4 突变株T53中T-DNA插入位点示意图Fig.4 Schematic diagram of T-DNA insertion site in mutant T53.
显著提高的突变菌株T53。SDS-PAGE蛋白电泳显示,T53菌株的胞外蛋白分泌量较野生型菌株显著增多,结合本实验前期工作的质谱鉴定结果[18],我们推测T53菌株纤维素降解能力的提高主要是由于纤维素酶Cel6A、Cel6B、Cel7A、Cel7B、CMC3和半纤维素酶XynA、XynB、XynC、Xyl43A和HIGAL表达分泌量的增加。上述纤维素酶和半纤维素酶的理论分子量,除XynB 外均集中在40 kDa左右(表1),这也进一步证实了突变株T53在40 kDa处较野生型明显分泌增多的主要是纤维素酶和半纤维素酶类(图3)。

表1 特异腐质霉纤维素酶和半纤维素酶的理论分子量Table 1 Theoretical molecular weight of cellulases and hemicelluloses of H. insolens.
与传统物理、化学诱变方法相比,T-DNA插入突变的最大优点在于便于对插入破坏的基因及其侧翼序列进行鉴定分析[26]。TAIL-PCR克隆得到T53菌株中的T-DNA插入位点,位于一个可能的真菌C2H2锌指蛋白类转录因子编码基因(命名为HicelR1)启动子区域。这表明,HicelR1很可能调控了特异腐质霉中纤维素酶基因的表达。已有研究发现,HicelR1的同源蛋白参与了生物体的多种重要生命活动,如人类Krueppel-like因子参与了肺炎球菌感染期间抗炎细胞因子白细胞介素(IL)-10的表达调控过程[31]、酿酒酵母金属硫蛋白表达激活剂可以诱导金属硫蛋白基因CUP1的转录[32]、裂殖酵母中转录调节因子Prz1在质膜钙泵Pmc1的表达过程中具有重要的调节作用[33],但尚未见其调控纤维素酶表达的报道。我们推测HicelR1很可能通过一种全局性调控模式参与了特异腐质霉纤维素酶和半纤维素酶的表达调控。
突变株T53的筛选以及突变位点的鉴定研究,不仅为我们阐明突变菌株T53纤维素酶和半纤维素酶的产量提高的分子机理奠定了重要基础,也为我们研究纤维素酶合成的复杂调控机制提供了重要参考。这将进一步丰富我们对木质纤维素酶表达调控机制的认识,也为进一步改良菌株和构建高效的异源蛋白表达系统提供了重要的理论基础。
