中华根瘤菌NP1中反硝化基因启动子分析及荧光定量PCR验证
2019-04-01陈度宇
张 宇, 王 森, 陈度宇, 许 雷
中国农业科学院研究生院, 北京 100081
好氧反硝化菌是一类在有氧条件下能够进行脱氮反应的异养微生物,自Robertson和Kuene[1]在20世纪80年代发现了好氧反硝化菌Thiosphaerapantotropha、Pseudomonassp.和Alcaligenesfaecalis等之后,此类脱氮菌被陆续报道。迄今为止,已从各种环境中筛选得到许多不同种属的具有好氧反硝化功能的菌株,如在废水处理系统中分离获得施氏假单胞菌PseudomonasstutzeriSU2[2]、在稻田沉积物中分离获得反硝化产碱菌AlcaligenesdenitrificansT25[3]以及在粪便处理系统中分离获得枯草芽胞杆菌Bacillussubtilis[4]等。
在好氧条件下,反硝化作用主要涉及4个关键酶, 分别是周质硝酸盐还原酶NAP、亚硝酸盐还原酶NIR、一氧化氮还原酶NOR和氧化亚氮还原酶NOS。周质硝酸盐还原酶NAP在好氧时表达占主导,能将硝酸盐还原为亚硝酸盐,亚硝酸盐还原酶再将亚硝酸盐转化为NO气体,一氧化氮还原酶对NO具有较高的亲和力,能够将NO还原为N2O,最后氧化亚氮还原酶能将NO、N2O两种气体同时还原为N2。
目前,好氧反硝化菌广泛应用于废水生物处理池作用于废水生物脱氮[5],使硝化与反硝化在同一个反应器中进行,进而大量减少了占地面积,降低成本。然而,大气中的N2O浓度持续上升,其中很大一部分来自微生物。目前对于N2O生成的机理及原因的认识还不够全面。一种观点认为氧气浓度会影响N2O还原酶的活性,低溶解氧条件下N2O会取代N2成为反硝化的最终产物[6]。还有观点认为C/N、DO浓度、SRT(污泥停留时间) 都会影响N2O的累积,导致释放量增加[7]。
按照控制转录水平的高低,启动子可以分为强启动子和弱启动子。启动子在转录水平上起到重要作用,不仅决定了基因的表达水平,而且决定了基因表达的时空顺序[8~10],启动子作为指导基因起始转录的重要顺式元件,在很大程度上决定了基因的转录速率,从而影响基因的表达效率[11,12]。
本文对中华根瘤菌NP1中反硝化关键酶基因的启动子进行生物信息学分析,初步预测了反硝化基因启动子的强弱,进一步利用荧光定量PCR对中华根瘤菌NP1反硝化基因的相对转录水平差异进行比较,最后通过直接测量反硝化过程中相关代谢产物的含量进行验证,从而为揭示反硝化过程中N2O的释放提供了一种合理解释。
1 材料与方法
1.1 启动子序列分析
从中华根瘤菌NP1的全序列中获得周质硝酸盐还原酶NAP、亚硝酸盐还原酶NIR、一氧化氮还原酶NOR和氧化亚氮还原酶NOS基因的转录起始位点上游3 000 bp至转录起始位点下游的+1 000 bp序列,共计4 000 bp的这段序列包含潜在的基因启动子序列。综合利用BPROM(http://www.softberry.com/berry.phtml)、Tfsitescan(http://www.ifti.org/cgi-bin/ifti/Tfsitescan.pl)、NNPP(Neural Network Promoter Prediction,http://www.fruitfly.org/seq_tools/promoter.html)等启动子预测网站,通过在线分析得到预测的nap、nir、nor和nos4个基因的启动子序列位置及相关转录因子序列。
1.2 供试菌株
Sinorhizobiumsp. NP1为本实验室保存。
1.3 培养基
反硝化培养基:KNO30.72 g/L,琥珀酸钠2.17 g/L,维氏盐溶液50 mL/L,pH 7.0~7.5。
维氏盐溶液:K2HPO45 g/L,NaCl 2.5 g/L,MgSO42.5 g/L,FeSO40.05 g/L,MnSO40.05 g/L。
1.4 试剂
细菌RNA小提试剂盒购自OMEGA公司、SYBR©Premix ExTaqTM(Perfect Realtime)和PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real-time) 均购自TaKaRa公司。引物合成为上海生工生物技术有限公司完成。Realtime-PCR反应八连管及管盖购自美国Axygen公司。
1.5 生长曲线的测定
将单菌落接种于20 mL以KNO3为单一氮源的反硝化培养基中,每隔3 h取样,使用分光光度计测定OD600值,绘制36 h内NP1的生长曲线。
1.6 总RNA的提取及cDNA的合成
将NP1单菌落接种于20 mL反硝化培养基中,30℃ 180 r/min震荡培养至OD600约为1.5 h,按1%的接种量接种于新的20 mL反硝化培养基中,培养20 h和30 h后分别取1 mL菌液10 000 r/min离心2 min收集菌体,使用RNA提取试剂盒提取RNA,提取的RNA进行琼脂糖凝胶电泳检测。使用RNA反转录试剂盒将提取的RNA反转录合成cDNA。
1.7 荧光定量PCR反应检测
根据NP1菌株的4个反硝化基因序列设计其Realtime-PCR特异引物,包括周质硝酸盐还原酶基因nap(登录号:KR902902)、亚硝酸盐还原酶基因nir(登录号:FJ598613)、一氧化氮还原酶基因nor(登录号:KR902903)、氧化亚氮还原酶基因nos(登录号:KR080373),采用16S rRNA为内标基因,所用引物见表1。
荧光定量PCR的反应混合液(25 μL):12.5 μL SYBR©Premix ExTaqⅡ染料,1μL引物F,1μL引物R,2μL模板cDNA和8.5μL双蒸水。 PCR 循环条件为:95℃预变性2 min;95℃ 5 s,60℃ 30 s,40个循环。
为减少实验差异,内标基因与目的基因每个样品分别设3个平行重复,试验结果取平均值。采用相对定量方法[13]表示各目的基因nap、nir、nor、nos的表达量。计算ΔCt=Ct目的基因-Ct内参基因和ΔΔCt=ΔCt待测组-ΔCt对照组,2-ΔΔCt即表示目的基因相对于对照基因的表达倍数[14]。测定以KNO3为单一氮源培养20 h和30 h后的NP1菌样中相关反硝化基因转录水平的相对量进行验证,其中每个样品相关基因转录水平的变化以20 hnor基因的转录水平作为对照来表示。


1.10 N2O气体含量的测定
N2O气体含量测定采用气相色谱法[18]。将1 mL菌液接种于含有100 mL反硝化培养基的250 mL锥形瓶中,瓶口用灭过菌的橡胶塞塞紧,保持装置气密性良好,摇床30℃ 180 r/min震荡培养,一段时间后采用5 mL注射器抽取锥形瓶内的气体注入气相色谱仪的进样口。N2O的测定采用气相色谱仪(Agilent 7890),进样口温度120℃,检测器温度280℃,以纯度为99.99%,流速为30 mL/min的高纯氮气作为载气,保留时间2 min[19]。

表1 荧光定量PCR所用引物序列Table 1 Primer sequences for real-time PCR.
2 结果与分析
2.1 中华根瘤菌NP1反硝化基因启动子分析
BPROM细菌启动子预测程序能够预测由Sigma70启动子调控的细菌基因的潜在转录起始位置,启动子识别的准确性约为80%,同时预测到-10区和-35区启动子核心序列相应的间隔碱基数分布信息,并给出了对应的线性判别函数(linear discriminant function,LDF)预测得分。
中华根瘤菌NP1反硝化基因的启动子区预测结果见图1。结果表明,硝酸盐还原酶基因、亚硝酸盐还原酶基因、一氧化氮还原酶基因和氧化亚氮还原酶基因分别使用各自的启动子,即4个反硝化基因并不位于同一个操纵子,而是分别行使功能。涉及的每个启动子的强度如表2所示,可以看出,nap和nir基因的启动子强度相对更高,据此猜测,周质硝酸盐还原酶和亚硝酸盐还原酶的表达量要高于一氧化氮还原酶和氧化亚氮还原酶,并在后续实验中进行验证。

图1 Sinorhizobium sp. NP1反硝化基因启动子预测图示Fig.1 The predicted promoters annotation of Sinorhizobium sp. NP1 denitrifying genes.

基因-35区-10 区启动子效率napTCGTCACCGTATAAT83%nirTTGAAACTTTATAAT91%norTTGTCGGGCTGTCAT66%nosTTCTCGCGCTCTACT58%
2.2 菌株NP1生长曲线
通过1.5中的方法测定菌株NP1的生长曲线,结果如图2所示,菌株NP1在反硝化液体培养基中生长较为缓慢,12 h后进入对数生长期,对数生长期持续时间较长, 24 h后进入平台生长期,达到最大OD600值约1.5。
2.3 荧光定量PCR检测反硝化基因的表达差异
通过1.6中的方法,提取NP1菌株的总RNA,结果如图3所示。对提取出的总RNA进行反转录, 用1.7中的方法对反转录得到的cDNA进行荧光定量PCR。

图2 菌株NP1生长曲线Fig.2 The growth curve of stain NP1.

图3 RNA提取电泳图Fig.3 Agarose gel electrophoresis of RNA extraction.
通过荧光定量PCR技术,采用相对定量方法分析中华根瘤菌NP1的4个反硝化基因nap、nir、nor、nos在不同时期表达水平的差异,每个基因的扩增曲线均为典型的S型曲线,溶解曲线主峰单一且无杂峰,排除了非特异性扩增,经2-△△Ct法对目的基因做相对定量分析后结果如图4所示。可以从中看出,在以KNO3为单一氮源的培养条件下,无论在20 h对数期还是在30 h平台期,4个反硝化关键基因的表达并不同步。周质硝酸盐还原酶基因和亚硝酸盐还原酶基因的转录水平明显高于一氧化氮还原酶基因和氧化亚氮还原酶基因,前者比后者的表达量高出将近一倍,这将导致氧化亚氮还原酶无法将全部NO和N2O还原为N2,造成N2O气体的残留并释放到大气中污染环境。
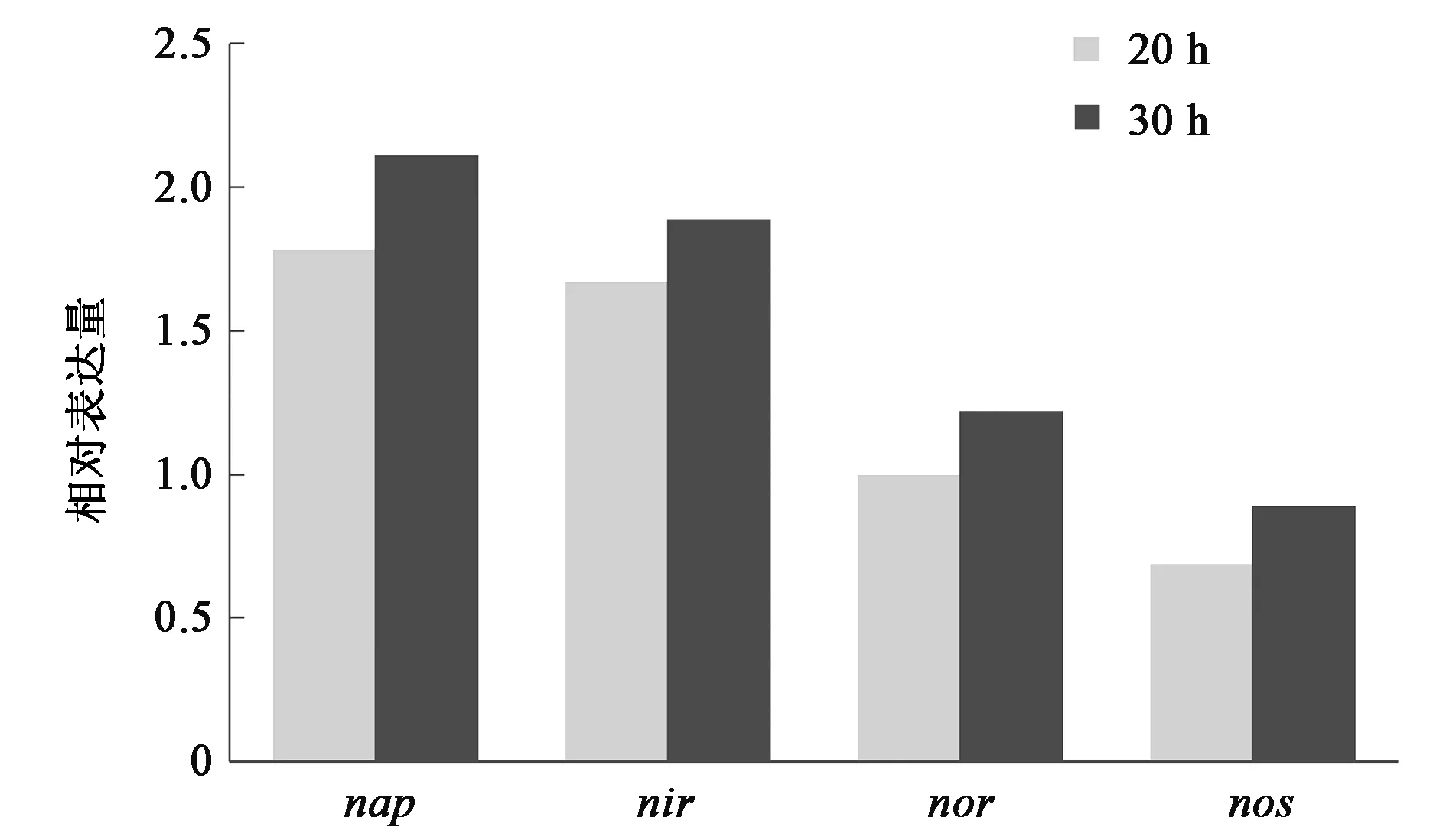
图4 NP1菌株不同时期反硝化基因的表达差异Fig.4 Expression differences of denitrifying genes in different stages of NP1.
2.4 NP1菌株反硝化代谢产物分析
以KNO3为单一氮源培养NP1菌株,对其反硝化产物进行测定,结果如图5所示,从图5中可以看出反硝化过程主要发生在生长旺盛的5~15 h,曲线较陡表示硝态氮浓度有明显变化,在前20 h硝态氮浓度随着时间增加而减少,之后趋于稳定,硝态氮浓度在30 h内从初始200.00 mg/L下降到97.31 mg/L,下降很快,证明NP1菌株中周质硝酸盐还原酶活性较高。

图5 以KNO3为单一氮源培养NP1菌株时硝态氮消耗情况Fig.5 Nitrate consumption in NP1 cultured with KNO3 as a single nitrogen source.
如图6所示,亚硝态氮随着硝态氮的减少而逐步积累,当硝态氮反应完全时,亚硝态氮在15 h达到最大积累量仅为0.305 mg/L,之后缓慢下降,亚硝态氮积累逐步降低。亚硝态氮产生量极低说明亚硝酸盐还原酶活性很高,并未造成亚硝态氮的大量积累。

图6 以KNO3为单一氮源培养NP1菌株时亚硝态氮的积累情况Fig.6 Nitrite accumulation in NP1 cultured with KNO3 as a single nitrogen source.
由图7可知,NP1菌株反硝化过程中N2O的产生量随着时间延长而快速增加,最大积累量达到274 μg/m3,之后达到平稳。说明NO还原酶的活性较低,使得还原产物N2O气体产生积累,相当一部分N2O没能反应完全至生成N2。

图7 以KNO3为单一氮源培养N2O菌株时硝态氮的积累情况Fig.7 N2O accumulation in NP1 cultured with KNO3 as a single nitrogen source.
3 讨论
从图1可以看出在NP1菌株中反硝化基因使用的不是同一个启动子,这与传统理论中认为细菌的4个反硝化基因由同一个启动子调控不同,表2的启动子强度分析表明在nap和nir基因发挥功能后,由于nor和nos基因的启动子强度较弱,导致N2O和NO气体在还原为N2前被释放。这一发现解释了NO2和NO气体的释放机理,进而为解决这一环境问题提供了理论依据。
通过荧光定量PCR对中华根瘤菌NP1的反硝化相关基因转录水平的差异进行了比较,结果证明在NP1反硝化过程中,一氧化氮还原酶基因和氧化亚氮还原酶基因的表达量低于周质硝酸盐还原酶基因和亚硝酸盐还原酶基因,进而在分子水平验证了反硝化基因的不同步表达,也证明了上述对于反硝化基因启动子强度的预测合理。同时对反硝化中间代谢产物含量的测定也表明,以KNO3为单一氮源培养NP1时,确实有一定量的N2O气体释放,推测是由于氧化亚氮还原酶基因的启动子较弱,致使其表达量降低,无法将产生的全部N2O还原,使其释放到空气中造成污染。
1992年,Khalil等[20]对N2O的全球产生源估测研究中表明每年污水处理过程中释放约0.3~3.0 Tg,占N2O总释放量的2.5%~25%。2009年,Kampschreur等[21]研究实验室规模的脱氮过程发现最高有近90%的氮转化为N2O释放,研究实际规模的污水脱氮过程发现最高近14.6%的氮转化为N2O。Tsuneda等[22]研究实验室规模的利用硝化活性污泥处理人工污水时发现N2O的释放量占总氮的0.7%~13%。
调查表明N2O的温室效应约是CO2的300倍[21],N2O的释放量正在以每年3%的速度持续上升,对于全球温室效应的贡献率已达5%~6%[23]。N2O的大量释放会引起酸雨,破坏臭氧层[24]。因此,在利用微生物进行污水处理的过程中N2O的释放应引起足够的重视。在反硝化过程中,N2O作为中间产物出现,通常认为其是不完全反硝化作用的产物[25]。
通过上述分析,未来可以采用基因工程的手段改造反硝化相关酶的表达从而减少N2O的释放,将硝酸盐还原酶、亚硝酸盐还原酶、一氧化氮还原酶、氧化亚氮还原酶串联在受同一个强启动子调控的操纵子上,在亚硝酸盐还原为NO和N2O后直接还原为无害的N2释放到空气中。同时也提供了一种筛选高效固氮菌的重要参考指标,以获得释放少量N2O的固氮菌。综上,降低N2O排放到环境中引起的二次污染,减少温室效应,建立更加高效绿色的污水脱氮工艺,同时有效控制温室气体的排放,具有重大的社会、环境和经济意义。
